ОТЧЁТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №12
Исследование эффекта Джоуля-Томсона при адиабатическом истечении газа.
| Физика |
По дисциплине __________________________________________________________
________
(наименование учебной дисциплины согласно учебному плану)
| ИВМ-12 |
| Задорожная И.Д. |
Автор: студент гр. ________ ____________________ /________________/
(подпись) (Ф.И.О.)
ОЦЕНКА: _____________
Дата: ___________________
ПРОВЕРИЛ
| Смирнова Н.Н. |
| доцент |
Преподаватель ___________ ________________ /________________/
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2012 год
Цель работы – исследовать эффект Джоуля-Томсона при протекании углекислого газа через пористую перегородку, определить возникающую при этом разность температур при различных начальных значениях давления и температуры;
Вычислить по результатам опытов значение коэффициентов уравнения Ван-дер-Ваальса, значение температуры инверсии и критической температуры для углекислого газа.
Краткое теоретическое содержание:
Исследуемое явление: изменение температуры реального газа при медленном его течении по трубке с пористой перегородкой (дросселе) под действием постоянного перепада давления, без теплообмена с окружающей средой.
Реальный газ – газ свойства, которого существенно зависят от взаимодействия его частиц (молекул, атомов).
Уравнение Ван-дер-Ваальса - уравнение для количественного описания свойств реальных газов.
Для одного моля газа объемом V при температуре Т и давлении р, уравнение Ван-дер-Ваальса имеет вид:
(p+a/Vm 2)(Vm - b) = RT,
где: R — газовая постоянная, R=8,31 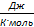
a (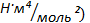 и b(
и b(  — экспериментальные константы, учитывающие отклонение свойств реального газа от свойств идеального газа.
— экспериментальные константы, учитывающие отклонение свойств реального газа от свойств идеального газа.
Член a/V2 имеет размерность давления и учитывает притяжение между молекулами газа, которое приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема.
рвн = a/Vm2
b является поправкой на собственный объем молекул газа и учитывает отталкивание молекул на близких расстояниях.
Адиабатический процесс -термодинамический процесс в макроскопической системе, при котором система не обменивается тепловой энергией с окружающим пространством.
Температура инверсии – температура, при которой коэффициент Джоуля –Томсона меняет знак, проходя через нулевое значение.
Tинв =  ;
;
Эффект Джоуля – Томсона - явление изменения температуры реального газа при его медленном адиабатическом течении по трубке с пористой перегородкой.
Величина эффекта Джоуля-Томсона определяется по разности температуры газа до, и после перегородки. Физическая причина изменения температуры – «трение» газа в дросселе, следовательно, изменение температуры справедливо только для реальных газов, молекулы которого взаимодействуют между собой. Эффект Джоуля-Томсона демонстрирует отличие исследуемого газа от идеального
Коэффициент Джоуля-Томсона – величина, показывающая, на сколько градусов меняется температура данного газа при его медленном теченеии под действием постоянного перепада давления в 1МПа.

Если при протекании газа через пористую перегородку температура возрастает (µ<0), то эффект называют отрицательным, и наоборот, если температура убывает (µ>0), то процесс называют положительным. Температура, при которой µ меняет знак, называется температурой инверсии.
В данной работе по экспериментальным результатам оценивается коэффициент теплового расширения, постоянные в уравнении Ван-дер-Ваальса и температура инверсии углекислого газа.
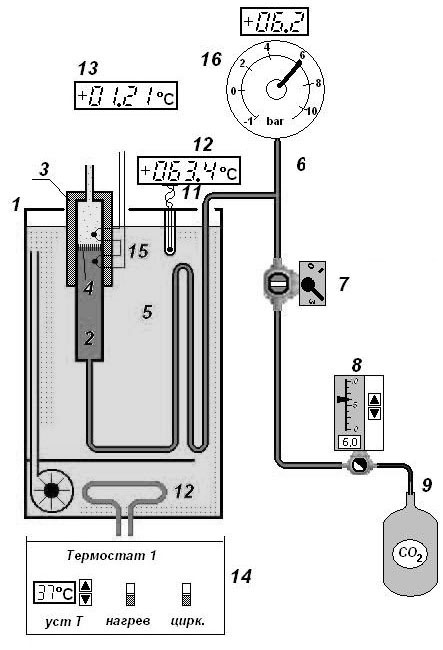
Схема установки
Основным элементом установки является трубка 3 с пористой перегородкой 4, через которую пропускается исследуемый газ. Трубка сделана из материала, обладающего малой теплопроводностью. Пористая перегородка 4 расположена в конце трубки и представляет собой стеклянную пористую пробку со множеством узких и длинных каналов. Пористость и толщина пробки подобраны так, чтобы обеспечить оптимальный поток газа при перепаде давлений до 10 атм.; при этом в результате эффекта Джоуля-Томсона создается достаточная разность температур. Газ поступает в трубку из теплообменника 5, в котором нагревается до температуры воды в термостате. Температура воды измеряется термопарой 11 и отображается на индикаторе 12, разность температур до и после перегородки измеряется дифференциальной термопарой 15 и отображается на индикаторе 13.
Газ поступает в систему из баллона 9 через редуктор 8, который позволяет регулировать давление газа в магистрали 6. Кран 7 позволяет перекрыть поток газа, давление контролируется манометром 16.
Расчетные формулы:
Коэффициент теплового расширения газа µ
µ =  ;
;
где:ΔТ- разность температур до и после перегородки,ΔР- разность давления газа до и после перегородки.
 ;
;
где: R - газовая постоянная, a и b - экспериментальные константы, учитывающие отклонение свойств реального газа от свойств идеального газа, Ср – молярная теплоемкость газа.
Экспериментальные константы уравнения Ван-дер-Ваальса - a и b
a =  ;
;
b =  ;
;
где:µ₁- коэффициент теплового расширения газа, рассчитанный для температуры t₁, µ₂- коэффициент теплового расширения газа, рассчитанный для температуры t₂,




