Основным законом химической кинетики является постулат, вытекающий из большого числа экспериментальных данных и выражающий зависимость скорости реакции от концентрации реагентов. Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени (закон действующих масс).
Для реакции

| (5.3) |
скорость процесса по каждому из реагирующих веществ определяется следующим образом:
 (5.4)
(5.4)
где k – константа скорости реакции.
Физический смысл k легко установить, приняв CA = CB = 1 моль/л. Тогда ω = k, т. е. константа скорости равна скорости реакции при концентрации реагирующих веществ равных единице.
Выражение (5.4) есть математическая формула, связывающая скорость реакции с концентрациями. Она называется кинетическим уравнением.
При изучении кинетики химические реакции классифицируют по молекулярности и порядку. Молекулярностью реакции называется число частиц, принимающих участие в одном элементарном акте химического превращения. Реакции бывают мономолекулярными, бимолекулярными, реже тримолекулярными.
Порядок реакции n равен сумме показателей степеней концентраций всех реагентов, которые входят в кинетическое уравнение для скорости реакции. Для реакции (5.3) (согласно уравнению (5.4)) порядок реакции будет следующий:

| (5.5) |
Показатель степени, в которой концентрация вещества входит в кинетическое уравнение, называется порядком реакции по данному веществу. Для элементарной реакции (5.3) a и b являются частными порядками по веществу A и B. Порядок реакции совпадает с молекулярностью, если она протекает за один элементарный акт.
Порядок реакции может быть положительным, целым, дробным и нулевым. В зависимости от этого выражение для константы скорости будет различным.
Каждый тип реакции описывается определенным кинетическим уравнением, связывающим концентрации со временем.
Для реакции нулевого порядка (n =0)
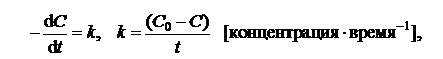
| (5.6) |
где С0 – исходная концентрация реагента; С – концентрация реагента в момент времени t.
Большинство известных реакций нулевого порядка представляют собой гетерогенные процессы, например, разложение на платиновой проволоке оксида азота (I)
или аммиака

|
Для реакции первого порядка (n =1) типа А → продукты кинетическое уравнение и выражение для константы скорости 1-го порядка имеют вид:

| (5.7) |
Время, за которое исходная концентрация вещества уменьшается наполовину, называется периодом полураспада (τ). Для реакций первого порядка период полураспада
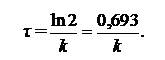
| (5.8) |
Таким образом, в реакциях первого порядка, время полураспада не зависит от количества исходного вещества, следовательно, за единицу времени распадается одна и та же часть вещества независимо от исходной концентрации. Так, если в первые 15 мин в реакцию вступило 5 % взятого вещества, то за следующие 15 мин распадутся еще 5 % оставшегося.
Примером необратимых реакций 1-го порядка служит разложение диметилового эфира

|
или разложение азометана
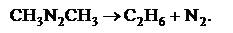
|
Для реакций второго порядка (n =2) типа А + В → продукты закон действующих масс запишется:

| (5.9) |
При решении уравнения (5.9) различают два случая:
1) начальная концентрация реагентов одинакова: С0А = С0В=С0. Кинетическое уравнение имеет вид

| (5.10) |
Решение этого уравнения дает выражение для константы скорости 2-го порядка:

| (5.11) |
Период полураспада веществ А и В одинаков и равен:

| (5.12) |
К реакциям данного типа относятся:
газофазное разложение иодоводорода

|
или разложение оксида азота (IV)

|
2) начальная концентрация веществ А и В различна: С0А ≠ С0В.
В этом случае решение уравнения (5.9):

| (5.13) |
Периоды полураспада исходных веществ будут различными:

|
Этот случай реализуется в следующих реакциях.
Газофазное образование иодоводорода

|
Омыление этилацетата раствором гидроксида натрия

|
Для того чтобы определить такой важный параметр химической реакции, как константа скорости, необходимо предварительно установить порядок реакции, который в отличие от молекулярности является величиной формальной и его нельзя предсказать даже для реакций, сходных между собой. Для определения порядка реакции необходимо иметь экспериментальные данные об изменении концентрации реагирующих веществ во времени.




