ВСТУП
Складання методичних рекомендацій для виконання лабораторних робіт з курсу «Мікробіологія» засновано перш за все на тому, що комерційна діяльність в галузі торгівлі в ринкових умовах неможлива без знання основ мікробіології продовольчих товарів, біотехнології харчових виробництв, заходів запобігання пошкодження товарів під час зберігання і реалізації споживачам.
Методичні рекомендації розроблені згідно робочим програмам дисципліни «Мікробіологія» і включають найбільш важливі теми, які повинні бути практично закріплені студентами на лабораторних роботах.
Велика увага в методичних рекомендаціях приділена методам кількісного визначення мікроорганізмів в зовнішньому середовищі|середі|, санітарно-мікробіологічним дослідженням в торгових|торгівельних| підприємствах і оцінці якості харчових продуктів за мікробіологічними показниками.
Вивчення матеріалу проводиться в певній послідовності, при якій теоретичні знання закріплюються лабораторною роботою.
Метою лабораторних робіт є закріплення на практиці і поглиблення теоретичних знань, одержаних при прослуховуванні лекційного курсу і в процесі самостійної підготовки.
Надбання практичних навичок при виконанні лабораторних робіт з дисципліни «Мікробіологія» передбачає освоєння студентами:
- основ мікробіології виробництва та споживання продукції;
- особливостей роботи з нормативно-технічною документацією;
- визначення якості та безпеки товарів народного споживання та продовольства за мікробіологічними показниками;
- вміння робити висновки про стан продукції, яка контролюється та визначення шляхів її подальшого використання.
Дані методичні рекомендації містять зміст роботи, коротке теоретичне пояснення по темі, опис методик виконання робіт, контрольні питання.
Позааудіторная самостійна робота студентів повинна включати підготовку до лабораторних робіт, виконання індивідуальних завдань та|задавань| самостійне вивчення окремих теоретичних розділів.
Успішна робота з раціоналізації харчових виробництв, підвищення якості продукції та оптимізації торговельних процесів можлива тільки|лише| через ґрунтовне вивчення|із| умов прояву|вияву| життєдіяльності мікроорганізмів.
Мікробіологічний контроль на виробничому або торговельному підприємстві є|з'являється| найбільш ефективним засобом|коштом| для оцінки його санітарного стану|достатку|, попередження|попереджувати| порушень виробничого і санітарного режимів, а також виявлення санітарно-небезпечного моменту на будь-якому етапі життєвого циклу товару і попередження|попереджувати| можливого збитку|шкоди|. Вивчення мікробіології дає майбутньому товарознавцю-комерсанту знатися на виробничому процесі, відноситися критично до різних заходів щодо раціоналізації, орієнтує на високий санітарний стан|достаток| виробництва і умов торгівлі.
ЛАБОРАТОРНА РОБОТА № 1
Правила роботи в мікробіологічній лабораторії. Будова оптичного мікроскопу і техніка мікроскопії
Зміст роботи:
1. Правила роботи в мікробіологічній лабораторії.
2. Правила надання невідкладної медичної допомоги в лабораторії.
3. Будова оптичного мікроскопу.
4. Техніка мікроскопії.
1. Правила роботи в мікробіологічній лабораторії
Мікробіологічні дослідження здійснюються в спеціально оснащених приміщеннях - мікробіологічних лабораторіях. Більшість мікробіологічних аналізів проводяться в стерильних умовах для виключення забруднення досліджуваного матеріалу, а також попередження забруднення зовнішнього середовища і персоналу мікробами з досліджуваного матеріалу.
Правила роботи студентів в лабораторії:
1. Кожен студент має в лабораторії постійне місце роботи.
2. Забороняється входити в лабораторію у верхньому одязі, головному уборі, працювати дозволяється тільки в чистих білих халатах, волосся у студенток повинні бути підібраними і не спадати на плечі.
3. Забороняється на робоче місце класти сторонні речі (у тому числі сумки, головні убори тощо).
4. Під час роботи слід менше ходити, відкривати і закривати двері, щоб не допустити забруднення досліджуваного матеріалу сторонньою мікрофлорою.
5. Категорично забороняється в лабораторії палити і приймати їжу, торкатися брудними руками обличчя.
6. Під час роботи з культурами мікроорганізмів необхідно виконувати всі правила мікробіологічної техніки. Запалювати спиртівки виключно сірниками.
7. На пробірках і чашках Петрі відзначати прізвище та ініціали, номер групи, дату і мету посіву.
8. Усі предмети, які використовувалися під час роботи з живими культурами мають бути знезаражені над полум'ям спиртівки (петлі, голки) або занурені в дезінфікуючий розчин (предметні скельця, піпетки, шпателі тощо).
9. Наприкінці заняття на робочому місці слід прибрати і обов'язково вимити руки з милом.
2. Правила надання невідкладної медичної допомоги в лабораторії
1. При пораненні склом видалити|знищувати| його осколки з|із| рани; якщо їх не залишилося, змазати|змазати| рану йодом і забинтувати.
2. При термічних опіках першого і другого ступеня обпалене місце|місце-милю| промити струменем холодної води, а потім - 2%-вим| розчином харчової соди або 5%-вим| розчином перманганату калію. Як примочку можна використовувати 96%-вий| етиловий спирт, який дезінфікує і знеболює.
3. При опіках кислотами уражене місце|місце-милю| промити холодною водою, а потім на обпалене місце|місце-милю| покласти примочку з|із| 2%-вого| содового розчину.
4. При опіках лугами уражене місце|місце-милю| промити холодною водою і на обпалене місце|місце-милю| покласти примочку із|із| слабкого|слабого| розчину оцтової|оцтової| кислоти.
5. При отруєнні газом постраждалого| вивести на свіже повітря і негайно викликати|спричиняти| швидку допомогу.
3. Будова оптичного мікроскопу
Біологічний мікроскоп (рис. 1) складається змеханічної і оптичної частин.
Механічна частина включає:
- штатив, який складається з основи (9) та тубусотримача (13);
- тубус (2), розташований у верхній частині тубусотримача;
- револьвер (3) - пристрій, який складається з двох пластин: нерухомої та рухомої, на якій в гніздах закріплюються об'єктиви;
- предметний столик (5) із затискувачами для закріплення препарату. У центрі столика є отвір для проходження світла. З обох боків столика знаходяться гвинти, за допомогою яких можна пересувати столик і відповідно препарат на ньому у взаємоперпендикулярних напрямах;
- макрометричний гвинт (12) знаходиться на тубусотримачі з обох боків і служить для швидкого пересування тубуса, а також для грубого фокусування, тобто знаходження зображення;
- мікрометричний гвинт (11) знаходиться на основі штатива з обох боків і служить для точного фокусування, тобто встановлення чіткості зображення. В деяких моделях мікроскопа мікрогвинт знаходиться на штативі нижче макрогвинта;
- гвинт конденсора (10) знаходиться лише справа під предметним столиком і забезпечує розташування конденсора на необхідній висоті.
Оптична частина мікроскопа включає:
- окуляр (1) - це дві лінзи в оправі, що знаходяться у верхній частині тубуса. Збільшення окуляра зазначається на оправі (найчастіше може бути 7х, 10х, 15х).
- об'єктив (4) - система лінз в оправі. Розрізняють сухі об'єктиви (лінза знаходиться на деякій відстані від препарату), які дають мале (у 8, 9, 10 разів) і середнє (у 20, 40 разів) збільшення та імерсійні (між фронтальною лінзою і препаратом знаходиться імерсійна олія), які дають велике збільшення (у 90 разів і більше). Загальне збільшення мікроскопа дорівнює множенню збільшення окуляра на збільшення об'єктива. Наприклад, 15 х 8 = 120 разів, 15 х 40 = 600 разів.

|
Рисунок 1 – Пристрій біологічного мікроскопу:
1 – окуляр, 2 – тубус, 3 – револьвер, 4 – об’єктив, 5 – предметний столик,
6 – конденсор, 7 – лампочка з колекторною лінзою, 8 – ірисова діафрагма,
9 – основа, 10 – гвинт конденсора, 11 – мікрометричний гвинт,
12 – макрометричний гвинт, 13 – тубусотримач
- джерело світла - лампочка, яка вмонтована в оправу з колекторною лінзою, знаходиться в основі штативу (7). В деяких моделях мікроскопів може бути двостороннє дзеркало (з одного боку воно плоске, а з іншого - вигнуте). Дзеркало легко повертається і з його допомогою промені направляються від джерела світла до конденсора;
- конденсор (6) - система лінз, яка знаходиться під предметним столиком і збирає паралельні промені, які йдуть від освітлювача або дзеркала. Конденсор оснащений ірисовою діафрагмою (8), за допомогою якої можна регулювати інтенсивність освітлення препарату. Гвинт конденсора (10) дозволяє розташовувати його на необхідній висоті.
4. Техніка мікроскопії
1. Встановлюють світло. Для цього мікроскоп вмикають в електричну мережу, конденсор підіймають вгору, відкривають діафрагму. Якщо мікроскоп не електричний, то знімають окуляр, спостерігають прямо в об’єктив і встановлюють дзеркало таким чином, щоб джерело світла було видно всередині об’єктива. За допомогою дзеркала і діафрагми конденсора встановлюють бажану ступінь освітлення.
2. На предметному столику закріплюють предметне скло з приготовленим заздалегідь препаратом.
3. Встановлюють необхідний для роботи об’єктив на оптичну вісь з окуляром (шляхом обертання рухомої частини револьверного пристрою за годинниковою стрілкою до звуку клацання фіксатора).
4. Дивлячись збоку на об'єктив за допомогою макрогвинта опускають тубус на певну відстань між фронтальною лінзою об'єктива і препаратом (для об. 9х - на 1,0 см, для об. 40х па 0,1 см, для об. 90х - занурюють у краплю імерсійної олії, попередньо нанесену на препарат).
5. Дивляться в окуляр, повільно піднімають тубус макрогвинтом і знаходять зображення (грубе фокусування).
6. За допомогою мікрогвинта встановлюють чіткість зображення (точне фокусування).
7. Після закінчення роботи з мікроскопом вимикають шнур з електромережі, піднімають тубус до крайнього верхнього положення, знімають з предметного столика препарат і обережно протирають імерсійний об'єктив сухою марлевою серветкою (не слід протирати лінзу ксилолом, тому що він розчиняє канадський бальзам, яким зміцнюють лінзи об’єктива). Відпрацьовані предметні скельця складають у спеціальні ванночки з дезінфікуючим розчином.
Завдання:
1. Ознайомитися з правилами роботи в мікробіологічній лабораторії.
2. Ознайомитися з правилами надання|виявлення| невідкладної медичної допомоги в лабораторії.
3. Ознайомитися з будовою оптичного мікроскопу, схематично замалювати його в лабораторному зошиті.
4. Записати і вивчити етапи техніки мікроскопування препаратів.
Питання для самоконтролю:
1. Які правила необхідно виконувати при роботі в мікробіологічній лабораторії?
2. З|із| яких частин|часток| складається мікроскоп?
3. Як користуватися макро- і мікрогвинтами? Яке їх призначення?
4. Як регулюють ступінь освітлення препарату?
5. Що таке сухі і імерсійні об'єктиви?
6. Чому дорівнює загальне|спільне| збільшення мікроскопа?
7. Навіщо і як використовують кедрову олію|мастило| при роботі з|із| імерсійним об'єктивом?
ЛАБОРАТОРНА РОБОТА № 2
Техніка приготування препаратів і методи фарбування мікроорганізмів
Зміст роботи:
1. Техніка приготування препаратів для живих та неживих культур.
2. Методи фарбування мікроорганізмів.
1. Техніка приготування препаратів для живих та неживих культур
Для вивчення мікроорганізмів в живому стані використовують препарати «роздавлена крапля» і «висяча крапля», в неживому – фіксований препарат.
1.1. підготовка препарату «роздавлена крапля»
1. На чисте предметне|предметне| скло нанести|завдавати| краплю|краплину| дистильованої води.
2. Металеву петлю прожарити в полум’ї спиртівки, охолодити на повітрі і занурити|навантажити| в досліджувану суспензію, внести петлю з|із| невеликою кількістю мікроорганізмів в краплю дистильованої води|краплину|, обережно перемішати|перемішувати| вміст, рівномірно розповсюдити мазок бактерій по предметному склу і накрити покривним склом. Покривне скло накладають таким чином, щоб між ним і предметним склом не було міхурців повітря. Надлишок рідини, що виступає за край покривного скла, видаляють фільтрувальним папером.
3. Розглянути|розглядувати| препарат під мікроскопом при збільшенні 15x40. При детальнішому вивченні структури мікрооб'єкту вивчити його в імерсійному середовищі|середі|. Для цього на поверхню покривного скла нанести|завдавати| краплю|краплину| імерсійної олії|мастила| і занурити|навантажити| в нього об'єктив 90х|. Наприкінці|у кінці| роботи обов'язково протерти об'єктив бавовняною серветкою.
4. Замалювати форми досліджених мікроорганізмів.
1.2. підготовка препарату «висяча крапля»
1. Краї покривного скла акуратно змастити|змазати| вазеліном.
2. Невелику краплю|краплину| суспензії мікробних клітин|клітин| нанести|завдавати| на покривне скло і обережно накласти на нього предметне|предметне| скло з|із| ямочкою так, щоб крапля|краплина| вільно поміщалася в центрі поглиблення, але не| зливалася з|із| ним.
3. Препарат перевернути|перевертати| і розглянути|розглядувати| під мікроскопом при збільшенні 15x40 або 15x90.
4. Вивчити рух мікроорганізмів.
1.3. Підготовка фіксованого офарбованого препарату
1. Приготування мазка. Краплю готової мікробної суспензії розмазують по поверхні середньої частини предметного скла на площі 2 см2.
2. Підсушування мазка на повітрі. Щоб прискорити процес висушування препарат направляють під струмінь теплого повітря досить високо над полум'ям спиртівки, тримаючи скло мазком догори. Після сушіння мазка на поверхні скла залишається ледь примітний наліт.
3. Фіксація мазка. Через полум’я пальника проводять предметне скло 3-4 рази мазком догори. При цьому мікроби гинуть і прикріплюються до скла. Мертві клітини також краще забарвлюються фарбами.
4. Фарбування мазка. Існують позитивнийі негативний способи фарбування. При позитивному способі офарбовуються клітини мікроорганізмів. При негативному - фарба заповнює простір між клітинами, а мікроорганізми залишаються нефарбованими. Фарбування буває простим, коли використовується лише одна фарба протягом 1-3 хв. (наприклад, метиленовий синій або фуксин), і складним - при використанні двох і більше фарб (наприклад, за методом Грама). Для фарбування на мазок наносять необхідну фарбу, витримують декілька хвилин (за методикою), залишок фарби змивають водою і препарат промокають фільтрувальним папером або підсушують.
2. Методи фарбування мікроорганізмів
2.1. Фарбування живих клітин мікроорганізмів
1. До краплі|краплини| суспензії культури дріжджів на предметному |предметному|склі додати|добавляти| краплю|краплину| слабкого|слабого| розчину (1:1000) фарбника|барвника| (метиленового синього або фуксину), розмішати, потім накрити покривним склом.
2. Розглянути|розглядувати| препарат під мікроскопом при збільшенні 15x40.
3. Замалювати забарвлені|пофарбовані| клітини|клітини| культури дріжджів.
4. Відпрацьовані препарати живих|жвавих| мікроорганізмів помістити в посуд|посудину| з|із| дезінфікуючим розчином для знешкодження.
Простий метод фарбування
1. На предметне скло нанести краплю дистильованої води, внести до неї невелику кількість досліджуваного матеріалу мікробіологічною петлею, обережно розмішати і розмазати на площі 2-3 см2 тонким шаром.
2. Мазок висушити на повітрі або струмені теплого повітря над полум'ям пальника, тримаючи скло мазком вгору|угору|, потім охолоджений мазок зафіксувати в полум'ї пальника: стекло з|із| мазком, оберненим догори, провести 3-4 рази через полум'я. При цьому мікроорганізми гинуть, їх клітини|клітини| прикріпляються до скла, фарбування|пофарбування| поліпшується|покращується|.
3. Фіксований препарат помістити мазком догори на мікробіологічний "місток" над кристалізатором.
4. На мазок нанести|завдавати| фарбник|барвник|, який повинен покрити весь мазок. Фуксин витримати на препараті 1-2 хв.|мінути|, метиленовий синій - 3-5 хв|мінути|.
5. Злити залишки фарби|барви|, а препарат промити слабким|слабим| струменем води.
6. Висушити мазок на повітрі або обережно промокнути фільтрувальним папером.
7. На висушений препарат нанести|завдавати| краплю|краплину| імерсійної олії|мастила| або гліцерину і розглянути|розглядувати| під мікроскопом при збільшенні 15x90.
8. Замалювати офарбовані|пофарбовані| клітини|клітини| мікроорганізмів.
Складний метод фарбування (за Грамом)
Цей метод є однією з диференційних ознак при вивченні видової приналежності бактерій.
Суть|сутність| методу полягає в послідовному фарбуванні|пофарбуванні| двома фарбниками:|барвниками| генціан-віолетом і фуксином.
По методу Грама одні бактерії (коки, бацили, мікобактерії, клостридіальні бактерії) міцно забарвлюються генціанвіолетом| в синьо-фіолетовий колір|цвіт| (грампозитивні бактерії, гр+|). Здатність|здібність| грампозитивних бактерій утримувати генціановий| фіолетовий в комплексі з|із| йодом пов'язана з властивістю багатошарового| пептидоглікану| (основного компоненту клітинної стінки бактерій) взаємодіяти з|із| фарбником|барвником|. Окрім|крім| цього, подальша|наступна| обробка мазка бактерій спиртом викликає|спричиняє| звуження пір в пептидоглікані| і тим самим затримку фарбника|барвника| в клітинній|клітковій| стінці. Грамнегативні бактерії (гр.-|) (спірили, сальмонели, вібріони, псевдомонади, азотобактер, кишкова паличка), стінки яких містять|утримують| меншу кількість пептидоглікану|, після|потім| дії спиртом втрачають фарбник|барвник|, обезбарвлюються|знебарвлюють| і при обробці фуксином забарвлюються в червоний колір|цвіт|.
Етапи фарбування за Грамом:
1. Приготувати препарат і зафіксувати його (див. розділ 1.3).
2. Фіксований мазок накрити фільтрувальним папером і налити на нього невелику кількість генціан-віолету. | |барвника|
3. Через 2 хв|мінути| фільтрувальний папір зняти|сіяти| пінцетом, дистильованою водою змити фарбу|барву| і на препарат нанести|завдавати| розчин Люголя на 1-2 хв|мінути|. Залишок розчину злити.
4. Мазок занурити|навантажити| в розчин 96%-го| спирту на 30 сек|мінути|.
5. Промити мазок водою.
6. нанести на препарат водний розчин фуксину і залишити на 1 хв|мінуту|.
7. Промити препарат водою, промокнути фільтрувальним папером, нанести невелику краплю імерсійної олії і розглянути|розглядувати| під мікроскопом при збільшенні 15x90. Грампозитивні бактерії забарвлюються в синій колір|цвіт|, а грамнегативні - в рожевий|трояндовий|.
8. Замалювати грампозитивні і грамнегативні бактерії.
2.4. Фарбування спор бактерій
Спора - це клітина|клітина| бактерій, що покоїться, вона володіє високою стійкістю до фізико-хімічних|фізико-хімічних| факторів. Спори деяких бактерій чіткіше можна розглянути|розглядувати| тільки|лише| після|потім| спеціального фарбування|пофарбування|.
1. Приготувати препарат і зафіксувати його (див. розділ 1.3).
2. На фіксований мазок, розташований|схильний| на мікробіологічному "містку" нанести|завдавати| лужний розчин метиленового синього (по Леффлеру) і довести його до кипіння, утримуючи препарат над полум'ям пальника 15-20 хв|мінути|.
3. Змити фарбу|барву| водою і дофарбувати мазок 0,5%-вим| розчином нейтрального червоного - 30 хв|мінути|.
4. Промити мазок водою і мікроскопувати| з|із| об'єктивом 90х|. Після|потім| фарбування|пофарбування| спори набувають|придбавають| блакитного|голубого| або синього кольору|цвіту|, а цитоплазма вегетативних форм клітин|клітин| - червоного кольору|цвіт|.
5. Замалювати клітини|клітини| з|із| виявленими забарвленими|пофарбованими| спорами.
Завдання:
1. Вивчити техніку приготування препаратів для живих та неживих культур: «роздавлена крапля», «висяча крапля», фіксованого офарбованого препарату.
2. Приготувати препарат «роздавлена крапля» з хлібопекарських дріжджів, провести мікроскопію, замалювати, зазначити загальне збільшення мікроскопу.
3. Вивчити методи фарбування мікроорганізмів: простий і складний.
4. Приготувати фіксований препарат зубного нальоту, пофарбувати його по Граму, розглянути під мікроскопом, замалювати.
5. Приготувати фіксований препарат настою ґрунту, пофарбувати спори, розглянути під мікроскопом, замалювати.
Питання для самоконтролю:
1. Який препарат готують для живих мікроорганізмів, а який для неживих?
2. Як підготувати мазок для фарбування|пофарбування|?
3. З|із| якою метою|ціллю| фіксують мазок?
4. Які існують методи фарбування|пофарбування| бактерій?
5. Чому одні бактерії забарвлюються по Граму позитивно, а інші - негативно|заперечний|?
6. Як виявити наявність спор в клітині|клітині|?
ЛАБОРАТОРНА РОБОТА № 3
Морфологія бактерій
Зміст роботи:
1. Будова бактеріальної клітини.
2. основні форми бактеріальних клітин.
3. Рухливість бактерій.
4. Спороутворення.
1. Будова бактеріальної клітини
  
|
2. основні форми бактеріальних клітин




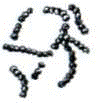


 |
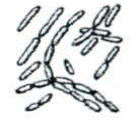

 |



3. Рухливість бактерій
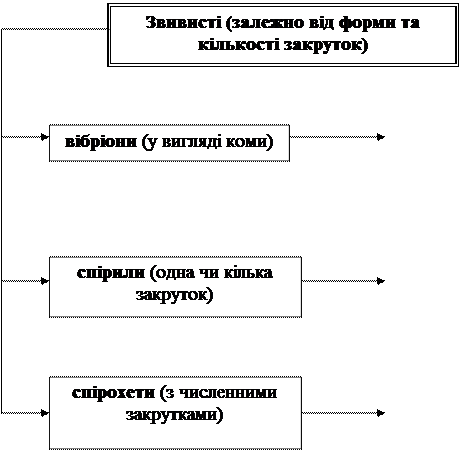
Кулясті форми бактерій нерухливі. Паличкоподібні бактерії є рухливі і нерухливі. Звивисті бактерії рухливі. Рух бактерій відбувається за допомогою джгутиків. Джгутики мають вигляд тонких ниток, що розпочинаються|розпочинало| від мембрани цитоплазми, мають більшу довжину, чим сама клітина|клітина|. Вони складаються з білка - флагеліна|, закрученого у вигляді спіралі. Наявність джгутиків, їх положення є постійною для виду ознакою і має діагностичне значення.






Спороутворення
Спори - своєрідна форма грампозитивних бактерій, що покояться, утворюються в зовнішньому середовищі за несприятливих умов існування бактерій (висушування, дефіцит поживних речовин, несприятлива температура, накопичення продуктів обміну і ін.). Процес спороутворення проходить декілька стадій, протягом яких частина цитоплазми і хромосома відділяються, оточуються мембраною цитоплазми; утворюється проспора, потім формується багатошарова, погано проникна оболонка, що додає спорі стійкість до температури і інших несприятливих чинників. При цьому усередині однієї бактерії утворюється одна спора. Спороутворення сприяє збереженню виду і не є способом розмноження, як у грибів. Спори бактерій можуть довго зберігатися в грунті. У сприятливих умовах спори проростають, при цьому з однієї спори утворюється одна бактерія.
 |
Завдання:
1. Вивчити будову бактеріальної клітини, зазначити функції окремих органел.
2. Замалювати основні форми бактерій, типи джгутування.
3. Приготувати фіксований препарат зубного нальоту, пофарбувати його по Граму. Розглянути препарат під мікроскопом, звертаючи увагу на форму клітин, їх угрупування, наявність спор.
Питання для самоконтролю:
1. Яку роль виконує нуклеоїд в бактеріальній клітині?
2. Опишіть основні органели бактеріальної клітини, їх функції.
3. Від яких факторів залежить відношення бактерій до фарбування за Грамом?
4. Які є різновиди бактерій по відношенню до фарбування за Грамом?
5. опишіть основні різновиди кулястих бактерій.
6. Що таке бацили?
7. Назвіть основні форми звивистих бактерій.
8. Які є типи джгутування бактерій?
9. Які фактори сприяють утворенню спор у спороутворюючих бактерій?
10. Які є форми та розміщення спор в клітині бактерії?
ЛАБОРАТОРНА РОБОТА № 4
Морфологія пліснявих грибів, дріжджів і актиноміцетів
Зміст роботи:
1. Будова грибної клітини.
2. Способи розмноження грибів.
3. Будова дріжджової клітини.
4. Характеристика пліснявих грибів і актиноміцетів.
1. Будова грибної клітини
плісняві гриби відносять до еукаріотів|. Вони відрізняться від бактерій складнішою будовою|спорудою| і досконалішим|довершеним| способом розмноження.

|
|
Будова міцелію гриба
Вегетативне тіло більшості грибів називається грибницею або міцелієм, що складаєтьсяз ниток гіфів, які гілкуються, їх товщина коливається від 2 до 3 мкм. Такі гриби називають міцеліальними (ще їх називають пліснявою).
Міцелій починає свій розвиток із спор, що проростають при певній температурі і вологості (рисунок 3).


Рисунок 3 – Проростання аскоспори:
А – багатоядерна двуклітинна спора перед проростанням, Б, В - стадії проростання, Г – гіфа з багатоядерними клітинами
 |
2. Способи розмноження грибів










































3. Будова дріжджової клітини
Дріжджі є представниками грибів класу аскоміцети. Це одноклітинні нерухомі мікроорганізми, широко поширені в природі; вони зустрічаються| в ґрунті, на листах, стеблах|стеблинах| і плодах рослин, в різноманітних| харчових субстратах рослинного і тваринного походження.

|
 |



Найбільш цікавим є рід сахароміцес (Saccharomyces), який об'єднує як природні види, так і культурні, що використовують в промисловості. Це два види дріжджів роду сахароміцес|: церевізіа| і | еліпсоідеус|.
Сахароміцес церевізіа (Sacch. cerevisiae) — дріжджі кулястої або овальної форми. Застосовують їх у виробництві етилового спирту, пивоварінні, квасоварінні і хлібопеченні. Сахароміцес еліпсоідеус (Sacch. ellipsoideus — S. vini) — дріжджі еліптичної форми. Їх використовують переважно у виноробстві.
4. Характеристика пліснявих грибів і актиноміцетів
  Рисунок 5 – Мукор: спорангії (1) і спорангієносці (2)|
Рисунок 5 – Мукор: спорангії (1) і спорангієносці (2)|
|
Серед пліснявих (цвілевих) грибів |плісняви| господарське і медичне значення мають пеніцилові, аспергілові і мукорові| гриби.
| |пліснява| |
 Рисунок 6 – Пеніцилл із стерігмами і конідіями|пліснява|
Рисунок 6 – Пеніцилл із стерігмами і конідіями|пліснява|
|
Мукорові цвілі. До класу Zygomycetes відносяться досить широко поширені в природі мукорові гриби, які також називають голівчастою цвіллю (рис. 5), яку можна зустріти на хлібі, овочах та ін. На щільних живильних|живлячих| середовищах|середі| колонії мукорових| грибів утворюють повстяний наліт. Їх вегетативне тіло – це розгалужений багатоядерний міцелій, що не має перегородок. Від міцелію відходять могутні плодоносні гіфи -| спорангієносці із|із| спорангіями, в яких утворюються численні|багаточисельні| спори. При дозріванні спорангій розривається, спорангієспори| звільняються|визволяють| і розносяться повітряними потоками.
Мукорові цвілі живуть на гниючих органічних субстратах, а також на стінах сирих приміщень у вигляді сіруватого пухнастого нальоту. Багато мукорових грибів (Mucor javanicus, Mucor racemosus) використовуються в промисловості для виробництва різних органічних кислот і спирту. Mucor nigricans є збудником кагатної гнилизни цукрового буряка.
Пеніцили і аспергіли. Цвілеві гриби родів Pеnicillium і Aspergillus відносяться до класу Ascomycetes. Міцелій у цих організмів не забарвлений, а спори мають різне забарвлення у різних видів, що додає відповідне забарвлення колонії гриба.
Гриби роду Penicillium мають сильно розгалужений септирований міцелій, від якого відходять численні плодоносні ниті – конідієносці (рис. 6). Конідієносці розвиваються з клітин міцелію. На окремих клітинах|клітинах| виникають утворення|, які проростають у вертикальну гіфу, що дихотомічно діліться. На кінцях такої гіфи утворюються короткі клітини-стерігми|. Кожна стерігма| несе на собі ланцюжок з|із| конідій|.
Іноді|інколи| на стерігмах| є|наявний| ще коротші стерігми| другого порядку|ладу|, що також закінчуються конідіями з пігментами|. Такі|зображенням| конідієносці з ланцюжком конідій нагадують пензлики або гроно руки, звідси гриби роду Penicillium отримали назву гроновики. Пеніцилових грибів в природі багато, вони складають половину всіх цвілевих грибів.
Ці цвілеві гриби широко поширені в ґрунті, кормах, особливо сирих приміщеннях, що погано провітрюються, вони викликають псування різних продуктів і матеріалів. Багато пеніцилів використовують в промисловості для отримання різних цінних продуктів, наприклад P. notanum і Р. chrysogenum використовуються як продуценти пеніциліну, P. vitale - продуцент ферменту глюкозооксидази, P. soppii використовується для отримання ліпідів. Р. glaucum бере участь в дозріванні деяких сортів сира (зелений сир), Р. roqueforti – сиру Рокфора, P. Camemberti - сиру Камамбера.
Міцелій грибів роду Aspergillus також септирован, від нього відходять вертикальні конідієносці (рис. 7). На вершині конідієносців утворюється розширення у вигляді головки або булави, на поверхні якої зростають численні дрібні утворення - стерігми. Від стерігм відділяються ланцюжки пігментованих конідій, які розташовуються по радіусах кулі і нагадують струмені води, що виливаються з лійки, звідки і назва гриба - ліїчна цвіль.
Представники роду Aspergillus широко поширені в природі і грають важливу роль в мінералізації органічних речовин. 40% аспергилів, що виділяються з ґрунту, володіють антибіотичною активністю. A. niger застосовується в промисловості для отримання лимонної кислоти з цукру і одночасно з міцелію цього гриба, як відходу виробництва лимонної кислоти, отримують фермент пектиназу. A. flavus і A. terricola утворюють найбільш активний комплекс протеолітичних ферментів. A. oryzae і A. awamort - кращі продуценти амілази.
 

Рисунок 8 – Міцелій актиноміцетів (1) і їх колонія (2) на МПА|пліснява| |
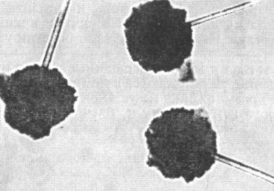
 Рисунок 7 – Аспергіл: конідієносці, їх розширення і стерігми |пліснява|
Рисунок 7 – Аспергіл: конідієносці, їх розширення і стерігми |пліснява|
|
Актиноміцети. Не зважаючи на нитеподібну будову, їх відносять до бактерій. Актиноміцети мають прокаріотичний тип клітини, в них відсутня ядерна мембрана. Актиноміцети (Actinomyces), або променисті гриби, мають добре виражений, дуже тонкий несептирований міцелій, що гілкується. Нитки міцелію актиноміцетів крихкі, легко розпадаються на окремі частини. Розвиваючись на щільному живильному субстраті актиноміцети утворюють щільні хрящовидні або шкірясті колонії, міцно прикріплені до субстрату численними пронизливими його нитками міцелію (рис. 8). Міцелій може бути субстратним і повітряним. Від ниток субстратного міцелію відходять гіфи, що створюють повітряний міцелій. Повітряний міцелій може покривати всю колонію або її частину пухнастим, бархатистим або борошнистим нальотом. На нитках повітряного міцелію утворюються спорангієносії - спіральні або прямі, поодинокі або зібрані в мітелки. Актиноміцети широко поширені в природі (ґрунті, воді, мулі), серед них багато видів патогенних, таких, що викликають захворювання тварин і людини (актиномікоз). Вони поселяються на насінні злаків, дають спори, які потрапляють в організм людини і викликають захворювання. Є види, що утворюють антибіотичні речовини. Так, Actinomyces griseus синтезує стрептоміцин - антибіотик, що широко використовують в боротьбі з туберкульозом.
Завдання:
1. Вивчити будову грибної клітини. Зазначити різницю і схожість щодо будови клітин пліснявих грибів з клітинами бактерій і дріжджів.
2. Приготувати фіксований препарат дріжджів роду Saccharomyces, пофарбувати метиленовим синім, мікроскопувати. Замалювати препарат, визначити форми дріжджових клітин, клітин з бруньками.
3. Розглянути в чашках Петрі колонії грибів родів Mucor, Pеnicillium і Aspergillus і Actinomyces. Описати макроскопічні ознаки колоній грибів: загальну топографію (форму, профіль, край, структуру), консистенцію колоній (порошкоподібна, бархатиста, ворсиста) (рис. 9, 10), тип міцелію (субстратний, повітряний)|. Результати занести в таблицю:
| Колонія | Розмір | Колір | Форма | Профіль | Край | Структура | Тип міцелію |
4. Розглянути плоди і овочі, уражені пліснявими грибами. Визначити тип хвороби, користуючись довідниками.
5. Приготувати препарат «роздавлена крапля» в суміші спирту і гліцерину пліснявих грибів і актиноміцетів. Мікроскопувати препарат при збільшенні 15х40. Замалювати гіфи, конідієносці і спорангієносці пліснявих грибів і актиноміцетів.
Форма




 |




 |




Профіль




 |

|



 |
Рисунок 9 – Культуральні ознаки колоній: форма і профіль
Край





 |




 |
Структура






Рисунок 10 – Культуральні ознаки колоній: край і структура
Питання для самоконтролю:
1. Охарактеризуйте особливості будови еукарістичної (грибної) клітини.
2. Типи міцелію грибів.
3. Охарактеризуйте класи грибів (зигоміцетів, аскоміцетів, базидіоміцетів і дейтероміцетів) по наступній схемі: будова міцелію, способи розмноження, представники.
4. Особливості морфології пліснявих грибів родів Mucor, Pеnicillium, Aspergillus.
5. В яких галузях господарства використовують плісняві гриби?
6. Чим дріжджова клітина відрізняється за будовою від бактеріальної?
7. Який метод розмноження є найпоширенішим для дріжджів?
8. В яких галузях народного господарства дріжджі мають промислове значення?
9. Наведіть приклади дріжджів, які є шкідливими і викликають псування продукції.
10. Чи можуть рухатися дріжджові клітини?
11. Особливості морфології актиноміцетів. Чому актиноміцети не відносяться до грибів? Їх значення.
12. Які плісняві гриби є збудниками: сірої гнилі плодів; плодової гнилі яблук; парши груш?
13. Які плісняві гриби є збудниками: раку картоплі; шийкової гнилі цибулі; сухої гнилі овочів?
14. Які плісняві гриби є збудниками: чорної гнилі коренеплодів; білої гнилі моркви; серцевинної гнилі буряку?
15. Який пліснявий гриб є збудником псування квашених і кисломолочних продуктів?
ЛАБОРАТОРНА РОБОТА № 5
Вплив факторів зовнішнього середовища на мікроорганізми
Зміст роботи:
1. Вплив температури на мікроорганізми.
2. Вплив осмотичного тиску на мікроорганізми.
3. Вплив антибіотиків і фітонцидів на мікроорганізми.
Екологічні фактори (умови зовнішнього середовища) суттєво впливають на розвиток мікроорганізмів. При сприятливій дії факторів мікроорганізми швидко розвиваються, поглинаючи із середовища поживні речовини, викликаючи різні біохімічні процеси і синтезуючи певні продукти.
У господарській діяльності людини знання впливу зовнішніх факторів на мікроорганізми дозволяє прискорити вирощування корисних форм, підвищити інтенсивність мікробних процесів, які використовують у промисловості, здійснювати ефективні заходи профілактики та лікування інфекційних захворювань мікробної природи. Різні фактори зовнішнього середовища широко використовують з метою продовження термінів зберігання харчових продуктів шляхом знищення або пригнічення розвитку збудників мікробного псування.
Результат зовнішніх дій на мікробну клітину залежить від механізму і тривалості дії фактора, видової стійкості мікроорганізмів, інтенсивності дії (дози, концентрації), а також фізичних і хімічних умов середовища.
1. Вплив температури на мікроорганізми
Нормальна життєдіяльність мікроорганізмів проходить у певних температурних межах, від яких залежить швидкість їх розмноження, інтенсивність протікання процесів обміну речовин в організмі. Температура, при якій спостерігається інтенсивний ріст культури називається оптимальною. Найменша температура, при якій спостерігається деякий розвиток мікробів, називається мінімальною. Нижче цієї температури розвиток припиняється, однак життєздатність клітин може зберігатися ще довго. Найбільша температура, при якій можливий розвиток мікробів, є максимальною.
По відношенню до дії температури мікроорганізми поділяють на три групи: термофіли, мезофіли і психрофіли:

Методика визначення термостійкості бактерій:
1. Водяну баню нагрівають до 80°С.
2. Чашку Петрі з застиглим м'ясо-пептонним агаром підписують з боку кришки (прізвище, дата), а з боку дна розкреслюють на три сектори, які зазначають за часом прогрівання культури (0-10-30) (рис.11).
3. З пробірки з дослідним зразком (наприклад, крупа з водою або розчин відповідних видів бактерій) роблять посів бактеріальною петлею на сектор 0 (тобто без прогрівання) методом штриха (рис. 11).
4. Далі пробірку з дослідною культурою поміщають на водяну баню і прогрівають 10 хв.
5. Аналогічно до п. 3 проводять посів культури на сектор 10.
6. Знову поміщають пробірку на водяну баню і прогрівають культуру ще 20 хв.
7. Аналогічно до п. 3 проводять посів культури на сектор 30 (загальний час прогрівання культури).
8. Чашки перевертають догори дном (для уникнення попадання конденсату на поживне середовище і культуру), ставлять у термостат при температурі 37°С на 24-48 год для вирощування.
9. Після культивування провести перегляд секторів чашки, виявити відсутність або наявність росту. Визначити інтенсивність росту орієнтовним візуальним методом за щільністю шару, його площі, зазначив її наступними позначками: - (відсутність росту), + (слабкий ріст), ++ (помірний ріст), +++ (рясний ріст).
10. Приготувати препарати, фарбовані фуксином з культури усіх секторів, промікроскопувати і замалювати.
 | |||
Рисунок 11 – Схема посіву мікроорганізмів на поверхню щільного поживного середовища без прогрівання та з прогріванням культури
2. Вплив осмотичного тиску на мікроорганізми
Важливе|поважне| значення для життєдіяльності мікроорганізмів має осмотичний тиск|тиснення| середовища, величину якого визначають концентрації розчинених у ньому сполук.|середи|
При високій концентрації речовин в навколишньому середовищі (плазмоліз) відбувається зморщування цитоплазми і відділення її від оболонки. Наступає стан розслаблення і млявості, який приводить до загибелі клітини. Подібне явище спостерігається в природі, а іноді його створює людина. Варення готують, огірки солять, капусту квасять шляхом підвищення концентрації розчину, створення середовища, несприятливого для розвитку мікробів, що сприяє збереженню продукту. Зворотне явище, зване деплазмолізом, спостерігається при нікчемне малій концентрації солей в навколишньому середовищі. Рідина проникає всередину клітини до тих пір, поки концентрація речовин клітки і концентрація середовища не стануть рівними. Зазвичай цьому передує розрив оболонки.Це відбувається, якщо мікроорганізми потрапляють у дистильовану воду. Отже, як плазмоліз, так і деплазмолиз несприятливо впливають на мікроорганізми і часто приводять їх до загибелі.
Мікроорганізми, які зберігають життєдіяльність у середовищах з високим осмотичним тиском, називають осмофілами. Мікроорганізми, які витримують високий осмотичний тиск, але краще розвиваються при нормальному тиску, назівають осмотолерантними.
 |
Деякі осмофіли є збудниками псування харчових продуктів, консервованих сіллю і цукром, а також збудниками харчових захворювань мікробної природи.
Методика визначення явища плазмолізу в клітинах дріжджів:
1. Хлібопекарські дріжджі розвести в дистильованій воді до незначної каламуті суспензії.
2. Краплю суспензії помістити на предметне скло і внести в неї декілька кристалів кухонної солі.
3. Через декілька хвилин провести мікроскопію при збільшенні у 600 разів (з об'єктивом 40х). У плазмолізованих клітинах протоплазма відокремлюється від оболонки і зморщується. Замалювати.
3. Вплив антибіотиків і фітонцидів на мікроорганізми
Антибіотики – це специфічні хімічні речовини біологічного походження, що мають антимікробну дію. За походженням їх умовно поділяють на антибіотики мікробного походження, антибіотичні речовини тваринного і рослинного походження (фітонциди).
Бактерії продукують такі антибіотики, як граміцидин, субтилін, поліміксін, нізин, дипломіцин, колоформін; плісняві гриби – пеніцилін, аспергілін, цефалоспорин, клавіміцин; актиноміцети – стрептоміцин, біоміцин, тетрациклін, ністатин, неоміцин та ін. Зустрічаються мікроорганізми, що віділяють декілька антибіотиків.
На мікроорганізми антибіотики діють вибірково, тобто кожний антибіотик діє тільки на певний вид мікроорганізмів і не впливає на інший. Так, на грампозитивні бактерії діють пеніцилін, біцилін, еритроміцин, на плісняві гриби – ністатин, полі міксин, ампіцилін.
Характер дії антибіотиків на мікроорганізми може бути різним. Одні затримують розмноження мікроорганізмів, тобто діють бактеріостатично, інші спричиняють їх загибель – діють бактерицидно. Є антибіотики, що розчиняють мікробні клітини.
Деякі антибіотики використовують як консерванти харчових продуктів (ауреоміцин, біоміцин, нізин, піраміцин, трихотецин), враховуючи при цьому їх безпечність, доступність і ефективність. Вміст антибіотиків в харчових продуктах строго регламентується. Крім того, необхідно, щоб при тепловій кулінарній обробці вони повністю розкладалися.
Фітонциди – антибіотичні речовини, що виділяють рослини. Їх хімічна природа дуже різноманітна. Антимікробну дію виявляють ефірні олії, глюкозиди, алкалоїди, органічні кислоти, антоціани, дубильні речовини. З часнику виділено антибіотик алліцин, з насіння редису – рафанін, з листя томатів – томатин, з коріння ріпи – рапін, із злакових – фітоалексини, з хмелю – гумулон і лупулон. Фітонциди характеризуються тими ж основними властивостями, що й антибіотики мікробного походження.
Методика визначення антимікробної дії антибіотиків і фітонцидів:
1. У центр підписаної зі сторони дна чашки Петрі з застиглим м'ясо- пептонним агаром поміщають розтерту таблетку антибіотика (ампіциліну, тетрацикліну чи ін.) або невелику кількість подрібненої цибулі чи часнику.
2. Чашки залишають відкритими впродовж 5 хв. для осадження мікроорганізмів з повітря (цей дослід можна проводити і з пліснявими грибами, висіяв попередньо спори на застиглий сусло-агар).
3. Паралельно ставлять контрольний дослід, тобто відкривають чашку без антибіотика та фітонциду.
4. Чашки закривають кришками, перевертають догори дном і ставлять в термостат для вирощування мікроорганізмів при температурі 37°С на 24-48 год. (для пліснявих грибів при температурі 25-27°С на 3-5 діб).
5. Через певний час розглянути чашку з посівом культури й оцінити антимікробну дію антибіотиків (навколо антибіотика чи фітонциду залежно від ступеня чутливості мікроба спостерігаються різні за розміром зони, вільні від росту мікробів).
6. Виміряти за допомогою лінійки затримку росту навколо таблетки. Розмір зони затримки росту визначає ступінь чутливості мікроорганізмів до цього антибіотика:
| Діаметр зони затримки росту, мм | Ступінь чутливості до антибіотика |
| Понад 25 | Високочутливі |
| 25- 15 | Чутливі |
| 14-10 | Малочутливі |
| Менше 10 або повна відсутність | Стійкі |
Завдання:
1. Визначити термостійкість бактерій.
2. Вивчити явище плазмолізу в клітинах дріжджів у концентрованому розчині кухонної солі. Мікроскопувати, замалювати.
3. Визначити антимікробну дію антибіотика на мікрофлору повітря лабораторії. Заміряти зони затримки росту і зробити відповідні висновки.
4. Визначити антимікробну дію фітонцидів часнику і цибулі на мікрофлору повітря лабораторії або на певний вид пліснявого гриба. Заміряти зони затримки росту мікроорганізмів і зробити висновки щодо ступеня чутливості їх до застосованих фітонцидів.
Питання для самоконтролю:
1. Як класифікують мікроорганізми по відношенню до температури?
2. Однакову чи різну температуру треба застосовувати для знищення спорових і безспорових бактерій?
3. Що відбувається з клітиною мікроорганізму, яка попадає в середовище з високим осмотичним тиском?
4. Як класифікують мікроорганізми по відношенню до осмотичного тиску?
5. Чим відрізняється антимікробна дія антисептиків від антимікробної дії антибіотиків?
6. Які антибіотики використовують як консерванти харчових продуктів?
7. Які антисептики використовують для дезінфекції складських приміщень, холодильних камер, обладнання, інвентарю, рук персоналу тощо?
8. Що таке фітонциди? Які вищі рослини виділяють фітонциди?
ЛАБОРАТОРНА РОБОТА № 6
Поживні середовища. Стерилізація поживних середовищ и посуду
Зміст роботи:
1. Поживні середовища.
2. Стерилізація поживних середовищ и посуду.
1. Поживні середовища
Ріст мікроорганізмів можливий при наявності в оточуючому середовищі усіх необхідних поживних речовин для здійснення конструктивних та енергетичних процесів клітини: джерела вуглецю, азоту, зольних елементів і мікроелементів.
В мікробіологічній практиці для вирощування мікроорганізмів використовують різні поживні середовища, які за складом розділяють на природні, полусинтетичні і синтетичні.
Природні середовища складаються







