1. Определите массу йода и объем спирта, необходимые для приготовления 300 г 10%-ного раствора йода (плотность спирта 0,8 г/мл).
2. Сколько граммов хлорида железа (III) необходимо для приготовления 2 л 0,5Н раствора? Определите титр этого раствора.
3. Вычислите молярную концентрацию раствора, в 0,04 л которого содержится 1,74 г сульфата калия. Определите титр этого раствора.
4. Водный раствор содержит 577 г серной кислоты в 1 литре, плотность раствора 1,335 г/мл. Определить массовую долю серной кислоты.
5. Вычислите молярную концентрацию 15%-ного раствора сульфата меди, плотность которого 1,107 г/мл.
6. Плотность 1,4 М раствора серной кислоты составляет 1,085 г/мл. Вычислите массовую долю серной кислоты.
7. Какое количество воды и нитрата калия необходимо для приготовления 400 г 20%-ного раствора?
8. Вычислите молярную концентрацию эквивалента (нормальность) 10%-ного раствора сульфата меди, плотность которого равна 1,107 г/мл.
9. Вычислите молярную концентрацию и молярную концентрацию эквивалента (нормальность) 16%-ного раствора хлорида алюминия плотностью 1,149 г/мл.
10. Определите молярную концентрацию раствора, полученного при растворении сульфата натрия массой 42,6 г в воде массой 300 г, если плотность полученного раствора равна 1,12 г/мл.
11. Определите молярную концентрацию и молярную концентрацию эквивалента (нормальность) 47,7%-ного раствора фосфорной кислоты, плотность которого равна 1,315 г/мл.
12. Вычислите, какие массы 60%-ного раствора и воды потребуются для приготовления 3 кг 10%-ного раствора некоторого вещества.
13. Какой объем раствора серной кислоты плотностью 1,8 г/мл с массовой долей Н2SO4 88% надо взять для приготовления раствора кислоты объемом 200 мл и плотностью 1,3 г/мл с массовой долей серной кислоты 40%?
14. Определить объем аммиака (условия нормальные), который необходимо растворить в 249 г воды для получения 25%-ного раствора гидроксида аммония.
15. Определить массу воды, в которой нужно растворить 188 г оксида калия для получения 5,6%-ного раствора гидроксида калия.
16. Определить массу 7,93%-ного раствора КОН, в котором нужно растворить 47 г оксида калия для получения 21%-ного раствора КОН.
17. Определить молярную концентрацию раствора, полученного при смешении 200 мл 8 М и 300 мл 2 М растворов серной кислоты.
18. Сколько граммов CuSO4 содержится в 10,0 мл 0,20 М раствора? Какова молярная концентрация эквивалента (нормальность) этого раствора?
19. Сколько миллилитров 60%-ного раствора серной кислоты, плотность которого 1,5 г/мл, нужно взять, чтобы приготовить 5,0 л 12%-ного раствора, плотность которого 1,08 г/мл?
20. Сколько миллилитров 30%-ного раствора гидроксида калия с плотностью 1,29 г/мл нужно взять, чтобы приготовить 3,0 л 0,50 М раствора?
21. До какого объема нужно разбавить 20,2 мл 20%-ного раствора хлорида меди (II), плотность которого 1,20 г/мл, чтобы получить 0,05 М раствор?
22. К 10 мл 12,8%-ного раствора хлорида бария, плотность которого 1,12 г/мл, прибавлен раствор сульфата натрия, в результате чего выпал осадок сульфата бария. Вычислите массу осадка.
23. К 3,5 М раствору хлорида аммония объемом 30 мл и плотностью 1,05 г/мл прилили 40 мл воды (плотность воды 1,00 г/мл). Определите массовую долю соли в полученном растворе.
24. Какой объем раствора с массовой долей карбоната натрия 15% (плотность 1,16 г/мл) надо взять для приготовления 0,45 М раствора карбоната натрия объемом 120 мл?
25. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) NaHCO3 и NaOH; б) K2SiO3 и HCl; в) BaCl2 и Na2SO4.
26. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и HCl; б) FeSO4 и (NH4)2S; в) Cr(OH)3 и KOH.
27. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Mg2+ + CO32- = MgCO3; б) H+ + OH- = H2O.
28. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) КНСО3 и H2SO4; б) Zn(OH)2 и NaOH; в) CaCl2 и AgNO3.
29. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuSO4 и H2S; б) BaCO3 и HNO3; в) FeCl3 и KOH.
30. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Cu2+ + S2- = CuS; б) SiO32- + 2H+ = H2SiO3.
31. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Sn(OH)2 и HCl; б) BeSO4 и KOH; в) NH4Cl и Ba(OH)2.
32. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) СаСО3 + 2Н+ = Са2+ + Н2О + СО2; б) Al(OH)3 + OH– = [Al(OH4)]–; в) Pb2+ + 2I– = PbI2.
33. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Be(OH)2 и NaOH; б) Cu(OH)2 и HNO3; в) Zn(OH)NO3 и HNO3.
34. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na3PO4 и CaCl2; б) K2CO3 и BaCl2; в) Zn(OH)2 и KOH.
35. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Fe(OH)3 + 2H+ = Fe3+ + 3H2O; б) Cd2+ + 2OH– = Cd(OH)2; в) H+ + NO2– = HNO2.
36. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CdS и HCl; б) Сr(OH)3 и NaOH; в) Ba(OH)2 и CoCl2.
37. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Zn2+ + H2S = ZnS + 2H+; б) НСО3– + Н+ = Н2О + СО2; в) Ag+ + Cl– = AgCl.
38. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) H2SO4 и Ba (OH)2; б) FeCl3 и NH4OH; в) СН3СООNa и HCl.
39. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FeCl3 и КОН; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3.
40. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Be(OH)2 + 2OH– = BeO 22– + 2H2O; б) СН3СОО– + Н+ = СН3СООН; в) Ba 2+ + SO 42– = BaSO4.
41. Какие из веществ: NaCl, NiSO4, Be(OH)2, KHCO3, взаимодействуют с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
42. Произведение растворимости сульфата кальция CaSO4 равно  . Выпадет ли осадок, если смешать равные объемы 0,01Н раствора CaCl2 и 0,02Н раствора Na2SO4?
. Выпадет ли осадок, если смешать равные объемы 0,01Н раствора CaCl2 и 0,02Н раствора Na2SO4?
43. Растворимость BaCO3 равна  моль/л. Вычислите произведение растворимости карбоната бария.
моль/л. Вычислите произведение растворимости карбоната бария.
44. Произведение растворимости PbI 2 равно  . Вычислите концентрацию ионов Pb 2+ и ионов I – в насыщенном растворе иодида свинца.
. Вычислите концентрацию ионов Pb 2+ и ионов I – в насыщенном растворе иодида свинца.
45. При t=  C в 1л насыщенного раствора иодида серебра AgI содержится 0,044г соли. Вычислите произведение растворимости этой соли.
C в 1л насыщенного раствора иодида серебра AgI содержится 0,044г соли. Вычислите произведение растворимости этой соли.
46. В 0,6 л насыщенного раствора PbSO4 содержится 0,186 г ионов свинца (II). Вычислите произведение растворимости этой соли.
47. Произведение растворимости Ag3PO4 равно  . Вычислите концентрацию ионов Ag+ и PO4 3– в насыщенном растворе этой соли.
. Вычислите концентрацию ионов Ag+ и PO4 3– в насыщенном растворе этой соли.
48. Произведение растворимости дихромата серебра Ag2Cr2O7 равно  . Выпадет ли осадок при смешивании равных объемов 0,01Н растворов AgNO3 и K2Cr2O7?
. Выпадет ли осадок при смешивании равных объемов 0,01Н растворов AgNO3 и K2Cr2O7?
49. Произведение растворимости сульфата свинца ПР ( )=
)=  . Образуется ли осадок, если к 0,1М раствору Na2SO4 прибавить равный объем 0,1Н раствора ацетата свинца Pb(CH3COO)2?
. Образуется ли осадок, если к 0,1М раствору Na2SO4 прибавить равный объем 0,1Н раствора ацетата свинца Pb(CH3COO)2?
50. В пробирке при комнатной температуре смешаны 1,0 мл 0,2Н раствора нитрата свинца и 2,0 мл 0,01Н раствора хлорида натрия. Выпадет ли осадок, если ПР ( )=
)=  ?
?
51. Произведение растворимости иодида серебра  . Образуется ли осадок, если смешать равные объемы 0,02Н раствора KI и 0,04Н раствора AgNO3?
. Образуется ли осадок, если смешать равные объемы 0,02Н раствора KI и 0,04Н раствора AgNO3?
52. Во сколько раз концентрация водородных ионов в 0,1Н растворе HCl  больше, чем в 0,01Н растворе HCl
больше, чем в 0,01Н растворе HCl  ?
?
53. Степень диссоциации H3PO4 по первой ступени в 0,1М растворе равна 0,17. Не учитывая диссоциацию по следующим ступеням, вычислите концентрацию водородных ионов в растворе.
54. Степень диссоциации NH4OH равна 1,3%. Сколько растворенных частиц (молекул и ионов) содержится в 1л такого раствора?
55. При какой молярной концентрации муравьиной кислоты HCOOH 95% ее молекул будут находиться в недиссоциированном состоянии, если КД = 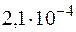 ?
?
56. Константа диссоциации сероводородной кислоты по первой ступени КД =  . Определите концентрацию водородных ионов в 0,1 М растворе H2S.
. Определите концентрацию водородных ионов в 0,1 М растворе H2S.
57. Вычислите степень диссоциации азотистой кислоты в ее 0,01 М растворе и концентрацию ионов водорода в растворе, если КД = 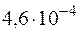 .
.
58. Какова концентрация водородных ионов [H+] в 0,1Н растворе синильной кислоты HCN, если ее константа диссоциации КД =  ?
?
59. Определить степень диссоциации и концентрацию ионов [OH–] в 0,01Н растворе NH4OH, если КД =  .
.
60. Концентрация насыщенного при t= 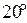 C раствора сероводородной кислоты H2S составляет 0,13 моль/л. Константа диссоциации по первой ступени КД =
C раствора сероводородной кислоты H2S составляет 0,13 моль/л. Константа диссоциации по первой ступени КД =  . Определите концентрации ионов [H+] и [HS–].
. Определите концентрации ионов [H+] и [HS–].
61. Вычислите степень диссоциации  и [H+] в 0,1 М растворе хлорноватистой кислоты, если КД =
и [H+] в 0,1 М растворе хлорноватистой кислоты, если КД = 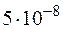 .
.






