Лабораторна робота №5-11
З дисципліни: «Фізика»
На тему: «Вивчення спектральних закономірностей
атома водню та визначення сталої Ридберга»
Підготував: студент групи МІТ-11(б)
Сікорський Дмитро
Перевірили: к.ф.-м.н.,доц. Стасенко В.А.
пров.інж. Камінський О.С.
Вінниця 2012
Мета роботи: вивчення спектральних закономірностей у видимій області спектра атома водню за допомогою монохроматора УМ-2.
Прилади і матеріали: монохроматор УМ-2, спектральні трубки з воднем і гелієм.

Теоретичні відомості
Спектри ізольованих атомів мають лінійчастий характер, тобто складаються з окремих ліній, інтенсивність і розміщення яких на шкалі частот характерна лише для атомів даного елемента.
Деякі закономірності, а саме, частоти спектральних ліній спектра атома водню одержали пояснення в теорії Бора, успіхи якої сприяли становленню квантової механіки. Однак поряд з певними успіхами в теорії Бора із самого початку проявилися істотні недоліки. Найголовнішим з них була внутрішня суперечність теорії. Ґрунтуючись на механічному поєднанні класичної фізики з квантовими постулатами, теорія Бора в ряді проблем наштовхнулась на істотні суперечності. Сюди, насамперед, належать питання про інтенсивності спектральних ліній, поляризацію випромінювання та ін. Поступово стало зрозуміло, що теорія Бора, яка правильно пояснювала одні факти і не здатна пояснити цілий ряд інших, є лише перехідним етапом на шляху створення послідовної теорії атомних і ядерних явищ. Такою послідовною теорією була квантова механіка. Застосування її до атомних процесів дало змогу не тільки пояснити величезну різноманітність явищ атомної і ядерної фізики, а й розкрити фізичний зміст самих постулатів Бора.
Розглянемо рух електрона в кулонівському полі ядра із зарядом Ze, тобто задачу про електрон, що має потенціальну енергію
 ,
,
де r - відстань між електроном і ядром.
Стан електрона у воднеподібному атомі описується деякою хвильовою функцією Y, яка задовольняє стаціонарне рівняння Шредінгера:
 (1)
(1)
де D - тривимірний оператор Лапласа;
Y - хвильова функція;
U(r) –потенціальна енергія електрона в електричному полі позитивно зарядженого ядра;
W - значення повної енергії електрона в атомі.
Розв'язання рівняння (1) для воднеподібної системи в сферичних координатах дає важливі результати. Насамперед виявляється, що момент імпульсу електрона в атомі квантується за формулою:
 (2)
(2)
де l = 0,1,2,..., n -1 - орбітальне квантове число.
Далі, з рівняння (1) випливає, що при W < 0, тобто в умовах, коли електрон "зв'язаний" в атомі, його рухи мають бути періодичними, а значення W - повної енергії в атомі - квантованими. Значення енергії, які може мати електрон в атомі, визначаються виразом:
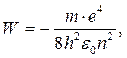 (3)
(3)
де п — головне квантове число, яке визначає енергію стаціонарних станів і набуває значень: 1,2,3,..., п.
Стан електрона в атомі водню однозначно визначається набором з трьох квантових чисел, що відповідає трьом ступеням вільності. Ця трійка квантових чисел поряд з головним і орбітальним містить також магнітне квантове число т.
Магнітне квантове число т визначає проекцію механічного моменту на напрям осі z:
 (4)
(4)
і набуває одного з (2l + 1) значень: -l,-l + 1,...,-1,0,1,2,..., l.
Енергії стаціонарних станів воднеподібних атомів показані на енергетичній діаграмі (рис. 1). На цій діаграмі показані лише переходи, які дозволяються правилами добору.
Найбільш фундаментальні особливості лінійчастого спектра водню були встановлені Бальмером, який шляхом підбору виявив, що видимі лінії із видимої частини спектра описуються співвідношенням
 , (5)
, (5)
де п набуває значень 3,4,5,...,
R — стала Рідберга.
Групи ліній, які при λ → ∞ зводяться до однієї і тієї ж лінії, утворюють спектральну серію. Якщо граничною лінією є λ гр =22/ R, то ця серія називається серією Бальмера.
В ультрафіолетовій і інфрачервоній областях спектра спостерігаються серії Лаймена, Пашена, Брекета, Пфунда, довжини хвиль яких визначаються співвідношеннями:
 n= 2,3,3,… Лаймана,
n= 2,3,3,… Лаймана,
 n= 2,3,3,… Пашена,
n= 2,3,3,… Пашена,
(6)
 n= 2,3,3,… Брекета,
n= 2,3,3,… Брекета,
 n= 2,3,3,… Пфунда.
n= 2,3,3,… Пфунда.
Можна переконатись, що закономірності, які визначаються формулами (5), (6) - природний наслідок квантово-механічного результату (3). Дійсно, нехай електрон із стану з енергією Wn  переходить в стан з енергією Wk.. Якщо Wn >Wk то такий перехід може супроводжуватись випромінюванням фотона, частота якого ν згідно із законом збереження енергії, знаходиться із умови:
переходить в стан з енергією Wk.. Якщо Wn >Wk то такий перехід може супроводжуватись випромінюванням фотона, частота якого ν згідно із законом збереження енергії, знаходиться із умови:
 (7)
(7)
Звідки
 (8)
(8)
Підстановкою (3) в (8) з урахуванням того, що 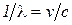 , одержимо:
, одержимо:
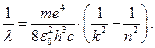 (9)
(9)
Підставляючи в (9) послідовно k = 1, k = 2, k = 3 і т.д., 5 наділяючи відповідними значеннями п, одержимо співвідношення (5) і (6). Відповідні серії випромінювання для атома водню показані на рис.1.
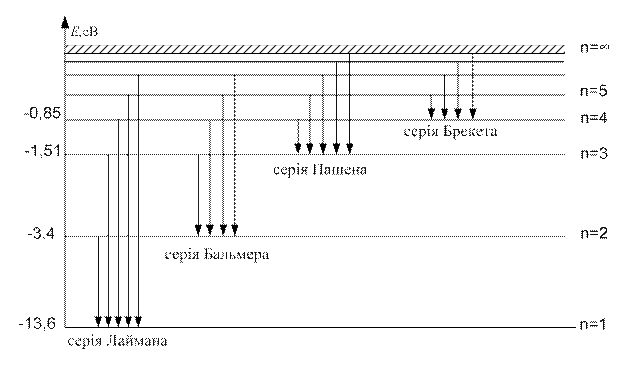 Рис. 1
Рис. 1
У формулі (9) вираз
 (10)
(10)
називається сталою Рідберга і визначається через універсальні константи і параметри електрона.
У співвідношенні (9):
т - маса електрона;
е - заряд електрона;
ε0 - діелектрична стала;
h - стала Планка;
с - швидкість світла.
Порядок виконання роботи
1. Вивчення спектральних закономірностей у спектрі атома водню проводять за допомогою монохроматора УМ-2, у високовольтну приставку якого почергово ставлять газорозрядні трубки, заповнені гелієм і воднем.
2. Градуювання монохроматора здійснюють за допомогою найбільш інтенсивних ліній спектра атома гелію. Спектр від газорозрядної трубки з гелієм розглядають в окуляр монохроматора. Градуювальним барабаном суміщають стрілковий показник монохроматора з відповідною спектральною лінзою атома гелію. Відліки градуювального барабана заносять до табл.1. Аналогічні дослідження проводять з газорозрядною трубкою заповненою воднем.
Таблиця 1.
| Речовина | Лінія спектра | Інтенсивність | Довжина хвилі, нм | Відліки градуювального барабана |
| Гелій | Червона | 706,5 | ||
| Червона | 667,5 | |||
| Жовта | 587,6 | |||
| Жовто-зелена | 541,2 | |||
| Зелена | 501,6 | |||
| Зелена | 492,2 | |||
| Голуба | 468,5 | |||
| Синя | 447,1 | |||
| Фіолетова | 402,6 | |||
| Фіолетова | 396,5 | |||
| Водень | Червона | |||
| Голуба | ||||
| Синя | ||||
| Фіолетова |
Обробка результатів експерименту та їх аналіз
1. Побудувати градуювальний графік, по осі у якого відкласти довжини хвиль спектра гелію (нм), а по осі х - відліки градуювального барабана монохроматора, які відповідають цим лініям.
2. Користуючись градуювальним графіком, визначити довжини хвиль спектра атома водню. Значення цих довжин хвиль занести до таблиці.
3. Користуючись формулою (3), визначити сталу Рідберга.
4. Одержані експериментальні значення сталої Рідберга порівняти з теоретичним значенням за формулою (10).
Контрольні запитання для допуску






