Анализ уравнения Нернста показывает, что даже при достаточно большом изменении (уменьшении или увеличении) концентраций компонентов по сравнению с единичными значениями новая величина φ будет мало отличаться от стандартного значения электродного потенциала(φ˚).
Это приводит к важному выводу:
–если в окислительно-восстановительной реакции разность ∆Е° = φ°ок – φ°вс велика, то даже при больших изменениях концентраций окислителя и восстановителя их окислительно-восстановительные потенциалы (φок и φвс)будут мало отличаться от соответствующих стандартных значений и новая разность ∆E будет мало отличаться от исходной ∆Е°, т. е. концентрационные эффекты практически не изменяют природу окислительно-восстановительного процесса в целом;
–если в ОВР разность ∆Е° =φ°ок – φ°вc мала, то при больших изменениях концентраций окислителя и восстановителя новая разность ∆Е будет относительно сильно (вплоть до перемены знака) отличаться от исходной ∆Е°Œи в этом случае можно ожидать существенного влияния концентрационных эффектов на природу окислительно-восстановительного процесса в целом.
Особенно ярко концентрационные эффекты проявляются в тех случаях, когда концентрация одного из участников окислительно-восстановительного процесса уменьшается на много порядков. К таким явлениям приводит образование малорастворимых соединений или устойчивых комплексных ионов.
Уменьшение концентрации окисленной формы приводит к понижению потенциала электрода, следовательно, к снижению окислительной способности. Например, окислительная способность следующих форм кобальта 

уменьшается в соответствии со значениями φ˚, которые составляют (–0,277) В, (–0,42)В,(–0.64)B, (–0,73)В.Образование малорастворимых соединений и комплексов повышает восстановительную способность металлов. Например, золото не растворяется в воде, но легко растворяется в присутствии цианида калия, так как φAu+/Au= +1,69 В, a φ[Au(CN)2]-/Au== – 0,61 В.
Уравнение Нернста.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Значение электродного потенциала можно определить уравнением Нернста:
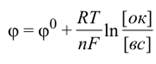
где [ок] – произведение концентраций компонентов окисленной формы в соответствующих степенях; [вс] – произведение концентраций компонентов восстановленной формы также в соответствующих степенях, φ – электродный потенциал, φ˚ - стандартный электродный потенциал (Вт),  — постоянная Фарадея = 96485,35 Кл·моль−1,
— постоянная Фарадея = 96485,35 Кл·моль−1,  — число моль электронов, участвующих в процессе.
— число моль электронов, участвующих в процессе.
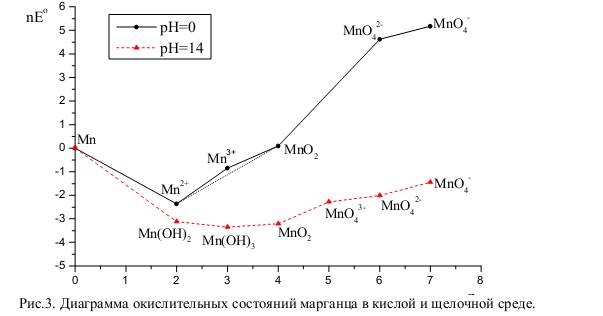
Диаграммы Латимера.


ЕСТЬ ПРИМЕРЫ:


Диаграммы Фроста.