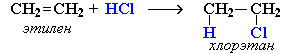
Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон Н+ в составе молекулы галогеноводорода HX (X - галоген).

Схема механизма реакции гидрохлорирования этилена
CH2=CH2 + HCl  CH3-CH2Cl
CH3-CH2Cl
Направление реакции присоединения галогеноводородов к алкенам несимметричного строения (например, к пропилену CH2=CH–СН3) определяется правилом Марковникова:
В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е. атому углерода, связанному с наибольшим числом атомов водорода).
Так, в реакции HCl c пропиленом из двух возможных структурных изомеров 1-хлорпропана и 2-хлорпропана, образуется последний:

Эта закономерность была первоначально установлена эмпирически. В современной органической химии дано теоретическое обоснование правила Марковникова на основе положения о влиянии электронного строения молекул на их реакционную способность.
Следует отметить, что правило Марковникова в его классической формулировке соблюдается только для электрофильных реакций самих алкенов. В случае некоторых производных алкенов или при изменении механизма реакции идут против правила Марковникова.
4.1.4. Гидратация (присоединение воды)

Гидратация происходит в присутствии минеральных кислот по механизму электрофильного присоединения:

В реакциях несимметричных алкенов соблюдается правило Марковникова.

Полимеризация алкенов
1. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:
n M  M n
M n
Число n в формуле полимера (M n) называется степенью полимеризации. Реакции полимеризации алкенов идут за счёт присоединения по кратным связям:

2. Димеризация алкенов – образование димера (удвоенной молекулы) в результате реакции присоединения. В присутствии минеральной кислоты (донора протона Н+) происходит присоединение протона по двойной связи молекулы алкена. При этом образуется карбокатион:
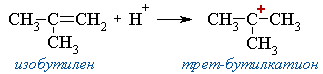
Этот карбокатион присоединяется к следующей молекуле алкена с образованием "димерного карбокатиона":

"Димерный карбокатион" стабилизируется путем выброса протона, что приводит к продуктам димеризации алкена – смеси изомерных диизобутиленов (2,4,4-триметипентена-2 и 2,4,4-триметилпентена-1):

Этот процесс протекает при обработке изобутилена (2-метипропена) 60% серной кислотой при температуре 70°С. Образовавшаяся в результате смесь диизобутиленов подвергается гидрированию с целью получения "изооктана" (2,2,4-триметилпентана), который применяется для улучшения антидетонационной способности бензина ("изооктан" – стандарт моторного топлива с октановым числом 100).
Подобно реакции димеризации алкенов происходит их полимеризация, только процесс не останавливается на стадии образования димера, а идет дальше и включает в себя множество стадий присоединения молекул алкена к растущему карбокатиону.
Реакции окисления алкенов
Строение продуктов окисления алкенов зависит от условий реакции и природы окислителя.
1. Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакцияВагнера):

Полное уравнение реакции:

Схема электронного баланса реакции окисления этилена раствором KMnO4
Полное уравнение реакции:

Электронный баланс:
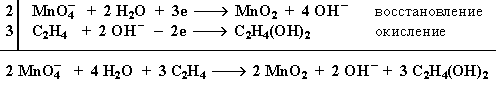
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены. "Взаимодействие этилена с раствором перманганата калия".
2. При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:

3. Промышленное значение имеет частичное окисление алкенов с образованием циклических оксидов, которые широко используются в органическом синтезе:

4. Полное окисление (горение):

Газообразные гомологи алкенов образуют с воздухом взрывоопасные смеси.
Изомеризация алкенов
Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3).
Изомеризация алкенов приводит или к перемещению π–связи:

или к перестройке углеродного скелета:

Получение алкенов
В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций.
I. Крекинг алканов:
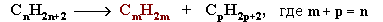
Например:

II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними p-связи.
- Дегидрогалогенирование галогеналканов при действии спиртового раствора щелочи

- Дегидратация спиртов при повышенной температуре (выше 140° C) в присутствии водоотнимающих реагентов
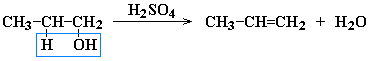
Реакции элиминирования идут в соответствии с правилом Зайцева:
Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Современная формулировка: реакции отщепления идут с образованием более замещенных при двойной связи алкенов.
Такие алкены обладают более низкой энергией.

- Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов:

- Дегидрирование алканов при 500°С:

Применение алкенов
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
Этилен (этен) Н2С=СН2 используется для получения полиэтилена, политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.

Применяется как средство для ускоренного созревания фруктов.
Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров.
Изобутилен (2-метилпропен) Н2С=С(СН3)2 применяется в производстве синтетического каучука.






