ГЕТЕРОЦИКЛЫ I
(трехчленные циклы, пятичленные циклы с одним гетероатомом)
Гетероциклическими называются соединения, имеющие циклическую структуру и содержащие в цикле не углеродные атомы (гетероатомы).
Классификация и номенклатура гетероциклов
Гетероциклы классифицируются 1) по величине цикла и 2) по виду и количеству гетероатомов.
Номенклатура Ганча
Наибольшее распространение и практическое значение имеют пяти и шестичленные циклы, содержащие в качестве гетероатомов кислород, серу и азот.
| Величина цикла | Гетероатомы | ||
| Общее количество атомов в цикле | Суффикс в названии | Вид гетероатома | Суффикс в названии |
| -ирин | O | -окс(а)- | |
| -ол | S | -тиа- | |
| -ин | N | -аз(а)- | |
| -епин |
Правила нумерации:
Старшинство атомов: O>S>N
1) Нумерация начинается от самого старшего атома к наименее старшему по кратчайшему пути.
2) Из возможных вариантов предпочтителен тот, в котором № положения заместителя наименьший.
Примеры:

ТРЕХЧЛЕННЫЕ ЦИКЛЫ

Наиболее важна окись этилена
Способы получения
Общий способ:
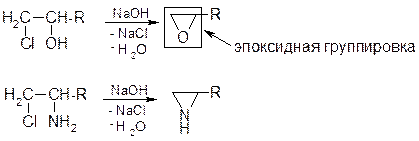
Промышленный способ получения окиси этилена:

Химические свойства
Напряженность трехчленного цикла усугубляется поляризацией связей под действием гетероатома. Циклические атомы углерода приобретают δ+ -заряды и могут быть атакованы нуклеофилом:
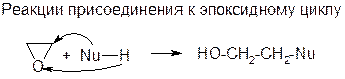
Правило Красуского: При присоединении к эпоксидному циклу нуклеофил атакует наименее замещенный атом углерода:


ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ОДНИМ ГЕТЕРОАТОМОМ
НАСЫЩЕННЫЕ ЦИКЛЫ

По своим химическим свойствам и методам получения эти соединения вполне аналогичны простым эфирам, тиоэфирам и вторичным аминам соответственно.
АРОМАТИЧЕСКИЕ ЦИКЛЫ
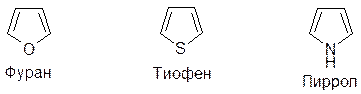
У всех трех соединений гетероатомы имеют неподеленную пару электронов, которая с π-электронами четырех углеродных атомов образует циклическую сопряженную систему – ароматический секстет:
Средняя π-электронная плотность (в расчете на 1 атом) в циклах фурана, тиофена и пиррола больше, чем в бензоле, поэтому эти циклы называются π-избыточными. По химическим свойствам – это типичные ароматические соединения, отличающиеся тем, что из-за π-избыточности скорость их электрофильных реакций повы-шена и они сравнительно легко окисляются.
Сравнительная ароматичность фурана, тиофена и пиррола

Из всех трех циклов тиофен наиболее ароматичен, т.к. его энергия сопряжения выше (дополнительная резонансная структура за счет d-орбиталей атома серы).
Наименее ароматичен фуран – его молекула наиболее полярна.
Общие методы получения фурана, тиофена и пиррола
1) Синтез Кнорре

2) Реакция Юрьева

Значительные количества тиофена получают из бензольной фракции каменноугольной смолы.
Химические свойства
Пиррол
1) NH-кислотность
Из-за включения неподеленной электронной пары азота в ароматическую систему пиррол почти лишен основности, В то же время, связь N-H ослаблена, под действием сильных оснований происходит отрыв протона и образование стабилизированного сопряжением пиррил-аниона:

2) Ацидофобность
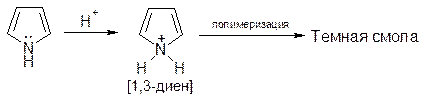
В сильно кислой среде пиррольный атом азота протонируется и ароматическая система превращается в сопряженный диен, который затем полимеризуется, образуя темного цвета смолу. Качественная реакция на пиррол: окрашивание смоченной соляной кислотой сосновой лучины в красный цвет.
3) Реакции электрофильного замещения

Из-за ацидофобности пиррола для сульфирования и нитрования применяются апротонные реагенты: пиридин-N-сульфотриоксид и ацетилнитрат (смешанный ангидрид азотной и уксусной кислот). При галогенировании пиррола даже при 0о образуются только тетрагалогенопроизводные.
4) Окисление

5) Восстановление (гидрирование)

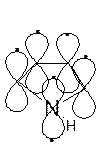
ПРИРОДНЫЕ ТЕТРАПИРРОЛЬНЫЕ СОЕДИНЕНИЯ

Порфирины – производные порфина – ароматические циклы (11 двойных связей и 2 неподеленные пары электронов). Металлокомплексы порфиринов – это природные соединения: гем (Me=Fe) – составная часть гемоглобина крови, мышечных миоглобинов, ОВ ферментов цитохромов; хлорофилл растений (Me=Mg).
Коррин – тетрапиррольный макроцикл, по структуре близкий к порфиринам. Кобальтовый комплекс коррина – витамин В12.
Фуран
Производные фурана получаются при сухой перегонке древесины:
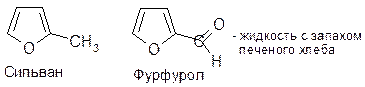
Фуран – ароматический цикл, вступающий в реакции электрофильного замещения:

Пониженная ароматичность фурана выражается в том, что он может проявлять свойства 1,3-диена и вступать в реакцию диенового синтеза:

Тиофен
Тиофен – жидкость, по физическим и химическим свойствам очень похожая на бензол (т.кип. бензола и тиофена почти совпадают). В отличие от пиррола, тиофен не ацидофобен и легко (легче, чем бензол) сульфируется обычной серной кислотой:

Образующийся α-сульфотиофен растворим в воде, и эта реакция применяется для очистки бензола от тиофена.
В присутствии кислот Льюиса тиофен ацилируется:

Биотин (витамин Н, кофактор биохимического карбоксилирования) – природное соединение, содержащее гидрированный цикл тиофена:
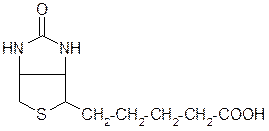
ИНДОЛ
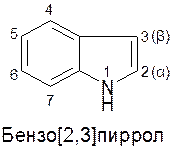
Индол – аналог пиррола, содержащий конденсированный бензольный цикл.
Индол – кристаллическое вещество с т.пл. 52о с характерным запахом, напоминающим в большом разведении цветочный (масло жасмина), применяется в парфюмерии.
Индол впервые получен расщеплением (перегонка с цинковой пылью) красителя индиго, привезенного из Индии – отсюда произошли названия.
Источник индола – каменноугольная смола.
Открытие синтеза индола из доступных исходных продуктов сделало его доступным:

Химические свойства
По химическим свойствам индол во многом является аналогом пиррола. Это ароматическое π-избыточное (в пиррольном кольце) соединение. Индол подобно пирролу почти лишен основности и ацидофобен. Обладает NH-кислотностью, близкой к кислотности спиртов. Склонен к реакциям элетрофильного замещения и к окислению.
1) Реакции SE идут по пиррольному циклу в положение 3, при этом промежуточный σ-комплекс стабилизирован сопряжением:

Примеры:

2) Окисление

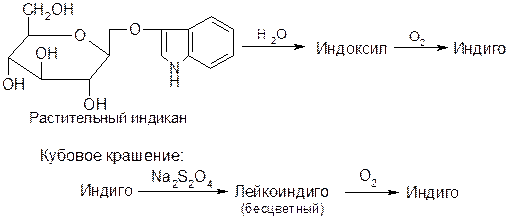
Другие природные соединения индола

ЛИТЕРАТУРА:
Основная
1. Тюкавкина Н.А., Зурабян С.Э., Белобородов В.Л. и др. – Органическая химия (специальный курс), кн.2 – Дрофа, М., 2008 г., с. 41-60.
Дополнительная
1. Н.А.Тюкавкина, Ю.И.Бауков – Биоорганическая химия – ДРОФА, М., 2007 г., с. 278-292.
25.09.09






