| Тип гиб-ридизации АО | Комплекс и электронная структура центрального атома | Структура внешних электронных оболочек комплексообразователя | Геометри-ческая структура и магнитные свойства комплекса |
| sp | [Cu(NH3)2]+ Cu+:…3 d 104 s 0 | 
| Линейная Диамагнетик |
| sp 3 | [NiCl4]2– Ni2+:…3 d 8 | 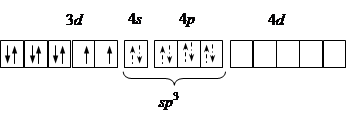
| Тетраэдри-ческая Парамагнетик |
| dsp 2 | [Ni(CN)4]2– Ni2+:…3 d 8 | 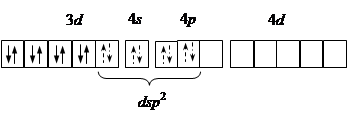
| Квадратная Диамагнетик |
| d 2 sp 3 | [Co(NH3)6]3+ Со3+:…3 d 6 | 
| Октаэдри-ческая Диамагнетик |
| sp 3 d 2 | [CoF6]3– Со3+:…3 d 6 | 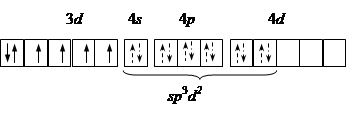
| Октаэдри-ческая Парамагнетик |
МВС не всегда может объяснить пространственное строение и магнитные свойства комплексов. Например, он не объясняет причин, вызывающих спаривание электронов в ионах [Ni(CN)4]2– и [Co(NН3)6]3–, то есть нарушение правила Гунда при распределении электронов по d– АО.
ТПЛ дополняет МВС. Согласно ТПЛ лиганды – заряженные точки, а комплексообразователь рассматривается с детальным учетом его электронной структуры.
В свободном атоме или ионе АО любого d– подуровня пятикратно вырождены, т.е. все пять АО имеют одинаковую энергию. Если такую частицу поместить в центре ориентированных особым образом лигандов, то под действием их электростатического поля энергия АО d –подуровня комплексообразователя изменится. Вне зависимости от числа и расположения лигандов вокруг центрального иона АО d –подуровня расщепляются на две группы новых орбиталей: d e серию, образованную dxy, dxz, dyz электронными облаками, и d g серию, содержащую d  и d
и d  АО.
АО.
В октаэдрическом поле лигандов (КЧ = 6) электроны d g серии испытывают более сильное отталкивание со стороны лигандов, чем электроны dε серии, поэтому энергия d g серии более высокая (см. рис. 1).
 |

Рис.1. Расщепление d –АО в октаэдрическом поле лигандов
В тетраэдрическом поле лигандов (КЧ = 4) d –подуровень расщепляется по отношению к октаэдрическому полю в обратном порядке (см. рис.2).
 |

Рис.2. Расщепление d –АО в тераэдрическом поле лигандов
Сумма энергий АО d g и d ε серий согласно закону сохранения энергии равна начальному значению энергии Е 0 вырожденных орбиталей. Разность между энергиями новых подуровней  называют энергией (иначе параметром) расщепления. Величина энергии расщепления для данного комплексообразователя определяется природой лиганда.
называют энергией (иначе параметром) расщепления. Величина энергии расщепления для данного комплексообразователя определяется природой лиганда.
Для 3 d –элементов экспериментально установлен так называемый спектрохимический ряд, в котором слева направо численное значение Δ монотонно возрастает:
I– < Br– < – S CN– < Cl– < NO  < F– < OH– < –ONO– < C2O
< F– < OH– < –ONO– < C2O  < H2O <
< H2O <
< – N CS– < gly < py < H– < NH3 < Еn < – N C– < N O  < CN– < CO
< CN– < CO
(подчеркнут атом, непосредственно связанный с комплексообразователем)
Лиганды левой части ряда (лиганды слабого поля) вызывают незначительное расщепление энергии d ‑подуровня. В этом случае величина Δ не превышает энергию взаимного отталкивания спаренных электронов, что приводит к заполнению АО электронами в соответствии с правилом Гунда (см. рис. 3).


 | |||
 |
Рис.3. Распределение электронов d –подуровня в ионе Co3+ при
октаэдрическом расположении лигандов слабого поля
Лиганды правой части ряда (лиганды сильного поля) приводят к значительному расщеплению энергии d –подуровня, при этом величина Δ превышает энергию межэлектронного отталкивания спаренных электронов. Это означает, что энергетически более выгодно заполнять электронами АО с нарушением правила Гунда. Например, в случае октаэдрического расположения лигандов сильного поля электроны будут заполнять АО сначала по одному, а затем по второму d ε серию, а затем в таком же порядке d γ серию (см. рис.4). Для тетраэдрического поля порядок будет обратный.


Рис.4. Распределение электронов d –подуровня в ионе Co3+ при
октаэдрическом расположении лигандов сильного поля
ТПЛ также как и МВС позволяет объяснять магнитные свойства комплексов: при наличии неспаренных электронов – комплекс парамагнитен, а при их отсутствии – диамагнитен.
Если на d γ подуровне в случае октаэдрического поля лигандов (или на d ε подуровне для тетраэдрического поля) есть вакантная (свободная) АО, то при поглощении комплексным ионом кванта света возможен переход электрона с нижнего энергетического подуровня на. Такого рода переходы определяют наличие окраски у КС, так как энергия поглощаемого кванта света равна энергии расщепления. В расчете на 1 моль поглощающего вещества справедливо соотношение (Дж/моль)
 ,
,
где h – постоянная Планка (h = 6,63×10–34 Дж×с); с – скорость света (с = 3×108 м/с); N А – постоянная Авогадро (N А = 6, 02×1023 моль–1); l – длина волны поглощаемого света, м.
При поглощении света с длиной волны определённой части спектра, вещество оказывается окрашенным в соответствующий цвет. При замене в комплексе одних лигандов на другие, обладающие большей силой поля, значение Δ возрастает, и комплекс начинает поглощать лучи света с меньшей длиной волны. Это изменяет его окраску. Например, у комплексов меди (II) при переходе от [CuCl4]2+ к [Cu(H2O)4]4+ и к [Cu(NH3)4]2+ цвет изменяется от зелёного через голубой на сине-фиолетовый.
При характеристике устойчивости комплексов используют такие понятия, как устойчивость и инертность или неустойчивость и лабильность. Устойчивость комплекса является его термодинамической характеристикой и связана с энергиями образующихся связей и с изменением энтропии при комплексообразовании. Инертность и, наоборот, лабильность комплекса являются его кинетическими характеристиками, зависящими от скоростей замещения его лигандов. Устойчивые комплексы могут быть инертными и лабильными. Например, ионы [Cr(H2O)6]3+ и [Fe(H2O)6]3+ имеют близкие значения энергии связи, т.е. обладают почти одинаковой устойчивостью, но первый комплекс инертен и обменивает лиганды медленно, а второй лабилен, так как обменивает лиганды быстро. Неустойчивые комплексы чаще всего являются лабильными.
При растворении в воде КС, имеющие внешнюю сферу, диссоциируют как сильные электролиты с образованием комплексного иона, состоящего из частиц внутренней сферы, и ионов внешней сферы. Этот процесс называется первичной диссоциацией. Например
К4[Fe(CN)6] ® 4К+ + [Fe(CN)6]4–
Наряду с этим процессом, как правило, протекает обратимая ступенчатая диссоциация внутренней сферы, которую называют вторичной диссоциацией. Так для иона [Fe(CN)6]4– этот процесс идет по следующим ступеням
первая ступень [Fe(CN)6]4– ↔ CN– + [Fe(CN)5]3–
вторая ступень [Fe(CN)5]3– ↔ CN– + [Fe(CN)4]2– и т.д.
Количественной характеристикой прочности комплексного иона является константой равновесия процесса вторичной диссоциации, которую называют константой нестойкости К нест. Например, для иона [Fe(CN)6]4– константы нестойкости первой и второй ступеней выражаются уравнениями
 ;
; 
На практике чаще пользуются величиной общей константы нестойкости К нест, которая характеризует суммарное равновесие вторичной диссоциации. Например, для иона [Fe(CN)6]4–
[Fe(CN)6]4– ↔ 6CN– + Fe2+, 
К нестравна произведению констант нестойкости всех ступеней:
К нест= К нест, 1· K нест, 2· K нест, 3·... K нест, n
Иногда вместо К нест пользуются обратной величиной – констанойи устойчивости К уст
К нест= 1/ К уст
Если комплексы имеют одинаковое число лигандов, то их устойчивость можно определить по общей константе нестойкости: чем меньше К нест, тем более устойчив комплексный ион.
Сопоставление К нест комплексов для реагента и для продукта (при постоянном КЧ) позволяет установить направление смещения равновесия реакции обмена лигандами в растворе. Например для процесса
K2[PtCl4] + 4KI ↔K2[PtI4] + 4KCl,
сравнив К нест ионов [PtCl4]2– и [PtI4]2–, которые равны 1×10-16 и 1×10-31 соответственно, видно, что комплексный ион – продукт намного устойчивее комплекса – реагента. Следовательно, равновесие такого процесса сильно сдвинуто вправо, то есть данная реакция протекает в прямом направлении.
Примеры решения задач
Пример 1. Определите заряд комплексообразователя в соединении [Co(NH3)4Cl2]NO2. Назовите это соединение.
Р е ш е н и е
Внешняя сфера КС состоит из одного аниона NO  , следовательно, заряд всей внутренней сферы равен +1, то есть [Co(NH3)4Cl2]+. Внутренняя сфера содержит две группы лигандов NH3 и Cl–. Степень окисления комплексообразователя обозначаем через х и решаем уравнение
, следовательно, заряд всей внутренней сферы равен +1, то есть [Co(NH3)4Cl2]+. Внутренняя сфера содержит две группы лигандов NH3 и Cl–. Степень окисления комплексообразователя обозначаем через х и решаем уравнение
+1 = 1× х + 0·4 + 2·(–1). Отсюда х = +1.
Таким образом, КС является комплексным катионом. Название соединения: нитрит дихлоротетрааммин кобальта (+1).
Пример 2. Почему ион [Cu(NH3)2]+ имеет линейное строение?
Р е ш е н и е
Определяем заряд комплексообразователя в данном комплексном ионе
+1 = 1× х + 0·2. Отсюда х = +1.
Электронное строение валентных подуровней иона Cu+ отвечает конфигурации 3 d 104 s 04 р 0. Так как 3 d – подуровень не содержит вакансий, то в образовании связей по донорно-акцепторному механизму (в качестве акцептора) со стороны Cu+ участвуют одна 4 s и одна 4 p орбитали, которые гибридизируются по типу sp. Такому типу гибридизации (см. табл. 1) соответствует линейное строение комплекса.
Пример 3. Определите тип гибридизации АО центрального иона и геометрическое строение комплекса [HgCl4]2–.
Р е ш е н и е
Электронная конфигурация центрального иона Hg2+: 5 d 106 s 06 р 0, а электронно-графическая схема может быть представлена следующим образом
 |
 Химическая связь образуется по донорно-акцепторному механизму, где каждый из четырёх лигандов-доноров (ионы Cl–) предоставляет по одной неподелённой паре электронов (пунктирные стрелки), а комплексообразователь (ион Hg2+) – свободные АО: одну 6 s и три 6 p АО
Химическая связь образуется по донорно-акцепторному механизму, где каждый из четырёх лигандов-доноров (ионы Cl–) предоставляет по одной неподелённой паре электронов (пунктирные стрелки), а комплексообразователь (ион Hg2+) – свободные АО: одну 6 s и три 6 p АО
Таким образом, в данном комплексном ионе имеет место sp3 гибридизация АО, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
Пример 4. Составьте энергетическую диаграмму образования связей в комплексе [Fe(CN)6]3– и укажите тип гибридизации орбиталей центрального атома. Какими магнитными свойствами обладает комплекс?
Р е ш е н и е
Электронная конфигурация центрального иона Fe3+:…3 d 54 s 04 p 04 d 0. Шесть монодентатных лигандов CN– создают сильное октаэдрическое поле и образуют шесть σ–связей, предоставляя неподеленные пары электронов атома углерода на свободные АО комплексообразователя Fe3+, при этом происходит снятие вырождения АО 3 d подуровня комплексообразователя. Энергетическая диаграмма комплекса имеет вид
|












|
 | |||||||
 | |||||||
 |  | ||||||
|
|

 | |||
|
Пять 3 d -электронов полностью распределяются на орбиталях 3 d ε серии, так как энергия расщепления, которая возникает при взаимодействии с лигандами сильного поля, оказывается достаточной для максимального спаривания электронов. Свободные 3 d, 4 s и 4 р– орбитали подвергаются d 2 sp 3–гибридизации и обуславливают октаэдрическую структуру комплекса. Комплекс является парамагнетиком, т.к. имеется один неспаренный электрон
 |
Пример 5. Составьте энергетическую диаграмму образования связей в комплексе [CrF4]– и укажите тип гибридизации.
Р е ш е н и е
Электронная формула Cr3+: …3 d 34 s 04 p 04 d 0. Монодентатные лиганды F– образуют четыре σ–связи, являются лигандами слабого поля и создают тетраэдрическое поле












|


|
|
|
 | |||
 | |||



| |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
|
Свободные две 3 d, одна 4 s и одна 4 р АО комплексообразователя гибридизируются по типу d 2 sp, в результате образуется парамагнитный комплекс тетраэдрической конфигурации.
Пример 6. Объясните, почему ион [CoF6]3– парамагнитный, а ион [Co(CN)6]3– диамагнитный.
Р е ш е н и е
Электронная формула комплексообразователя Со3+: …3 d 6. В октаэдрическом поле лигандов F– (лиганд слабого поля) происходит незначительное расщепление d– подуровня, поэтому электроны заполняют АО в соответствии с правилом Гунда (см. рис.3). В этом случае имеется четыре непарных электрона, поэтому ион [CoF6]3– парамагнитный. При образовании иона [Co(CN)6]3– с участием лиганда сильного поля (ион CN–) энергия расщепления d– подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. Электроны будут заполнять АО иона Со3+ с нарушением правила Гунда (см. рис.4). В этом случае все электроны спарены, сам ион – диамагнитный.
Пример 7. Для иона [Cr(H2O)6]3+ энергия расщепления равна 167,2 кДж·моль–1. Какова окраска соединений хрома (III) в водных растворах?
Р е ш е н и е
Для определения окраски вещества определим длину волны, при которой происходит поглощение света
 или
или  нм.
нм.
Таким образом, ион [Cr(H2O)6]3+ поглощает свет в красной части спектра, что соответствует окраске соединения хрома (III) зелёного цвета.
Пример 8. Установите, выпадет ли осадок сульфида серебра (I) при температуре 25°С, если смешать равные объёмы 0,001 М раствора [Ag(CN)2]–, содержащего одноимённый лиганд CN– с концентрацией 0,12 моль/дм3, и раствора иона-осадителя S2– с концентрацией 3,5·10–3 М.
Р е ш е н и е
Процесс диссоциации для данного иона можно представить схемой
[Ag(CN)2]– ↔ Ag+ + 2CN–,
а процесс осаждения можно записать так
2Ag+ + S2– ↔ Ag2S¯.
Чтобы определить будет ли образовываться осадок необходимо рассчитать произведение растворимости сульфида серебра ПР(Ag2S) по формуле

Для определения концентрации ионов серебра запишем выражение для константы нестойкости комплексного иона
 . Отсюда
. Отсюда 
По справочнику выбираем значение константы нестойкости комплекса [Ag(CN)2]– (К нест = 1·10-21). Тогда
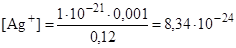 моль/дм3.
моль/дм3.
Рассчитаем произведение растворимости образующегося осадка
 .
.
По справочнику выбираем табличное значение произведения растворимости сульфида серебра (ПР(Ag2S)табл = 5,7·10–51) и сравниваем его с расчетным. Поскольку ПРтабл < ПРрасчет, то из данного раствора осадок выпадает, так как соблюдается условие выпадения осадка.
Пример 9. Вычислите концентрацию ионов цинка в растворе тетрацианоцинката натрия с концентрацией 0,3 моль/дм3 при избытке цианид–ионов в растворе равном 0,01 моль/дм3.
Р е ш е н и е
Первичная диссоциация протекает практически полностью по схеме
Na2[Zn(CN)4] → 2Na2+ + [Zn(CN)4]2–
Вторичная диссоциация идет по уравнению
[Zn(CN)4]2– ↔ Zn2+ + 4CN–
Запишем для данного процесса выражение константы нестойкости
 . Отсюда
. Отсюда 
По справочнику находим значение константы нестойкости данного иона (К нест = 1,3·10-17). Концентрация цианид–ионов, образующихся в результате диссоциации комплекса, гораздо меньше концентрации введенного избытка, и можно полагать, что [CN–]» 0,01 моль/дм3, то есть концентрацией ионов CN–, образующихся в результате диссоциации, можно пренебречь. Тогда
 моль/дм3.
моль/дм3.
Литература
1. Павлов Н.Н. Общая и неорганическая химия: Учеб. для вузов. М.: ООО «Дрофа», 2002;
2. Общая химия в формулах, определениях, схемах / И.Е. Шиманович, М.Л. Павлович, В.Ф. Тикавый, П.М. Малашко; Под ред. В.Ф. Тикавого. Мн.: Унiверсiтэцкае, 1996;
3. Задачи по общей и неорганической химии: Учеб. пособие для студентов высш. учеб. заведений / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева; под ред. Р.А. Лидина. – М.: Гуманитар. изд. центр ВЛАДОС, 2004;
4. Задачи и упражнения по общей химии: Учеб. пособие / Б.И. Адамсон, О.Н. Гончарук, В.Н. Камышова и др.; под ред. Н.В. Коровина. – М.: Высш. шк., 2003;
5. Сборник задач и упражнений по общей химии: Учеб. пособие / С.А. Пузаков, В.А. Попоков, А.А. Филиппова. – М.: Высш. шк., 2004;
6. Сборник задач и упражнений по общей химии: Учеб. пособие для нехим. спец. вузов / Л.М. Романцева, З.И. Лещинская, В.А. Суханова. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1991;
7. Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. Пособие для вузов. – М.: Интеграл-Пресс, 2001;
8. Рабинович В.А., Хавин З.Я. Краткий химический справочник. Л.: Высш. шк., 1991.
Содержание
Введение.................................................................................................... 3
Энергетика химических процессов.......................................................... 3
Краткие теоретические сведения........................................................... 3
Примеры решения задач....................................................................... 10
Химическая кинетика и равновесие......................................................... 17
Краткие теоретические сведения........................................................... 17
Примеры решения задач....................................................................... 22
Комплексные соединения......................................................................... 28
Краткие теоретические сведения........................................................... 28
Примеры решения задач....................................................................... 39
Литература................................................................................................ 45





 Е 0
Е
Е 0
Е 

