Стан рівноваги оборотного хімічного процесу

характеризується константою рівноваги  , що виражена через
, що виражена через
рівноважні молярні концентрації учасників реакції, або константою рівноваги  , що виражена через їх рівноважні парціальні тиски.
, що виражена через їх рівноважні парціальні тиски.
Константи рівноваги 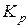 та
та  пов’язані співвідношенням
пов’язані співвідношенням  , де
, де  – зміна кількості молів газоподібних речовин внаслідок перебігу хімічної реакції.
– зміна кількості молів газоподібних речовин внаслідок перебігу хімічної реакції.
Рівняння ізотерми хімічної реакції пов’язує зміну ізобарного потенціалу внаслідок реакції та її константу рівноваги:
 ,
,
де 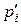 - нерівноважний (вихідний) парціальний тиск і - того учасника реакції.
- нерівноважний (вихідний) парціальний тиск і - того учасника реакції.
Якщо відома константа рівноваги реакції та вихідні тиски кожного газу, то за рівнянням ізотерми можна визначити напрямок перебігу хімічного процесу. Самочинні ізотермічні процеси уможливлюються за умови зменшення ізобарного потенціалу, тому при  реакція перебігатиме у напрямку утворення продуктів, а при
реакція перебігатиме у напрямку утворення продуктів, а при 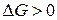 - у напрямку вихідних речовин. Якщо
- у напрямку вихідних речовин. Якщо  , то система перебуває у стані рівноваги.
, то система перебуває у стані рівноваги.
За умови 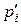 =1 атм стандартна зміна ізобарного потенціалу за будь-якої температури складає:
=1 атм стандартна зміна ізобарного потенціалу за будь-якої температури складає:
 .
.
Таким чином, за стандартною зміною енергії Гіббса можна обчислити константу рівноваги за рівнянням:
 .
.
Визначена за цим рівнянням константа рівноваги має розмірність (атм)Dn . Для переведення в СІ (Па)Dn її потрібно помножити на (1,013×105)Dn.
Температурну залежність константи рівноваги 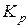 описує рівняння ізобари хімічної реакції:
описує рівняння ізобари хімічної реакції:
 .
.
Інтегрування цього рівняння з урахуванням одержаної раніше залежності 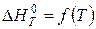 уможливлює точне обчислення константи рівноваги при різних температурах за рівнянням:
уможливлює точне обчислення константи рівноваги при різних температурах за рівнянням:
 ,
,
де  - стала інтегрування в залежності
- стала інтегрування в залежності 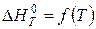 .
.
Сталу інтегрування В розраховують за відомою константою рівноваги при 298 К за формулою:

Значення В потрібно обчислити з точністю до тисячних.
Завдання 2. Розрахунок констант рівноваги хімічних реакцій
Для наведеної в додатку 1 реакції:
1. розрахувати при 298 К константи рівноваги 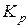 в (атм)Dn , (Па)Dn та
в (атм)Dn , (Па)Dn та  в (моль/л)Dn , (моль/м3)Dn;
в (моль/л)Dn , (моль/м3)Dn;
2. вивести рівняння залежності константи рівноваги від температури  ; зазначити інтервал температур, в якому можна застосовувати це рівняння;
; зазначити інтервал температур, в якому можна застосовувати це рівняння;
3. обчислити за цим рівнянням 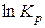 та
та 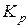 в (атм)Dn при 400, 500 та 600 К;
в (атм)Dn при 400, 500 та 600 К;
4. порівняти значення  , визначене за формулою
, визначене за формулою  та за рівнянням ізобари;
та за рівнянням ізобари;
5. розрахувати 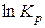 та
та 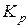 при 700 та 800 К за методом Тьомкіна-Шварцмана;
при 700 та 800 К за методом Тьомкіна-Шварцмана;
6. побудувати графіки залежності  та
та  (за шістьма точками);
(за шістьма точками);
7. визначити за графіком 
 та
та  реакції;
реакції;
8. визначити напрямок перебігу реакції при 500 К, якщо нерівноважний парціальний тиск кожного газу у реакційній суміші складає 1×104 Па.
ФАЗОВІ РІВНОВАГИ






