Вода составляет основу жидких дисперсных систем организма: крови, лимфы, мочи, слюны, желудочного и кишечного соков, синовиальной и спинномозговой жидкостей, внутреннего содержимого клеток, межклеточной жидкости. Дисперсными называются системы, состоящие из мелко раздробленных частиц одного вещества, распределенных в массе другого вещества. Раздробленное вещество называют дисперсной фазой. Вещество, в котором происходит распределение частиц дисперсной фазы, называется дисперсионной средой. В большинстве жидких дисперсных систем организма вода является дисперсионной средой. В клеточных мембранах, состоящих в основном из белков и липидов, она может играть роль дисперсной фазы. По степени дисперсности (т. е. размеру частиц дисперсной фазы) различают истинные растворы, коллоидные растворы и взвеси (табл. 1).
Истинные растворы гомогенны (однородны), прозрачны, оптически пусты (направленный луч света в них не виден), между частицами дисперсионной среды и дисперсной фазы отсутствует поверхность раздела. Частицы дисперсной фазы в истинных растворах настолько малы, что легко проходят через бумажные фильтры и животные мембраны, не оседают под действием силы тяжести, поэтому системы устойчивы, т. е. неограниченно долго не разделяются на дисперсную фазу и дисперсионную среду. Дисперсной фазой в истинных растворах являются отдельные молекулы или ионы.
Таблица 1. Классификация дисперсных систем по степени дисперсности.
| Название системы | Размер частиц дисперсной фазы | Пример системы |
| Истинные растворы: молекулярные ионные | Менее 10-7 см | Растворы моносахаридов, спиртов, альдегидов, кетонов, эфиров и т. п. Растворы кислот, оснований, солей. |
| Коллоидные растворы: лиофильные - жидкие (золи) и студнеобразные (гели) лиофобные - жидкие (золи) | 10-7-10-5 см | Растворы белков и полисаха-ридов. Золи металлов. |
| Взвеси: суспензии, эмульсии | Более 10-5 см | Взвесь эритроцитов в плазме крови. Молоко, взвесь жировых капель в кишечном соке. |
В коллоидных растворах частицы дисперсной фазы представляют собой агрегаты из множества мелких молекул или ионов или гигантские полимерные молекулы. Такие частицы имеют четко выраженную поверхность, на которой происходят адсорбционные процессы, и сложную структуру (рис.3).
Как и частицы в истинных растворах, коллоидная частица взаимодействует с растворителем. Коллоидный раствор, в котором связь между коллоидной частицей и дисперсионной средой непрочная, называется лиофобным (водный - гидрофобным). Лиофобными являются в основном неорганические коллоиды. Если эта связь прочная, молекулы растворителя могут содержаться и в ядре, и в адсорбционном слое коллоидной частицы. Такие коллоидные растворы называются лиофильными (водные-гидрофильными). Гидрофильные коллоидные системы образуют в тканях организма белки и полисахариды.
Коллоидные частицы имеют размеры, позволяющие проходить через бумажные фильтры, однако мембраны задерживают их. Направленный на коллоидный раствор луч света становится видимым, так как коллоидные частицы вызывают дифракционное рассеяние света.
Рис. 3. Строение коллоидной частицы.
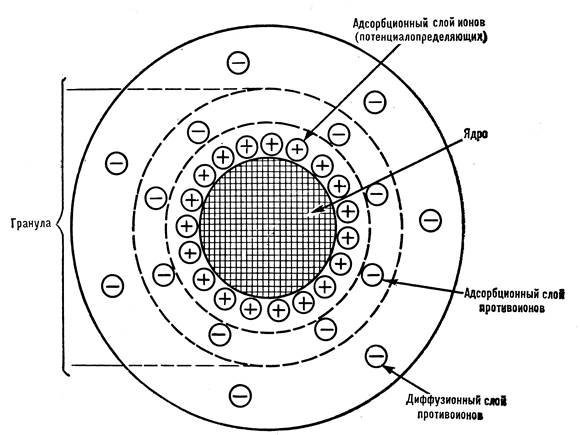
Коллоидные частицы не оседают под действием силы тяжести, электростатически отталкиваются друг от друга, что является одной из причин относительной устойчивости коллоидных систем. Любое воздействие на коллоидную систему, приводящее к уменьшению электрического заряда гранулы, понижает устойчивость системы. Лишенные заряда гранулы слипаются друг с другом, образуя более крупные агрегаты. Этот процесс носит название коагуляции. Укрупнившиеся частицы дисперсной фазы отделяются от дисперсионной среды - происходит седиментация (выпадение осадка). У гидрофильных коллоидов дополнительным фактором устойчивости является водная оболочка коллоидной частицы. Пока она не разрушена, нейтрализация коллоидных гранул не приводит к коагуляции коллоида.
Гидрофильные коллоидные растворы могут находиться в двух состояниях - жидком и студнеобразном, связанных взаимными переходами. Жидкие коллоидные системы называются золями, а студнеобразные - гелями. В гелях частицы дисперсной фазы взаимодействуют друг с другом с образованием трехмерной сетчатой структуры, в ячейках которой в связанном состоянии находятся молекулы воды. Переход из золя в гель возможен при понижении температуры раствора, увеличении его концентрации, под действием электролитов и т. п. Примером такого перехода является свертывание крови. Из геля в золь переходят мышечные белки при сокращении мышцы. Этому сопутствует резкое изменение вязкости, тесно связанное с рядом физиологических и биологических явлений: мышечным сокращением, дифференциацией некоторых внутриклеточных структур, клеточным делением, движением протоплазмы и т. п.
Коллоидные растворы являются микрогетерогенными. Гетерогенность (неоднородность) их увеличивается с возрастанием размеров частиц дисперсной фазы. Устойчивость системы при этом уменьшается. Во взвесях частицы дисперсной фазы настолько велики, что не проходят ни через мембраны, ни через бумажные фильтры. Они рассеивают свет в результате отражения и преломления, поэтому взвеси непрозрачны. Под действием силы тяжести происходит быстрое расслоение взвеси на дисперсную фазу и дисперсионную среду. Они образуются в том случае, если дисперсионная среда полярна, а дисперсная фаза неполярна (или наоборот). Устойчивость взвесей можно повысить, если ввести в них стабилизатор - вещество, имеющее достаточно большой неполярный радикал, соединенный с полярной функциональной группой. Стабилизатор располагается на поверхности частиц дисперсной фазы, ориентируясь радикалом в направлении неполярных веществ, а функциональной группой - в направлении полярных. Образуя тонкую пленку на поверхности частиц, стабилизатор предохраняет их от слипания друг с другом.
Если частицы дисперсной фазы образованы твердым веществом, взвесь называется суспензией; если частицы дисперсной фазы жидкие - эмульсией. Наиболее распространенными в живых организмах взвесями являются водные эмульсии жиров и жироподобных веществ. Стабилизаторами в них могут быть белки, жирные кислоты и их соли - мыла, а также желчные кислоты.
В биологических жидкостях различные виды дисперсных систем образуют сложные комбинации. Например, кровь представляет собой коллоидный раствор белков, в котором взвешены кровяные клетки и жировые капли, истинный раствор минеральных солей, глюкозы, аминокислот, молочной кислоты и других веществ.






