Эукариотические организмы (и особенно млекопитающие) устроены значительно сложнее прокариотов и нуждаются в более сложном аппарате регуляции. Так, в организме человека имеется более 200 различных типов клеток, существенно различающихся по структуре и функциям. В то же время различными методами исследования ДНК (прежде всего, методом молекулярной гибридизации) доказано, что количество и структура ДНК практически всех клеток организма одинаковы (за исключением лимфоцитов), т.е. все клетки организма содержат один и тот же геном. У высших организмов по сравнению с прокариотическими существенно возрастает содержание ДНК на гаплоидную клетку: с 4,2×106 пар нуклеотидов у Е. coli до 3,3×109 пар нуклеотидов в клетках человека.
Организация хроматина в дифференцированных клетках многоклеточного организма. В клетках млекопитающих наряду с адаптивной регуляцией, обеспечивающей приспособление организма к меняющимся условиям внутренней и внешней среды, существуют механизмы, которые сохраняют стабильную (существующую на протяжении всей жизни клетки и даже многих её генераций) репрессию одних генов и депрессию других. В ядрах дифференцированных клеток хроматин имеет такую укладку, что только небольшое число генов (часто менее 1%) доступно для транскрипции. Различают участки гетерохроматина, в которых ДНК упакована очень компактно и недоступна для транскрипции, и участки эухроматина, имеющие более рыхлую укладку и способные связывать РНК-полимеразу. В разных типах клеток в область эухроматина попадают разные гены, а это означает, что в разных тканях транскрибируются разные участки хроматина.
Стойкая репрессия генов гетерохроматина обеспечивается:
- пространственной укладкой ДНК, при которой гетерохроматин находится в высококонденсированном состоянии;
- метилированием дезоксицитидина ДНК-ме-тилазами в 5'-CG-3' последовательностях ДНК. Эта модификация сильно меняет кон-формацию хроматина и препятствует активной транскрипции;
- связыванием с гистонами и образованием нуклеосом, которые также снижают транскрипционную активность ДНК.
Исследования показали, что области эухроматина, в которых расположены активно транскрибируемые гены, обладают некоторыми структурными особенностями:
- они более чувствительны к действию ДНК-аз, чем остальные участки ДНК;
- молекулы гистонов, связанные с ДНК в этих участках, модифицированы: е-аминогруппа лизина метилирована или ацетилирована; метилированы некоторые остатки аргинина и гистидина в гистонах Н2А и Н2В, являющихся коревыми белками нуклеосом. Некоторые молекулы Н2А образуют прочный комплекс с белком убиквитином. В гистоне HI фосфорилируются остатки серина. Результат этой серии ковалентных модификаций - снижение суммарного, положительного заряда гистонов и ослабление сродства нуклеосом к ДНК.
- к областям "активного" хроматина присоединяется группа негистоновых HMG-бел-ков, или белков с высокой подвижностью при гель-электрофорезе. Эти белки содержат много положительно заряженных аминокислотных остатков, связывание с которыми ослабляет взаимодействие ДНК и гистонов и вызывает дополнительное повышение транскрипционной активности генов.
Разнообразие клеток и возросшая сложность клеточных процессов нуждаются в большом разнообразии механизмов регуляции. Показано, что разный набор и количество белков в эукариотических клетках может регулироваться:
- изменением количества структурных генов;
- перестройкой генов в хромосомах;
- эффективностью транскрипции разных участков генома;
- характером посттранскрипционных модификаций первичных транскриптов;
- на уровне трансляции;
- с помощью посттрансляционных превращений вновь синтезированных полипептидных цепей.
Изменениеколичествагенов. Геном эукариотов обнаруживает высокую пластичность, играющую важную роль в регуляции активности некоторых генов и увеличивающую разнообразие клеточных ответов. У млекопитающих реализуются следующие варианты изменений в структуре генов:
· Амплификация (илиувеличениечисла) генов используется организмом в том случае, когда возникает необходимость увеличить синтез определённого генного продукта. Многие гены, кодирующие белки или РНК, необходимые организму в больших количествах (например, гистоны, рРНК, тРНК), постоянно присутствуют в амплифицированном соетрянии. Так, у человека 20% общего генома состоит из участков, кодирующих рибосомные, транспортные и ядрышковые РНК, последние из которых обеспечивают посттранскрипционные модификации РНК. Амплифицированные участки могут располагаться друг за другом (тандемно) в хромосоме или образовывать внехромосомные фрагменты ДНК, называемые двойными мини-хромосомами, их размер колеблется от 100 до 1000 килобаз (1 килобаза = 1000 пар нуклеотидов). Описано более 20 генов, способных амплифицироваться при определённых условиях.
К числу генов, для которых обнаружена амплификация, относят ген металлотионеина. Продукт экспрессии этого гена - низкомолекулярный белок металлотионеин, обладающий способностью связывать тяжёлые металлы (медь, цинк, кадмий, ртуть) и защищать клетки от отравления этими соединениями. Установлено, что в ответ на повышение концентрации тяжёлых металлов в крови в клетках происходит амплификация гена металлотионеина.Другими примерами генов, количество которых увеличивается под влиянием лекарственных препаратов, являются ген дигидрофолатредуктазы и ген Р-гликопротеина, ответственный за синтез белка, обеспечивающего множественную лекарственную устойчивость опухолевых клеток.
· Утратагенетическогоматериала -довольно редкий способ регуляции. Наиболее яркий пример потери всех генов за счёт разрушения ядра - процесс созревания эритроцитов. Нестабильны амплифицированные гены, двойные хромосомы. Они, как правило, исчезают в последующих генерациях. Утрата генетического материала происходит в процессе созревания лимфоцитов и образования плазматических клеток разных клонов, синтезирующих секретируемые формы иммуноглобулинов.
Перестройка генов. У высших организмов, так же как и у прокариотов, отмечают процесс обмена, перемещения генов между хромосомами или внутри хромосомы, объединение генов с образованием изменённой хромосомы, которая после таких структурных изменений способна к репликации и транскрипции. Этот процесс получил название "генетическая рекомбинация".
У эукариотов рекомбинации наблюдают:
- при половом слиянии яйцеклетки и сперматозоида;
- при перемещении подвижных генетических элементов - транспозонов, в состав которых входят отдельные гены или группа генов, с исходной позиции в какое-либо другое место той же или другой хромосомы;
- при формировании в лимфоцитах "библиотеки" генов, кодирующих антитела или иммуноглобулины.
Рассмотрим более подробно механизмы, обеспечивающие образование в организме каждого человека около 10 млн (107) различных антител, т.е. количества значительно большего, чем число всех других белков, существующих у каждого индивидуума. Антитела с одинаковыми антигенсвязывающими свойствами синтезируются В-лимфоцитами, принадлежащими к одному определённому клону (т.е. группе клеток, возникшей из одной родоначаль-ной клетки), При попадании в организм любого антигена среди имеющегося набора В-лимфоцитов всегда найдётся такой клон клеток, антитела которого имеют комплементарный ему активный центр. Антитела встроены в плазматическую мембрану В-лимфоцитов, и их антигенсвязывающие участки локализованы на поверхности клеток. Антиген, присоединяясь к активному центру антитела, вызывает пролиферацию клеток и превращение В-лимфоцитов в плазматические клетки, в которых идут активный синтез и секреция не связанных с мембраной антител.Изучение вопроса о происхождении антител позволило сделать вывод о том, что огромное многообразие белков иммунной системы кодируется ограниченным количеством генетического материала, изменения в котором обеспечиваются рекомбинациями и соматическими мутациями (или изменениями в структуре ДНК, которые сохраняются при последующих делениях клеток). Вспомним, что мономерные антитела - доменные белки, состоящие из двух идентичных тяжёлых (Н) цепей и двух идентичных лёгких (L) цепей. Лёгкие цепи имеют двухдоменную структуру и включают вариабельный (VL) и константный (CL) домены. Тяжёлая цепь состоит из 4-5 доменов: одного вариабельного (VH) и, как правило, трёх константных (СH). Иммуноглобулины - гликопротеины; их углеводная часть присоединяется к константной области Н-цепей. В связывании антигенов участвуют 2 активных центра антитела, образованные вариабельными областями Н-цепей (VH) и L-цепей (VL). L-цепи бывают двух типов: λ (лямбда) и κ (каппа), значительно различающиеся по первичной структуре С-областей. Наличие в антителах С- и V-областей позволило предположить, что гены, обеспечивающие синтез L- и Н-цепей, образуются в результате соединения двух участков гена, один из которых кодирует вариабельную область, а второй - константную. И действительно вскоре было установлено, что в зародышевых клетках и соматических клетках, не синтезирующих иммуноглобулины, участки гена, кодирующие V- и С-области L-цепей λ-типа, разделены протяжёнными нуклеотидными последовательностями, но сближены в зрелых В-лимфоцитах, синтезирующих Lλ Из этого следовал вывод о том, что в процессе дифференцировки В-лимфоцита из зародышевой клетки происходит "вырезание" протяжённого участка генетического материала, обеспечивающее сближение VL- и Cλ-областей с образованием полного гена L-цепи иммуноглобулина. Этот процесс перестройки в геноме получил название соматической рекомбинации, так как он связан с созреванием лимфоцитов и не передаётся по наследству. Описано 3 разных семейства генных фрагментов, или сегментов, кодирующих строение L- и Н-цепей Ig. Два семейства ответственны за синтез лёгких цепей: сегменты, кодирующие строение L-цепей типа λ, расположены в хромосоме 22, генетический материал L-цепей типа к (каппа) - в хромосоме 2, а информация о всём разнообразии Н-цепей локализована в хромосоме 14. Полные гены L-цепей λ и κ типов в ходе дифференцировки собираются из 3 сегментов: вариабельного (VL), соединительного (JL) и константного (CL). Так, для L-цепей к типа обнаружено около 300 сегментов, кодирующих N-концевой вариабельный (Vκ) участок полипептидной цепи длиной в 95 аминокислотных остатков, 5 сегментов, в которых содержится информация об остальных 13 аминокислотах Vκ области, и 1 сегмент константной области. В зародышевых клетках 300 сегментов Vκ расположены в хромосоме последовательно на расстоянии 7 килобаз друг от друга. Каждый V-сегмент состоит из 2 экзонов, разделённых коротким интроном: лидирующий экзон (L) кодирует сигнальный пептид (20-25 аминокислотных остатков), а экзон Vκ - основную часть вариабельного домена. Семейство Vκ-сегментов отделено от группы соединительных сегментов (Тк) участком ДНК размером в 20 килобаз. Между последним из Jκ-сегментов и Сκ-экзоном, кодирующим домен константной области, расположен интрон размером в 2,4 килобазы. В ходе дифференцировки В-клеток один из вариабельных VL-сегментов путём соматической рекомбинации переносится из отдалённого участка в участок той же хромосомы, рядом с одним из сегментов JL. Например, сегмент V2 объединяется с соединительным мини-сегментом J4, и формируется полный ген L-цепи. Он состоит из 3 экзонов и 2 нитронов, расположенных в гене в следующем порядке: 5'L-I1-V2-J4-J5-I2-С-3', где L - лидерная последовательность, кодирующая сигнальный пептид, I, - интрон V2-сегмента, а 12 - интрон между семейством JL-сегментов и Сκ-экзоном. После транскрипции гена в ходе сплайсинга из первичного транскрипта удаляются интроны I1, I2и лишний сегмент J5, а все кодирующие последовательности соединяются в единую информационную молекулу зрелой мРНК. В процессе синтеза L-цепи на рибосоме лидерный участок, состоящий в основном из гидрофобных аминокислот, обеспечивает прохождение белка через мембрану ЭР и затем отщепляется. Образуется L-цепь, имеющая аминокислотный состав, характерный для L-цепи κ-типа в молекуле Ig. Расчёты показывают, что из имеющихся сегментов κ-гена в организме можно синтезировать 4500 полных генов, кодирующих L-цепи κ-типа. Формирование полных генов L-цепей λ-типа происходит так же, как L-цепей κ-типа. Ещё большее разнообразие вариантов возникает при сборке полных генов тяжёлых (Н) цепей Ig. Н-цепи кодируются четырьмя сегментами: VH, DH (от англ, diversity) сегментами разнообразия, JH и СH. У человека обнаружено около 500 VH, 15 DH и 4 JH сегментов. Каждый VH сегмент содержит информацию об аминокислотной последовательности сигнального пептида и около 100 аминокислот VH домена. В сегменте DH закодирован участок полипептидной цепи, содержащий от 2 до 13 аминокислот, а в сегменте JH - 4-6 аминокислот. Полный ген вариабельного домена образуется путём соединения VH, DH и JH сегментов. При формировании полного гена вариабельной части Н-цепи Ig, состоящей из VH, D и JHсегментов, происходит 2 рекомбинационные состыковки: на первом этапе удаляется участок между выбранными Dx и Jy кодирующими последовательностями, а на втором - между Vi и DxJy сегментами. Экзонов, кодирующих константную область Н-цепей, описано 10: Сμ, Сσ, Сγ3, Сγ1, Сα1, Сγ2α, Сγ2β, Сγ4, Сε и Сα2, они определяют классы и подклассы иммуноглобулинов - IgM, IgG, IgA и т.д. Первыми в иммунном ответе появляются IgM, поскольку к полному гену вариабельного домена ближе всех остальных С-экзонов находится Cμ, сегмент Н-цепи. Активированные В-клетки могут синтезировать мембранно-связан-ную и секретируемую формы IgM. Кроме того, они могут переключаться с синтеза IgM на образование антител других классов. Перед каждым СH экзоном имеется участок ДНК, называемый "участок переключения", или "свич-сайт" (от англ, swich site), построенный из повторяющихся нуклеотидных последовательностей. Эти участки облегчают протекание дополнительной рекомбинации, в ходе которой удаляются С-сегменты между полным геном вариабельной области и С-сегментом того класса, который должен быть включён. Исследование нуклеотидных последовательностей генов некоторых подклассов L-цепей к-типа и Н-цепей показало, что разнообразие структуры сегментов, закодированных в зародышевой клетке, увеличивают соматические мутации. Мутации происходят в дифференцированных клетках на участках VL-JL и VHDHJH сегментов в процессе или после рекомбинаций, делая, таким образом, количество антител практически неограниченным. Очень важно, что мутации происходят в областях, ответственных за узнавание антигенов, обеспечивая более полное соответствие активного центра антитела антигену. Таким образом, перестройки генетического материала в процессе формирования полных генов Ig происходят в несколько этапов, каждый из которых приурочен к строго определённой стадии дифференцировки В-лимфоцитов. Из сегментов, которые кодируют различные участки полипептидной цепи, входящей в вариабельные домены, и одного из экзонов константного домена собираются полные гены тяжёлых и лёгких нитей Ig. Сборка L-цепей включает одну соматическую рекомбинацию, а сборка Н-цепей происходит с помощью двух соматических рекомбинаций. Когда В-лимфоциты синтезируют Ig не класса М, то это сопровождается ещё одним дополнительным рекомбинационным событием. Соматические мутации, происходящие в зрелых В-лимфоцитах, делают многообразие антител неисчерпаемым. Аналогичные процессы наблюдают и в ходе дифференцировки Т-лимфоцитов.
Регуляциятранскрипции. Регуляция транскрипции генов высших организмов сходна с регуляцией экспрессии генов прокариотов. Основное различие состоит в значительно большем количестве участков ДНК и регуляторных факторов, контролирующих этот процесс. У животных и человека различные гены экспрессируются в разные моменты времени и с разной интенсивностью. Здесь, так же, как у прокариотов, есть гены "домашнего хозяйства", транскрибирующиеся конститутивно, т.е. постоянно и во всех тканях. Это гены гликолиза, синтеза РНК и некоторых белков (например, альбумина). Существуют гены, транскрибирующиеся только в специализированных клетках, т.е. имеет место тка-неспецифическая экспрессия. Например, экспрессия генов α- и β-цепей глобина происходит только в клетках-предшественниках эритроцитов. Многие гены подвергаются адаптивной регуляции и являются объектами индуцибельных воздействий или негативного контроля. Ранее уже говорилось о том, что минимальный синтез любого белка поддерживается в том случае, если к ТАТА-участку промотора присоединяется ТАТА-связывающий белок, факторы транскрипции и РНК-полимераза, образующие инициирующий комплекс, осуществляющий синтез небольшого количества мРНК. Формирование комплекса - многоступенчатый процесс, от образования которого зависит скорость инициации транскрипции. Идентифицировано более 100 различных белков, способных взаимодействовать со специфическими регуляторными последовательностями ДНК, влияя главным образом на процесс сборки транскрипционного комплекса и скорость транскрипции.
Эти белки имеют один или несколько доменов, обеспечивающих выполнение регуляторных функций.
· ДНК-связывающие домены, ответственные за узнавание и связывание регуляторных факторов со специфическими участками на молекуле ДНК;
· Домены, активирующие транскрипцию за счёт связывания с белками основного инициаторного комплекса: транскрипционными факторами, коактиваторами и РНК-поли-меразой;
· Антирепрессорные домены, благодаря которым белки способны взаимодействовать с гис-тонами нуклеосом и освобождать транскрибируемые участки ДНК от связи с этими ингибиторными структурами;
· Домены, связывающие лиганды, присоединение которых к белку изменяет его конформацию и обеспечивает связывание с молекулой ДНК. Лигандь1-индукторы транскрипции - стероидные гормоны, ретиноевая кислота, каль-цитриол (производное витамина D3) и гормоны щитовидной железы. Лигандами-репрессорами могут быть конечные продукты метаболических путей, некоторые гормоны. Будучи липофильньши молекулами, они проходят плазматическую, а иногда и ядерную мембраны, взаимодействуют с внутриклеточными рецепторами, присоединяясь к лиганд-связьгвающему участку. Присоединение лиганда к рецептору образует ДНК-связьшающий участок, узнающий специфическую последовательность в регуляторной зоне ДНК и индуцирующий транскрипцию определённых генов.
На молекуле ДНК на расстоянии 100-200 пар оснований от стартовой точки транскрипции имеются короткие специфические последовательности ДНК: СААТ - элемент (или бокс), CG-бокс и октамерный бокс (включающий 8 пар оснований), узнающие транскрипционные факторы. Эти элементы есть во всех клетках, и конститутивно экспрессируемые гены нуждаются только в них. В то же время для генов, подвергающихся адаптивной регуляции, обнаружены участки молекулы ДНК, которые удалены (до 1000 и более пар оснований) от промотора, но тоже участвующие в регуляции транскрипции. Эти нуклеотидные последовательности бывают 2 типов.
Энхансеры - участки ДНК размером 10-20 пар оснований, присоединение к которым регуляторных белков увеличивает скорость транскрипции. Если участки ДНК, связываясь с белками, обеспечивают замедление транскрипции, то их называют сайленсерами. Эти структурные элементы молекулы ДНК контролируют транскрипцию, даже если они ориентированы на молекуле ДНК в любом направлении (от 5'- к З'-концу или наоборот);
Элементы ответа, или cis-элементы -регуляторные последовательности ДНК, общие для группы генов. Они обеспечивают координированную регуляцию транскрипции генов и, как правило, располагаются на расстоянии примерно в 250 пар оснований выше промотора каждого гена. В остальном эти нуклеотидные последовательности имеют много общего с энхансерами. В данном варианте регуляции один и тот же индуктор, связываясь с соответствующим регуляторным белком, может активировать много разных генов, так как каждый из них в регуляторной области содержит один и тот же cis-элемент. Один из белков-продуктов этой группы генов может оказаться индуктором другой группы генов. Конечный результат регуляции - серия ответных реакций за счёт активации различных генов одним индуктором. К генам, регулируемым cis-элементами, относят гены, чувствительные к стероидным гормонам, гены белков теплового шока и многие другие. Например, при повышении температуры или после какого-либо другого клеточного стресса активируется синтез транскрипционного фактора, который индуцирует транскрипцию генов, кодирующих строение шаперонов. Очевидно, что эффективность регуляции во многом зависит от структуры транскрипционных факторов и внутриклеточных рецепторов, непосредственно взаимодействующих с молекулой ДНК. Установлено, что большинство ДНК-связывающих белков принадлежит к трём семействам в зависимости от структуры домена, непосредственно взаимодействующего с двойной спиралью ДНК. Эти белки включают структуры типа "спираль-поворот-спираль", "цинковые пальцы" и "лейциновой молнии" (см. раздел 1). Как правило, эти структуры - небольшие фрагменты молекул белков, а сайт-специфическое связывание происходит за счёт взаимодействия между радикалами аминокислот этих участков и азотистыми основаниями молекулы ДНК.
Посттранскрипционная регуляция. В организме животных существенное значение в обеспечении разнообразия белков играет посттранскрипционный процессинг РНК. Основные способы такой регуляции - альтернативный сплайсинг и изменение стабильности РНК.
Альтернативный сплайсинг. Установлено, что многие эукариотические гены, будучи транскрибированы, образуют несколько вариантов зрелой мРНК в ходе процессинга (или созревания) первичного транскрипта, имеющего полиэкзонное строение.Наиболее часто промотор сохраняется на одном из концов транскрипта, а в ходе сплайсинга происходит "вырезание" одного или нескольких экзонов. В других случаях в зрелой мРНК сохраняется часть интрона и включается в состав экзона с 5' или 3'-конца. Сплайсинг может влиять на выбор промотора или участка полиаденилирования. С помощью альтернативного сплайсинга в процессе синтеза антител образуются мембра-носвязанные и секреторные формы антител. Так, первоначально В-лимфоциты продуцируют транскрипты, полиаденилированные после второго стоп-кодона, а интрон, в котором имеется первый стоп-кодон, удаляется. В результате синтезируются IgM, связанные с клеточной мембраной, так как мРНК таких клеток содержит на 3'-конце экзон, кодирующий участок полипептидной цепи, состоящий из гидрофобных аминокислот. С помощью этого участка происходит "заякоривание" IgM в мембране. Когда В-лимфоциты превращаются в плазматические клетки, то в езультате альтернативного сплайсинга образуется мРНК, в которой сохраняется интрон, содержащий первый стоп-кодон. Поэтому происходит более раннее полиаденилирование и исчезает экзон, кодирующий гидрофобный участок молекулы. Синтезируются укороченные молекулы антител, секретируемые в кровь.
"Редактирование" РНК. Описан ряд случаев, когда первичная структура мРНК изменяется ("редактируется") после транскрипции. Последовательность нуклеотидов в таких генах одинакова, а транскрибируемая в разных тканях мРНК различается в результате появления в молекуле замен, вставок или выпадений нуклеотидов. Пример "редактирования" РНК - образование апопротеина В (апо-В) в клетках печени и тонкого кишечника. Апо-В - основной компонент липопротеинов, участвующих в транспорте триацилглицеринов из этих тканей в кровь. Хотя апопротеин В кодируется одним и тем же геном, вариант белка, образующийся в печени, называют апо-В-100, и он содержит 4563 аминокислотных остатка, тогда как белок, синтезированный в клетках кишечника, состоит из 2152 аминокислот. В гене, кодирующем этот белок, последовательность нуклеотидов в триплете 2153 - САА и шифрует включение в полипептидную цепь остатка глутамина. В клетках кишечника в первичном транскрипте гена азотистое основание - цитозин (С) ко-дона 2153 дезаминируется и превращается в урацил (U). Возникает стоп-кодон - UAA, прекращающий трансляцию мРНК в середине молекулы и приводящий к синтезу укороченного белка. В результате образуется белок (В-48), длина которого составляет 48% от длины белка синтезируемого печенью.
Изменение стабильности мРНК. Для того, чтобы участвовать в синтезе белка, мРНК должна выйти из ядра в цитоплазму через ядерные поры. Установлено, что в ядре клеток обычно синтезируется больший набор гетерогенных РНК, чем тот, что выходит в цитоплазму. Многие продукты транскрипции подвергаются расщеплению нуклеазами, а те мРНК, что, транспортируются из ядра в цитоплазму, защищаются от гидролитического разрушения, образуя комплексы с белками. Время жизни эукариотических мРНК значительно больше (t1/2 составляет от нескольких часов до нескольких дней), чем t1/2 мРНК прокариотов, равное нескольким минутам. Очевидно, что стабильность молекул мРНК - фактор, изменение которого влияет на уровень трансляции. Стабилизация мРНК при фиксированной скорости транскрипции приводит к накоплению и увеличению количества образующегося белкового продукта. Продолжительность жизни разных мРНК варьирует в достаточно широких пределах. Некоторые гены кодируют продукт с большой продолжительностью жизни. Так, в ходе транскрипции гена β-глобина образуется мРНК с t1/2, равной примерно 10 ч. Другие гены образуют мРНК с короткой продолжительностью жизни: мРНК, на которых синтезируются факторы роста, имеют t1/2 менее 1 ч. Показано, что поли(А)-фрагмент на 3'-конце мРНК увеличивает продолжительность жизни молекул. Чем длиннее поли(А)-фрагмент, тем больше время жизни мРНК. Описано много примеров регуляции количества синтезирующихся белков за счёт изменения продолжительности функционирования мРНК. Так, стабильность мРНК-матриц для синтеза молекул гистонов сильно зависит от фазы клеточного цикла. В S-фазе гистоны постоянно синтезируются и используются для укладки вновь образованной ДНК в нуклеосомы. Гистоновая мРНК в этот период стабильна в течение нескольких часов. После S-периода, когда ДНК уже не синтезируется, в клетках образуется небольшое количество гистонов, так как они не требуются для формирования нуклеосом. В этот период t1/2 для гистоновой мРНК составляет 10-15 мин.
Регуляция трансляции и посттрансляционных модификаций
Изменение скорости трансляции. Хотя изменение скорости образования белков на уровне трансляции не относят к числу основных способов регуляции количества и разнообразия белков, некоторые случаи такой регуляции известны. Наиболее изученный пример - синтез белков в ретикулоцитах. Известно, что на этом уровне дифференцировки кроветворные клетки лишены ядра, а следовательно, и ДНК. Регуляция синтеза белка-глобина осуществляется только на уровне трансляции и зависит от содержания тема в клетке (рис. 4-56). Если внутриклеточная концентрация тема высока, то глобин синтезируется; когда содержание тема снижается, то ингибируется и образование глобина. Остановка синтеза белка осуществляется за счёт фосфорилирования фактора инициации eIF2, который в фосфорилированной форме неактивен. Гем предотвращает фосфорилирование eIF2, связываясь со специфической протеинкиназой, которая получила название гемкиназы. Некоторые мРНК содержат элементы вторичной структуры на 5'- или 3'-концах нетранслируемого участка мРНК, к которым могут присоединяться белки и ингибировать трансляцию. Например, синтез ферритина - белка, обеспечивающего хранение ионов железа в клетке, усиливается при повышении внутриклеточной концентрации железа. Обнаружено, что мРНК ферритина на 5'-конце имеет петли, к которым при низкой концентрации железа присоединяется регудяторный белок. Когда этот белок связан с мРНК, то трансляция не идёт. Если концентрация ионов железа в клетке повышается, то Fe3+ взаимодействует с белком, изменяет его конформацию и сродство к мРНК. мРНК освобождается от регуляторного белка, и на ней начинается синтез ферритина.
Различия в продолжительности жизни молекул белка. После того как белки синтезированы, время их жизни регулируется протеазами. Разные белки имеют разные t1/2: от нескольких часов до нескольких месяцев, а иногда и лет. В каждой клетке скорость расщепления белков варьирует в широких пределах. Ферменты, катализирующие регуляторные реакции метаболических путей, как правило, подвергаются быстрому расщеплению, поэтому скорость обновления этих молекул достаточно высока. Физиологическое состояние организма также влияет на продолжительность жизни белков. Кроме того, существует мощная система защиты, обеспечивающая быстрое расщепление дефектных белков. Некоторые белки расщепляются лизосомными ферментами. В процессе аутофагии содержимое клетки, включая органеллы, окружается мембраной, сливается с лизосомой другой клетки и подвергается действию лизосомных ферментов.В результате гидролиза образующиеся мономеры поступают в цитоплазму для повторного использования. Для других белков показано расщепление в цитоплазме протеазами. Так, подлежащие разрушению белки первоначально отмечаются клеткой путём присоединения белка под названием убиквитин. Этот небольшой белок, состоящий из 76 аминокислотных остатков, обнаружен у многих организмов.
111. Понятие о клеточной дифференцировке. Изменение белкового состава клеток при дифференцировке (на примере белкового состава полипептидных цепей гемоглобина).
Часть пролиферирующих клеток созревает и дифференцируется последовательно в клетки нескольких морфологических типов. Дифференцировка клеток определенного типа сводится к экспрессии в них комплекса генов, специфичных для данной клеточной линии. Экспрессия этих генов в свою очередь контролируется регуляторными районами гена - промоторами и энхансерами. С промотора начинается транскрипция гена, для чего помимо РНК-полимеразы II требуются и активирующие факторы. Энхансеры - регуляторные районы ДНК, расположенные на некотором расстоянии от контролируемых ими генов, но в том же локусе хромосомы. Активация энхансеров и регуляторных участков промотора ведет к резкому увеличению активности гена, т.е. к усилению скорости его транскрипции. Активация же промоторов и энхансеров происходит при их специфическом взаимодействии с тканеспецифическими ядерными транскрипционными факторами (ТФ), набор и специфичность которых определяют направление и уровень дифференцировки данной клеточной линии. Для того, чтобы промоторы и энхансеры тканеспецифических генов могли взаимодействовать с ТФ, они должны быть "открытыми", т.е. не блокированными белками хроматина, который "закрывает" энхансеры и гены, неактивные в клетках данного типа. Таким образом, дифференцировка клеточной линии осуществляется путем взаимодействия набора тканеспецифических ТФ с энхансерами ипромоторами тканеспецифических генов. Это взаимодействие приводит к экспрессии дифференцировочных генов, определяющих специфичность данной клеточной линии. Как образуется набор специфичных для данной ткани ТФ и чем контролируется конфигурация хроматина, "разрешающая" взаимодействия ТФ с энхансерами и промоторами, а РНК-полимеразы II с промоторами генов в разных клеточных типах, - это вопросы, находящиеся в процессе активного исследования.
Гемоглобины человека. В ходе эволюции из единичных генов-предшественников возникли семейства генов α- и β-глобинов, на хромосомах 16 и 11 соответственно. В процессе онтогенеза у людей образуются разные виды гемоглобинов, обеспечивающие наилучшую адаптацию к меняющимся условиям существования. НbЕ - эмбриональный, синтезируется у зародыша в первые месяцы развития, HbF - фетальный, обеспечивает дальнейшее внутриутробное развитие плода, а НbА и НЬA2 осуществляют транспорт кислорода в организме взрослого человека. Эти белки представляют собой тетрамеры, состоящие из полипептидных цепей двух видов: α и β в НbА (2α2β), α и ε в НbЕ (2α2ε), а у остальных гемоглобинов β-цепи заменены на γ-полипептиды в HbF (2α2γ) или на δ-цепи в HbА2 (2α2δ). Полиморфизм гемоглобинов в популяции людей очень велик. Наряду с генами, кодирующими изобелки и занимающими разные локусы на хромосоме, обнаружено большое число вариантов гемоглобина А, являющихся продуктами аллельных генов. Один из наиболее известных аллельных вариантов НЬА - HbS, образующийся в результате замены остатка глутамата в положении 6 β-цепи НbА на валин (β6 Глу→Вал). По аллелям НbА и HbS всех людей можно разделить на 3 генотипически различающиеся группы: АА, AS и SS. Распространённость аллеля S по земному шару неравномерна. Часто людей с этим аллелем можно встретить в малярийных районах Африки и Азии (до 35%). К настоящему времени описано свыше 300 вариантов НbА, на основании этого признака всех людей можно разделить на 600 генотипических групп по наиболее часто встречающимся аллелям.
112. Молекяулрные механизмы генетической изменчивости. Молекулярные мутации: типы, частота, значение
Классификация мутаций
| Тип мутаций | Характер мутационных изменений | Примеры последствий |
| Геномный | Изменение числа хромосом | Болезнь Дауна (появление дополнительной хромосомы 21) |
| Хромосомные | Общее число хромосом не меняется. Наблюдают перестройки хромосом, обычно видимые при микроскопическом исследовании. | Мышечная дистрофия Дюшенна (делеции Х-хромосомы) |
| Генные | Изменения затрагивают один кодон или небольшой отрезок гена и не обнаруживаются цитогенетически | Серповидно-клеточная анемия, вызванная заменой одного нуклеотида в гене β-цепи глобина |
Изменения в геноме могут быть разнообразны и затрагивать различные по протяжённости участки ДНК от хромосом и генов до отдельных нуклеотидов. Наиболее драматичны геномные и хромосомные мутации, часто наблюдаемые на уровне соматических клеток. Если они имеют место в половых клетках, то для организма это имеет чаще всего летальные последствия. Частота мутаций в половых клетках высока. Существуют данные, указывающие на то, что в 20% случаев при беременности у эмбрионов наблюдают нарушения структуры хромосом. В 90% случаев это приводит к ненормальному развитию плода и элиминированию зародышей в результате спонтанных абортов. Выкидыши, происходящие в течение первых нескольких недель беременности, связаны с серьёзными нарушениями хромосом. В 50% случаев отмечается трисомия по аутосомам, т.е. вместо пары хромосом наблюдаются три. Пример такой патологии - болезнь Дауна, при которой хромосома 21 присутствует в 3 экземплярах. Некоторые генные мутации закрепляются в популяции, становятся наследственными и определяют эволюционные процессы. С мутациями такого типа связано появление различных наследственных патологий, сопровождающихся прекращением синтеза белка, кодируемого повреждённым геном, либо синтезом изменённого белка.
Генные, или точечные, мутации бывают в основном 3 видов:
· замены, при которых одно азотистое основание в ДНК замещается на другое;
· вставки, обеспечивающие внедрение в молекулу ДНК одного или нескольких дополнительных нуклеотидов;
· делеции (или выпадения) одного или нескольких нуклеотидов, при которых происходит укорочение молекулы ДНК.
Основные виды генных мутаций
| Виды мутаций | Изменения в структуре ДНК | Изменения в структуре белка |
| ЗАМЕНА | ||
| Без изменения смысла кодона | Замена одного нуклеотида в кодоне | Белок не изменён |
| С изменением смысла кодона (миссенс-мутация) | Происходит замена одной аминокислоты на другую | |
| С образованием терминирующего кодона (нонсенс-мутация) | Синтез пептидной цепи прерывается, и образуется укороченный продукт | |
| ВСТАВКА | ||
| Без сдвига «рамки считывания» | Вставка фрагмента ДНК из 3 нуклеотидов или с числом нуклеотидов, кратным 3 | Происходит удлинение полипептидной цепи на одну или несколько аминокислот |
| Со сдвигом «рамки считывания» | Вставка одного или нескольких нуклеотидов, не кратных 3 | Синтезируется пептид со «случайной» последовательностью аминокислот, так как изменяется смысл всех кодонов, следующих за местом мутации |
| ДЕЛЕЦИЯ | ||
| Без сдвига «рамки считывания» | Выпадение фрагмента ДНК из 3 нуклеотидов или с числом нуклеотидов, кратным 3 | Происходит укорочение белка на одну или несколько аминокислбт |
| Со сдвигом «рамки считывания» | Выпадение одного или нескольких нуклеотидов, не кратных 3 | Синтезируется пептид со «случайной» последовательностью аминокислот, так как изменяется смысл всех кодонов, следующих за местом мутации |
Частота мутаций. Считается, что средняя частота возникновения мутаций в структурных локусах (областях локализации гена в хромосоме или в молекуле ДНК) человека колеблется в пределах от 10-5 до 10-6 на одну гамету за каждое поколение. Однако эта величина может значительно варьировать для разных генов (от 10-4 для генов с высокой скоростью мутаций до 10-11 для наиболее устойчивых участков генома). Столь существенные колебания в частоте возникновения мутаций обусловлены характером мутационного повреждения, механизмом возникновения мутации, протяжённостью кодирующей области мутантного гена, функциями белка, закодированного в этом гене. Так, для гена гемоглобина скорость замещения одного основания другим лежит в интервале μ = 2,5×10-9-5×10-9замен в гамете за одно поколение. Чтобы представить себе, что означают эти цифры, распространим эту скорость мутаций на весь геном человека - 3×109 пар оснований. Умножив размер генома на скорость μ, мы получим, что геном за одно поколение может получить от 7 до 15 мутаций, т.е. это значит, что каждая гамета содержит такое количество изменений в ДНК по сравнению с родительской ДНК. А поскольку у каждого шадивидуума клетки диплоидны и получаются при слиянии 2 гамет, то мутаций тоже в 2 раза больше. Спрашивается, каким же образом человечество справляется с такой мутационной нагрузкой? Отвечая на этот вопрос, следует помнить, что кодирующие части генов, изменения в которых наиболее опасны, занимают не более 10% генома. Ситуация облегчается ещё и тем, что далеко не каждая мутация в кодирующей области имеет фенотипическое проявление. Многие попадают в 3'-положение кодонов и, таким образом, являются "молчащими", так как благодаря вырожденности генетического кода они не приводят к аминокислотным заменам, другие оказываются в доменах, несущественных для функционирования белков. Потомству передаются мутации, происходящие в гаметах, а их процент совсем невелик.
113. Генетическая гетерогенность. Полиморфизм белков в популяции человека (варианты гемоглобина, гликозилтрансферазы, группоспецифических веществ и др).
Полиморфизм белков. Поскольку большинство нормальных клеток человека диплоидны, то они содержат две копии каждой хромосомы, одна из которых получена от отца, а вторая от матери. Эти две копии одной и той же хромосомы называют гомологичными. В ДНК каждой хромосомы содержится более тысячи генов. Соответствующие друг другу гены в гомологичных хромосомах называют аллелями. Аллели могут быть идентичными и содержат одинаковую последовательность нуклеотидов. В этом случае индивидуум, имеющий такие аллели, будет гомозиготен по данному признаку. Если аллели различаются по последовательности нуклеотидов в ДНК, то говорят о гетерозиготном наследовании гена. В этом случае индивидуум будет иметь 2 белковых продукта гена, различающихся по аминокислотной последовательности. У каждого человека существует только 2 разных аллеля одного гена, тогда как в популяции людей вариантов аллелей может быть огромное множество. Как уже говорилось ранее, изменчивость структуры ДНК, а следовательно разнообразие аллелей, обусловлено мутационным процессом и рекомбинациями в гомологичных хромосомах половых клеток. Если в ходе мейоза рекомбинации сопровождаются обменом участками ДНК, меньшими по размеру, чем ген, то такой процесс может приводить к появлению новых, прежде не существовавших аллелей. А поскольку рекомбинации - более частые события, чем мутации в кодирующих участках гена, то разнообразие вариантов аллелей обусловлено главным образом ими. Существование в популяции 2 и большего числа аллелей одного гена называют "аллеломорфизм", или "полиморфизм", а белковые продукты, образующиеся в ходе экспрессии этих вариантов гена - "полиморфы". Разные аллели встречаются в популяции с разной частотой. К полиморфам относят только те варианты, распространённость которьж в популяции не меньше 1%. В процессе эволюции отдельные гены амплифицируют с образованием копий, а их структура и положение могут изменяться в результате мутаций и перемещений не только внутри хромосомы, но и между хромосомами. Со временем это приводит к появлению новых генов, кодирующих белки, родственные исходному, но отличающиеся от него определёнными свойствами и занимающие в хромосомах разные генные локусы (или места). К родственным белкам относят изобелки, представляющие собой варианты белков, выполняющие одну и ту же функцию и обнаруживаемые в пределах одного вида организмов. Так, в группе из 2000 генов человека, кодирующих факторы транскрипции и транскрипционные активаторы, идентифицировано 900, относящихся к семейству белков, имеющих "цинковые пальцы". Существует 46 генов фермента глицеральдегид-3-фосфатдегидрогеназы, осуществляющего единственную окислительную реакцию в метаболическом пути катаболизма глюкозы до пирувата. Выявлены семейства родственных белков, возникшие в ходе эволюции из одного "предкового" гена, или гена-предшественника. Такие семейства составляют:
- гены миоглобина и протомеров гемоглобинов;
- группа протеолитических ферментов: трипсин, химотрипсин, эластаза, гшазмин, тромбин и некоторые другие белки и ферменты.
Группы крови. Другой важный пример полиморфизма белков, связанный с проблемой переливания крови, - существование в популяции людей 3 аллельных вариантов гена фермента гликозилтрансферазы (А, В и 0). Этот фермент принимает участие в синтезе олигосахарида, локализованного на наружной поверхности плазматической мембраны и определяющего антигенные свойства эритроцитов. Варианты фермента А и В имеют разную субстратную специфичность: вариант А катализирует присоединение к олигосахариду N-ацетилгалактозамина, а вариант В - галактозы. Вариант О кодирует белок, лишённый ферментативной активности. В результате структура олигосахаридов, расположенных на поверхности эритроцитов, будет разной. Антитела к антигенам А и В обычно имеются в сыворотке крови людей, на поверхности эритроцитов которых отсутствует соответшвующий антиген, т.е. индивидуумы с антигенами А на поверхности эритроцитов продуцируют в сыворотку крови антитела к В-антигенам (анти-В), а люди с В-антигенами ~ антитела к антигенам А (анти-А). В сыворотке крови анти-А и анти-В обычно присутствуют в высоких титрах и при появлении соответствующих антигенов способны активировать ферменты системы комплемента. При переливании крови руководствуются правилом, согласно которому кровь донора и реципиента не должна содержать антигены и антитела, реагирующие между собой: например, реципиенту, имеющему в сыворотке крови анти-А, нельзя переливать кровь от донора, содержащего на эритроцитах антигены А. При нарушении этого правила происходит реакция антиген-антитело. Это вызывает агглютинацию (склеивание) эритроцитов и их разрушение ферментами комплемента и фагоцитами. У индивидуумовгетерозигот, имеющих группу крови АВ (IV), на эритроцитах присутствуют А- и В-антигены, функционируют 2 варианта глйкозилтрансферазы (А и В), а следовательно антитела не образуются. Этих людей можно рассматривать как "универсальных" реципиентов, которым безопасно вводить эритроциты от доноров, имеющих любые группы крови. Однако люди с группой крови IV не могут безопасно получать сыворотку крови от этих доноров, так как она содержит антитела к А- и/или В-антигенам. В то же время индивидуумы, имеющие 0 (I) группу крови, - гомозиготы по неактивному варианту гликозилтранеферазы 0, и поверхность их эритроцитов лишена антигенов. Такие люди являются "универсальными" донорами эритроцитарной массы, так как их эритроциты можно вводить людям с группами крови А, В, 0 или АВ. В то же время сыворотка крови этих доноров содержит антитела к А- и В-антигенам и может использоваться только для пациентов 0 (I) группы крови.
Белки главного комплекса гистосовместимости и трансплантационная несовместимость. При формировании клеточного иммунного ответа узнавание Т-лимфоцитами чужеродного антигена происходит только если он расположен рядом с гликопротеинами, присутствующими на собственной клеточной мембране. Эти гликопротеины называют белками главного комплекса гистосовместимости, или МНС-белками. Существуют 2 класса этих белков: молекулы класса I и П. МНС-белки класса I обнаружены практически во всех содержащих ядро клетках, включая Т-киллеры, тогда как МНС-белки класса II найдены главным образом в клетках, участвующих в иммунном ответе, в антиген-представляющих В-клетках и Т-хелперах, но не в Т-киллерах и макрофагах. Строение МНС-белков кодирует семейство генов, расположенных на коротком плече хромосомы 6 и занимающих участок ДНК длиной более 6000 пар нуклеотидов. Это семейство состоит из серии тесно сцепленных генов, ответственных за синтез МНС-белков и некоторых компонентов системы комплемента. Гены комплекса отличаются чрезвычайно высоким полиморфизмом. Число разных аллелей достигает нескольких миллионов. Белки МНС-системы считают самой полиморфной системой человека. Вариабельность МНС-белков обеспечивает трансплантационную несовместимость. Клетки трансплантата имеют набор этих белков, отличный от МНС-белков реципиента (во всех случаях, кроме генетически идентичных близнецов), и это приводит к развитию реакции клеточного иммунитета, в результате которой трансплантированная ткань отторгается. Исследования показали, что полиморфизм различных белков настолько велик, что можно говорить о биохимической индивидуальности и уникальности каждого человека.
114. Биохимические основы возникновения и проявления наследственных болезней (разнообразие, распространение).
Каждый генетический локус характеризуется определённым уровнем изменчивости, т.е. присутствием различных аллелей у разных индивидуумов. Аллели генов делят на 2 группы - нормальные, или аллели "дикого" типа, для которых функция гена не нарушена, и мутантные, приводящие к нарушению работы гена. "Плохой" аллель кодирует синтез белка, функция которого сильно нарушена и при гомозиготном наследовании фенотипически проявляется как наследственная болезнь. Наследственные болезни - следствие мутаций, произошедших в гаметах или зиготе. Такие мутации могут быть первичными, если возникли в гаметах или в процессе формирования зиготы, или вторичными, если мутантный ген возник раньше и был передан последующему поколению по наследству.
Первичные мутации, как правило, не сопровождаются возникновением болезни, так как происходят обычно в одной из хромосом, и индивидуум, получивший такую мутацию, становится гетерозиготным носителем повреждения в гене. Мутантный ген в гетерозиготном состоянии часто не проявляется как болезнь и существенно не снижает жизнеспособность организма. Это способствует его распространению в популяции. При вторичных мутациях, если каждый из родителей является носителем мутантного гена, будучи гетерозиготой, возможно рождение детейгомозигот по дефектному аллелю,, В таком случае развивается наследственная болезнь, часто сопровождаемая очень тяжёлым течением. Согласно данным Всемирной организации здравоохранения, около 2,4% всех новорождённых на земном шаре страдают теми или иными наследственными нарушениями. Около 40% ранней младенческой смертности и инвалидности с детства обусловлены наследственной патологией.
К настоящему времени на хромосомах человека выявлено около 800 генов, мутации в которых приводят к развитию различных наследственных болезней. Количество моногенных заболеваний (т.е. вызванных мутациями в определённом гене) ещё больше и равно примерно 950 в результате существования так называемых "аллельных серий", т.е. групп болезней, клинически сильно отличающихся друг от друга, но обусловленных мутациями в одном и том же гене. Например, мутации в гене рецептора с тирозинкиназной активностью ret могут вызывать 4 различных наследственных заболевания. Более половины генов, в которых найдены мутации, вызывающие наследственные, заболевания охарактеризованы методами молекулярного анализа. Наибольшую по размеру группу составляют ферменты (31% от общего числа). За этой группой следуют белки, модулирующие функции белков и участвующие в правильном сворачивании полипептидных цепей (14%). На каждой хромосоме в среднем идентифицировано около 30 структурных генов, мутации в которых вызывают наследственные болезни. Однако распределены эти гены по хромосомам неравномерно. Так, например, на хромосоме 2 их в 3 раза меньше, чем на хромосоме 1. Наибольшее число мутантных генов (более 100) установлено на Х-хромосоме. Хорошо изученными наследственными заболеваниями, связанными с нарушением синтеза α- или β-цепей НЬ, являются талассемии. Синтез α- и β-цепей в норме регулируется таким образом, что все молекулы протомеров используются на синтез тетрамера α2β2 Талассемии возникают как результат мутаций, включающих замены или делеции одного или нескольких нук-леотидов, а иногда и целого гена, кодирующего структуру одного из протомеров. Эти болезни классифицируют по 4 типам: так, в случае, если одна из цепей не синтезируется, то их обозначают как α0- или β0-талассемии, а если синтез какой-либо из цепей снижен, то α+- или β+-талассемии.
α- Талассемии возникают при нарушении синтеза α-цепей. В геноме каждого индивидуума существует 4 копии гена α-глобина (по 2 копии на каждой хромосоме), поэтому встречаются несколько видов недостаточности ос-цепей. Если дефектна одна из 4 копий, то фенотипически это не проявляется, и такого человека рассматривают как "молчащего носителя" талассемии. При дефекте в 2 копиях гена у носителя мутации обнаруживают слабовыраженные признаки болезни, а при дефекте в 3 копиях развивается гемолитическая анемия. При полном отсутствии синтеза α-цепей (т.е. дефектны все 4 копии гена) наступает внутриутробная гибель плода, так как не образуются фетальные формы Нb, а тетрамеры γ4 обладают высоким сродством к кислороду и не способны функционировать как транспортные белки.
β- Талассемии развиваются в результате снижения синтеза β-цепей Нb, для которых на каждой хромосоме имеется по одному гену. Синтез НbА начинается после рождения ребёнка. При дефекте в одной из копий гена недостаточность Нb проявляется в слабой степени и не требует специального лечения. Однако при полном выключении синтеза β-цепей развивается тяжёлая форма анемии, и таким пациентам проводят либо периодическую трансфузию крови, либо пересадку костного мозга.
Со многими моногенными наследственными заболеваниями читатель познакомится практически во всех последующих разделах учебника. Здесь же хотелось бы только отметить, что наряду с болезнями, наследственная природа которых ярко выражена, существует множество болезней, характеризующихся семейной предрасположенностью. Это такие широко распространённые заболевания, как сахарный диабет, подагра, атеросклероз, шизофрения и ряд других. В отличие от моногенных болезней, эти заболевания относят к мультифакторным. Поэтому исследования, направленные на выявление белков, аллельные формы которых ответственны за предрасположенность к заболеванию, являются задачами настоящего и будущего времени.
115. Основные системы межклеточной коммуникации: эндокринная, паракринная, аутокринная регуляция.
По расстоянию от клетки—продуцента гормона до клетки-мишени различают эндокринный, паракринный и аутокринный варианты регуляции.
• Эндокринная, или дистантная, регуляция. Секреция гормона происходит в жидкие среды организма. Клетки-мишени могут отстоять от эндокринной клетки сколь угодно далеко. Пример: секреторные клетки эндокринных желёз, гормоны из которых поступают в систему общего кровотока.
• Паракринная регуляция. Продуцент биологически активного вещества и клетка-мишень расположены рядом. Молекулы гормона достигают мишени путём диффузии в межклеточном веществе. Например, в париетальных клетках желёз желудка секрецию Н+ стимулируют гастрин и гистамин, а подавляют соматостатин и Пг, секретируемые рядом расположенными клетками.
• Аутокринная регуляция. При аутокринной регуляции клетка—продуцент гормона имеет рецепторы к этому же гормону (другими словами, клетка—продуцент гормона в то же время является его мишенью). Примеры: эндотелины, вырабатываемые клетками эндотелия и воздействующие на эти же эндотелиальные клетки; Т-лимфоциты, секретирующие интерлейкины, имеющие мишенями разные клетки, в том числе и Т-лимфоциты.
116. Роль гормонов в системе регуляции метаболизма. Клетки-мишени и клеточные рецепторы гормонов
Роль гормонов в регуляции обмена веществ и функций. Интегрирующими регуляторами, связывающими различные регуляторные механизмы и метаболизм в разных органах, являются гормоны. Они функционируют как химические посредники, переносящие сигналы, возникающие в различных органах и ЦНС. Ответная реакция клетки на действие гормона очень разнообразна и определяется как химическим строением гормона, так и типом клетки, на которую направлено действие гормона. В крови гормоны присутствуют в очень низкой концентрации. Для того чтобы передавать сигналы в клетки, гормоны должны распознаваться и связываться особыми белками клетки - рецепторами, обладающими высокой специфичностью. Физиологический эффект гормона определяется разными факторами, например концентрацией гормона (которая определяется скоростью инактивации в результате распада гормонов, протекающего в основном в печени, и скоростью выведения гормонов и его метаболитов из организма), его сродством к белкам-переносчикам (стероидные и тиреоидные гормоны транспортируются по кровеносному руслу В комплексе с белками), количеством и типом рецепторов на поверхности клеток-мишеней. Синтез и секреция гормонов стимулируются внешними и внутренними сигналами, поступающими в ЦНС.Эти сигналы по нейронам поступают в гипоталамус, где стимулируют синтез пептидных рилизинг-гормонов (от англ, release -освобождать) - либеринов и статинов, которые, соответственно, стимулируют или ингибируют синтез и секрецию гормонов передней доли гипофиза. Гормоны передней доли гипофиза, называемые тройными гормонами, стимулируют образование и секрецию гормонов периферических эндокринных желёз, которые поступают в общий кровоток и взаимодействуют с клетками-мишенями. Поддержание уровня гормонов в организме обеспечивает механизм отрицательной обратной связи. Изменение концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов, действуя либо на эндокринные железы, либо на гипоталамус. Синтез и секреция тропных гормонов подавляется гормонами эндокринных периферических желёз. Такие петли обратной связи действуют в системах регуляции гормонов надпочечников, щитовидной железы, половых желёз. Не все эндокринные железы регулируются подобным образом. Гормоны задней доли гипофиза (вазопрессин и окситоцин) синтезируются в гипоталамусе в виде предшественников и хранятся в гранулах терминальных аксонов нейрогипофиза. Секреция гормонов поджелудочной железы (инсулина и глюкагона) напрямую зависит от концентрации глюкозы в крови. В регуляции межклеточных взаимодействий участвуют также низкомолекулярные белковые соединения - цитокины. Влияние цитокинов на различные функции клеток обусловлено их взаимодействием с мембранными рецепторами. Через образование внутриклеточных посредников сигналы передаются в ядро, где происходят активация определённых генов и индукция синтеза белков. Все цитокины объединяются следующими общими свойствами:
- синтезируются в процессе иммунного ответа организма, служат медиаторами иммунной и воспалительной реакций и обладают в основном аутокринной, в некоторых случаях паракринной и эндокринной активностью;
- действуют как факторы роста и факторы дифференцировки клеток (при этом вызывают преимущественно медленные клеточные реакции, требующие синтеза новых белков);
- обладают плейотропной (полифункциональной) активностью.
Биологическое действие гормонов проявляется через их взаимодействие с рецепторами клеток-мишеней. Для проявления биологической активности связывание гормона с рецептором должно приводить к образованию химического сигнала внутри клетки, который вызывает специфический биологический ответ, например изменение скорости синтеза ферментов и других белков или изменение их активности. Мишенью для гормона могут служить клетки одной или нескольких тканей. Воздействуя на клетку-мишень, гормон вызывает специфическую ответную реакцию. Например, щитовидная железа - специфическая мишень для тиреотропина, под действием которого увеличивается количество ацинарных клеток щитовидной железы, повышается скорость биосинтеза тиреоидных гормонов. Глюкагон, воздействуя на адипоциты, активирует липолиз, в печени стимулирует мобилизацию гликогена и глюконеогенез. Характерный признак клетки-мишени - способность воспринимать информацию, закодированную в химической структуре гормона.
Рецепторы гормонов. Начальный этап в действии гормона на клетку-мишень - взаимодействие гормона с рецептором клетки. Концентрация гормонов во внеклеточной жидкости очень низка и обычно колеблется в пределах 10-6-10-11 ммоль/л. Клетки-мишени отличают соответствующий гормон от множества других молекул и гормонов благодаря наличию на клетке-мишени соответствующего рецептора со специфическим центром связывания с гормоном.
Общая характеристика рецепторов
Рецепторы пептидных гормонов и адреналина располагаются на поверхности клеточной мембраны. Рецепторы стероидных и тиреоидных гормонов находятся внутри клетки. Причём внутриклеточные рецепторы для одних гормонов, например глюкокортикоидов, локализованы в цитозоле, для других, таких как андрогены, эстрогены, тиреоидные гормоны, расположены в ядре клетки. Рецепторы по своей химической природе являются белками и, как правило, состоят из нескольких доменов. В структуре мембранных рецепторов можно выделить 3 функционально разных участка. Первый домен (домен узнавания) расположен в N-концевой части полипептидной цепи на внешней стороне клеточной мембраны; он содержит гликозилированные участки и обеспечивает узнавание и связывание гормона. Второй домен - трансмембранный. У рецепторов одного типа, сопряжённых с G-белками, он состоит из 7 плотно упакованных α-спиральных полипептидных последовательностей. У рецепторов другого типа трансмембранный домен включает только одну α-спирадизованную полипептидную цепь (например, обе β-субъединицы гетеротетрамерного рецептора инсулина α2β2). Третий (цитоплазматический) домен создаёт химический сигнал в клетке, который сопрягает узнавание и связывание гормона с определённым внутриклеточным ответом. Цитоплазматический участок рецептора таких гормонов, как инсулин, фактор роста эпидермиса и инсулиноподобный фактор роста-1 на внутренней стороне мембраны обладает тирозинки-назной активностью, а цитоплазматические участки рецепторов гормона роста, пролактина и цитокинов сами не проявляют тирозинкиназ-ную активность, а ассоциируются с другими цитоплазматическими протеинкиназами, которые их фосфорилируют и активируют.
Рецепторы стероидных и тиреоидных гормонов содержат 3 функциональные области. На С-концевом участке полипептидной цепи рецептора находится домен узнавания и связывания гормона. Центральная часть рецептора включает домен связывания ДНК. На N-концевом участке полипептидной цепи располагается домен, называемый вариабельной областью рецептора, отвечающий за связывание с другими белками, вместе с которыми участвует в регуляции транскрипции.
117. Механизмы передачи гормональных сигналов в клетки.
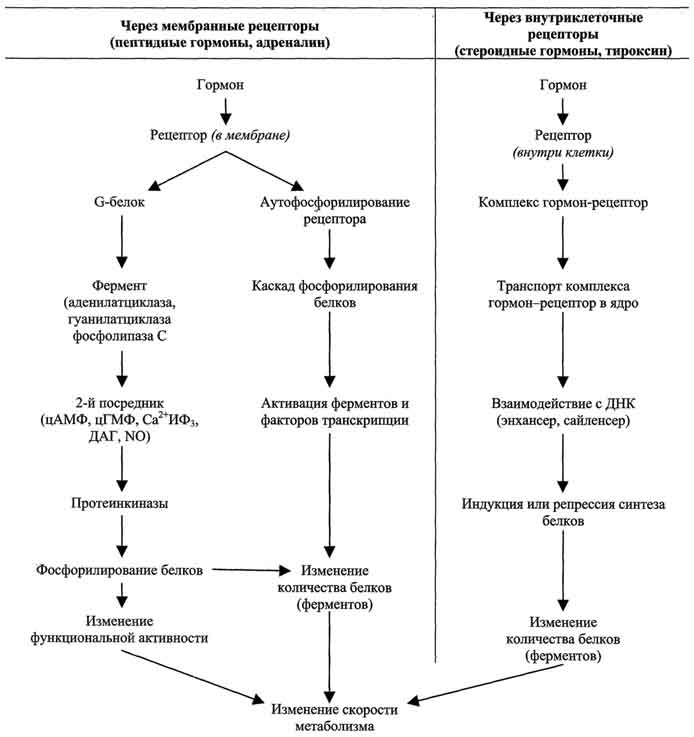
По механизму действия гормоны можно разделить на 2 группы. К первой группе относят гормоны, взаимодействующие с мембранными рецепторами (пептидные гормоны, адреналин, а также гормоны местного действия - цитокины, эйкозаноиды). Вторая группа включает гормоны, взаимодействующие с внутриклеточными рецепторами.Связывание гормона (первичного посредника) с рецептором приводит к изменению кон-формации рецептора. Это изменение улавливается другими макромолекулами, т.е. связывание гормона с рецептором приводит к сопряжению одних молекул с другими (трансдукция сигнала). Таким образом, генерируется сигнал, который регулирует клеточный ответ путём изменения активности или количества ферментов и других белков. В зависимости от способа передачи гормонального сигнала в клетках меняется скорость реакций метаболизма:
- в результате изменения активности ферментов;
- в результате изменения количества ферменто в
118. Классификация гормонов по химическому строению и биологическим функциям