КОМПЛЕКСОНОМЕТРИЯ
Формула ЭДТА (трилона Б)– Na2C10H14N2O8·2H2O.
1. В каком объеме раствора содержится m г ЭДТА, если молярная концентрация раствора равна с моль/л?
Решение.
 ,
,
где с – молярная концентрация раствора ЭДТА, моль/л; n – количество вещества ЭДТА в растворе, моль; m – физическая масса ЭДТА в растворе, г; 1000 мл/л – пересчетный коэффициент; V – искомый объем раствора, мл; M – молярная масса ЭДТА, г/моль.
2. На титрование V 1 мл раствора вещества В израсходовано V 2 мл с М раствора ЭДТА. Найти массово-объемную концентрацию вещества В (г/л) в исследуемом растворе.
Решение.
 ,
,
где с (B) – молярная концентрация вещества В, моль/л; с – молярная концентрация раствора титранта, моль/л; V 1 – объем исходного раствора вещества В, мл; V 2 – объем раствора титранта, мл.
 ,
,
где ρ – искомая массово-объемная концентрацию вещества В в исследуемом растворе, г/л; M – молярная масса вещества В, г/моль.
3. К раствору вещества В добавили аммиачный буферный раствор и V 1 мл с 1 М раствора ЭДТА. Избыток ЭДТА оттитровали V 2 мл с 2 М раствором второго титранта. Найти массу вещества В в исследуемом растворе.
Решение.
 ,
,
где n – количество вещества В в растворе, моль; с 1– молярная концентрация раствора ЭДТА, моль/л; V 1 – объем раствора ЭДТА, мл; с 2– молярная концентрация раствора второго титранта, моль/л; V 2 – объем раствора второго титранта, мл;1000 мл/л – пересчетный коэффициент.

где m – искомая физическая масса вещества В в исследуемом растворе, г; M – молярная масса вещества В, г/моль.
4. Какую массу x -гидрата вещества В, содержащего ω% индифферентных примесей, следует взять для анализа, чтобы на титрование ее потребовалось V мл с М ЭДТА?
Решение.
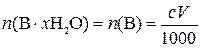 ,
,
где  – количество вещества чистого x -гидрата В, моль; n (В) – количество вещества В, моль; с – молярная концентрация раствора ЭДТА, моль/л; V – объем раствора ЭДТА, мл; 1000 мл/л – пересчетный коэффициент.
– количество вещества чистого x -гидрата В, моль; n (В) – количество вещества В, моль; с – молярная концентрация раствора ЭДТА, моль/л; V – объем раствора ЭДТА, мл; 1000 мл/л – пересчетный коэффициент.
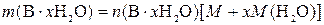 ,
,
где  – физическая масса чистого x -гидрата В, г; M – молярная масса вещества В, г/моль; x – число молекул воды в формульной единице гидрата; M (H2O) – молярная масса воды, г/моль.
– физическая масса чистого x -гидрата В, г; M – молярная масса вещества В, г/моль; x – число молекул воды в формульной единице гидрата; M (H2O) – молярная масса воды, г/моль.
 ,
,
где m – искомая физическая масса x -гидрата В, содержащего индифферентные примеси, г; ω – массовая доля индифферентных примесей, %; 100% – пересчетный коэффициент.
5. Какая масса А-ионов содержится в пробе, если после прибавления V 1 мл с 1 М раствора первого титранта избыток его был оттитрован V 2 мл с 2 М раствором ЭДТА?
Решение.
 ,
,
где n – количество вещества А-ионов в пробе, моль; с 1– молярная концентрация раствора ЭДТА, моль/л; V 1 – объем раствора ЭДТА, мл; с 2– молярная концентрация раствора второго титранта, моль/л; V 2 – объем раствора второго титранта, мл;1000 мл/л – пересчетный коэффициент.

где m – искомая физическая масса А-ионов в пробе, г; M – молярная масса А-ионов, г/моль.
6. Растворением навески В· x H2O массой m г приготовили V мл раствора, к V 0 мл которого прибавили V 1 мл с 1 М раствора ЭДТА. На титрование избытка ЭДТА израсходовали V 2 мл с 2 М раствора второго титранта. Вычислить массовую долю (%) вещества В в образце, определить число молекул воды x в формульной единице кристаллогидрата.
Решение.
 ,
,
где n (В) – количество вещества В в образце, моль; с 1– молярная концентрация раствора ЭДТА, моль/л; V 1 – объем раствора ЭДТА, мл; с 2– молярная концентрация раствора второго титранта, моль/л; V 2 – объем раствора второго титранта, мл; V – объем исходного раствора образца, мл;1000 мл/л – пересчетный коэффициент; V 0 – объем оттитрованного исходного раствора образца, мл.

где  – физическая масса вещества В в образце, г; M – молярная масса вещества В, г/моль.
– физическая масса вещества В в образце, г; M – молярная масса вещества В, г/моль.
 ,
,
где ω – искомая массовая доля вещества В в образце, %; m – физическая масса навески, г.
 ,
,
где  – молярная масса В· x H2O, г/моль; M (H2O) – молярная масса воды, г/моль; x – искомое число молекул воды в формульной единице кристаллогидрата.
– молярная масса В· x H2O, г/моль; M (H2O) – молярная масса воды, г/моль; x – искомое число молекул воды в формульной единице кристаллогидрата.
7. Из навески карбонатной породы, содержащей соли двух металлов, массой m г получили V мл раствора. На титрование V 0 мл этого раствора пошло V 1 мл с 1 М раствора трилона Б. На титрование  мл того же раствора после отделения первого металла расходуется V 2 мл с 2 н. раствора трилона Б. Найти массовые доли оксидов обоих металлов в карбонатной породе.
мл того же раствора после отделения первого металла расходуется V 2 мл с 2 н. раствора трилона Б. Найти массовые доли оксидов обоих металлов в карбонатной породе.
Решение.
 ,
,
где n 2 – количество вещества оксида второго металла в навеске карбонатной породы, моль; с ,2– молярная концентрация раствора трилона Б во втором титровании, моль/л; V 2 – объем раствора трилона Б во втором титровании, мл; V – объем раствора навески, мл; 1000 мл/л – пересчетный коэффициент;  – объем раствора навески после отделения первого металла во втором титровании, мл.
– объем раствора навески после отделения первого металла во втором титровании, мл.
 ,
,
где n 1 – количество вещества оксида первого металла в навеске карбонатной породы, моль; с ,1– молярная концентрация раствора трилона Б в первом титровании, моль/л; V 1 – объем раствора трилона Б в первом титровании, мл; V 0 – объем раствора навески в первом титровании, мл.

где m 1 и m 2 – физические массы оксидов первого и второго металлов соответственно в навеске, г; M 1 и M 2– молярные массы оксидов первого и второго металлов соответственно, г/моль.
 ,
,
где ω1 и ω2 – искомые массовые доли оксидов первого и второго металлов соответственно в карбонатной породе, %; m – физическая масса навески карбонатной породы, г.
8. На титрование пробы (V мл) анализируемого раствора, содержащего соли двух металлов, затрачено V 1 мл с титром T г/мл. После полного осаждения катионов первого металла из такой же пробы раствора (V мл) избытком раствора осадителя и отфильтровывания осадка фильтрат оттитровали V 2 мл такого же раствора ЭДТА. Написать уравнения всех проведенных при анализе реакций. Найти массу каждой соли (г) в пробе анализируемого раствора.
Решение.
 ,
,
где с – молярная концентрация раствора ЭДТА, ммоль/л; T – титр раствора ЭДТА, г/мл; M – молярная масса ЭДТА, г/моль.
 ,
,
где m 1 – искомая физическая масса соли первого металла в пробе, моль; V 1 – объем раствора ЭДТА в первом титровании, мл; V 2 – объем раствора ЭДТА во втором титровании, мл; M 1– молярная масса соли первого металла, г/моль.
 ,
,
где m 1 – искомая физическая масса соли второго металла в пробе, моль; M 2– молярная масса соли второго металла, г/моль.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ
1. Рассчитать молярные массы эквивалентов вещества В в а) кислой; б) нейтральной; в) щелочной среде.
Решение.
Ионно-электронные уравнения полуреакций:
а) MnO 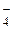 + 8 H+ + 5 e – = Mn2+ + 4 H2O;
+ 8 H+ + 5 e – = Mn2+ + 4 H2O;
б) MnO 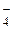 + 2 H2O + 3 e – = MnO2↓ + 4 OH–;
+ 2 H2O + 3 e – = MnO2↓ + 4 OH–;
в) MnO 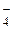 + e – = MnO
+ e – = MnO  .
.
 ,
,
где  – искомая молярная масса эквивалентов вещества В, г/моль; f эк – фактор эквивалентности вещества В;
– искомая молярная масса эквивалентов вещества В, г/моль; f эк – фактор эквивалентности вещества В;  – молярная масса вещества В, г/моль.
– молярная масса вещества В, г/моль.
2. m г x -гидрата вещества В растворили в мерной колбе на V мл. На титрование V 1 мл этого раствора расходуется V 2 мл раствора титранта. Найти: а) молярную концентрацию эквивалентов раствора титранта; б) титр раствора титранта; в) титр раствора титранта по другому веществу.
Решение.
Ионно-электронные уравнения полуреакций:
MnO 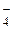 + 8 H+ + 5 e – = Mn2+ + 4 H2O; 2 CO2 + 2 H+ + 2 e – = Н2С2O4;
+ 8 H+ + 5 e – = Mn2+ + 4 H2O; 2 CO2 + 2 H+ + 2 e – = Н2С2O4;
Fe3+ + e – = Fe2+.
а)  ,
,
где с эк,1 – молярная концентрация эквивалентов раствора вещества В, моль/л; 1000 мл/л – пересчетный коэффициент; m – физическая масса x -гидрата вещества В, г; V – объем исходного раствора вещества В, мл; M 1 – молярная масса вещества В, г/моль; M (H2O) – молярная масса воды, г/моль; x –число молекул воды в формульной единице кристаллогидрата;  – фактор эквивалентности вещества В.
– фактор эквивалентности вещества В.
 ,
,
где с эк,2 – искомая молярная концентрация эквивалентов вещества В, моль/л; V 1 – объем исходного раствора x -гидрата вещества В, пошедший на титрование, мл; V 2 – объем раствора титранта, пошедший на титрование, мл.
б) 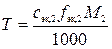 ,
,
где Т – искомый титр раствора титранта, г/мл; f эк,2 – фактор эквивалентности титранта; M 2– молярная масса титранта, г/моль.
в)  ,
,
где  – искомый титр раствора титранта по другому веществу, г/мл; f эк,3 – фактор эквивалентности другого вещества; M 3– молярная масса другого вещества, г/моль.
– искомый титр раствора титранта по другому веществу, г/мл; f эк,3 – фактор эквивалентности другого вещества; M 3– молярная масса другого вещества, г/моль.
3. Какую навеску вещества В требуется взять, чтобы на титрование ее было затрачено V мл с эк н. раствора титранта?
Решение.
Ионно-электронное уравнение полуреакции: 2 CO2 + 2 e – =  .
.
 ,
,
где m – искомая физическая масса вещества В, г; с эк – молярная концентрация эквивалентов раствора титранта, моль/л; V – объем раствора титранта, мл; M – молярная масса вещества В, г/моль;  – фактор эквивалентности вещества В;1000 мл/л – пересчетный коэффициент.
– фактор эквивалентности вещества В;1000 мл/л – пересчетный коэффициент.
4. m г раствора вещества В разбавили водой в мерной колбе на V мл. На титрование V 1 мл этого раствора расходуется V 2 мл с эк н. раствора титранта. Какова массовая доля (%) вещества В в исходном растворе?
Решение.
Ионно-электронное уравнение полуреакции: O2 + 2 H+ + 2 e – = H2O2.
 ,
,
где m (В) – физическая масса вещества В в исходном растворе, г; с эк – молярная концентрация эквивалентов раствора титранта, моль/л; V 2 – объем раствора титранта, мл; V – объем разбавленного исходного раствора, мл; M – молярная масса вещества В, г/моль; f эк – фактор эквивалентности вещества В;1000 мл/л – пересчетный коэффициент; V 1 – объем разбавленного исходного раствора, пошедший на титрование, мл.
 ,
,
где ω – искомая массовая доля вещества В в исходном растворе, %; m – физическая масса исходного раствора, г.
5. Навеска m г руды, содержащей оксид ЭO z, обработана избытком смеси растворов веществ В и C. Раствора вещества В было взято V 1 мл, и на титрование его избытка израсходовано V 2 мл с эк н. раствора титранта. Найти массовую долю (%) элемента Э в руде, если известно, что на титрование V 3 мл такого же раствора вещества В расходуется V 4 мл раствора такого же раствора титранта.
Решение.
Ионно-электронное уравнение полуреакции:
MnO2 + 4 H+ + 2 e – = Mn2+ + 2 H2O.
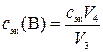 ,
,
где с эк(В) – молярная концентрация эквивалентов раствора вещества В, моль/л; V 4 – объем раствора титранта, пошедший на титрование V 3 мл раствора вещества В, мл.
 ,
,
где n – количество вещества оксида ЭO z, моль; V 1 – объем раствора вещества В, взятый для обработки навески руды, мл; с эк – молярная концентрация эквивалентов раствора титранта, моль/л; V 2 – объем раствора титранта, пошедший на титрование избытка раствора вещества В, мл; f эк – фактор эквивалентности оксида ЭO z; 1000 мл/л – пересчетный коэффициент.

где m (Э) – физическая масса элемента Э в навеске руды, г; M – молярная масса элемента Э, г/моль.
 ,
,
где ω – искомая массовая доля элемента Э в руде, %; m – физическая масса навески руды, г.
6. Вычислить окислительно-восстановительный потенциал системы ОФ, H+/ВФ при [ОФ] = [ВФ] и концентрации ионов водорода, равной [H+] моль/л.
Решение.

Согласно уравнению Нернста при комнатной температуре для полуреакции, ионно-электронное уравнение которой
ОФ + a H+ + z e – = ВФ + b H2O,
где ОФ и ВФ – формулы окисленной и восстановленной форм соответственно; a, z и b – коэффициенты; справедливо следующее

где e – искомый окислительно-восстановительный потенциал системы ОФ, H+/ВФ, В; e 0 – стандартный окислительно-восстановительный потенциал системы ОФ, H+/ВФ, В; [ОФ], [ВФ] и [H+] – молярные концентрации соответствующих частиц в системе, моль/л.
7. К V 0 мл исходного раствора соли элемента Э прибавили V 1 мл с эк,1 н. раствора осадителя, затем отделили образовавшийся осадок другой соли элемента Э. На титрование оставшегося в избытке раствора осадителя было израсходовано V 2 мл с эк,2 н. раствора титранта. Сколько граммов элемента Э содержится в V мл исходного раствора?
Решение.
 ,
,
где n – количество вещества элемента Э в V 0 мл исходного раствора, моль; с эк,1 – молярная концентрация эквивалентов раствора осадителя, моль/л; V 1 – объем раствора осадителя, мл; с эк,2 – молярная концентрация эквивалентов раствора титранта, моль; V 2 – объем раствора титранта, мл; f эк – фактор эквивалентности соли элемента Э; 1000 мл/л – пересчетный коэффициент.

где 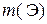 – искомая физическая масса элемента Э в V мл исходного раствора, г; M – молярная масса элемента Э, г/моль; V 0 – объем исходного раствора, обработанный осадителем, мл.
– искомая физическая масса элемента Э в V мл исходного раствора, г; M – молярная масса элемента Э, г/моль; V 0 – объем исходного раствора, обработанный осадителем, мл.
8. Сколько граммов x -гидрата вещества В следует взять для приготовления: 1) V 1 мл с эк н. раствора; 2) V 2 мл раствора с титром по другому веществу T г/мл?
Решение.
Ионно-электронные уравнения полуреакций:
2 SO3S2– + 2 e – =  ;I2 + 2 e – = 2 I–.
;I2 + 2 e – = 2 I–.
1)  ,
,
где m 1 – искомая физическая масса x -гидрата вещества В, необходимая для приготовления первого раствора, г; с эк – молярная концентрация эквивалентов первого раствора вещества В, моль/л; V 1 – объем первого раствора вещества В, мл; M 1 – молярная масса вещества В, г/моль; M (H2O) – молярная масса воды, г/моль; x – число молекул воды в формульной единице кристаллогидрата;  – фактор эквивалентности вещества В; 1000 мл/л – пересчетный коэффициент.
– фактор эквивалентности вещества В; 1000 мл/л – пересчетный коэффициент.
2) m 2 = TV 2,
где m 2 – физическая масса другого вещества, г; T – титр второго раствора по другому веществу, г/мл; V 2 – объем второго раствора вещества В, мл.
 ,
,
где n эк,2 – количество вещества эквивалентов вещества В во втором растворе, моль; M 2 – молярная масса другого вещества, г/моль; 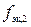 – фактор эквивалентности другого вещества.
– фактор эквивалентности другого вещества.
 ,
,
где m 2 – искомая физическая масса x - гидрата вещества В, необходимая для приготовления второго раствора.
9. Вычислить молярную концентрацию эквивалентов раствора титранта, если на титрование m г вещества В израсходовано V мл этого раствора.
Решение.
Ионно-электронное уравнение полуреакции:
2 H3AsO4 + 4 H+ + 4 e – = As2O3 + 5 H2O.
 ,
,
где с эк – искомая молярная концентрация эквивалентов раствора титранта, моль/л; 1000 мл/л – пересчетный коэффициент; M – молярная масса вещества В, г/моль; f эк – фактор эквивалентности вещества В; V – объем раствора титранта, мл.
10. К кислому раствору вещества В прибавили V 1 мл с эк,1 н. раствора первого титранта и выделившееся вещество оттитровали V 2 мл раствора второго титранта. Найти молярную концентрацию эквивалентов раствора второго титранта.
Решение.
 ,
,
где c эк,2 – искомая молярная концентрация эквивалентов раствора второго титранта, моль/л; c эк,1 – молярная концентрация эквивалентов раствора первого титранта, моль/л; V 1 – объем раствора первого титранта, мл; V 2 – объем раствора второго титранта, мл.
11. К раствору вещества В добавили избыток раствора первого титранта и выделившееся вещество оттитровали V мл с эк н. раствора второго титранта. Сколько граммов вещества В содержалось в растворе?
Решение.
Ионно-электронное уравнение полуреакции:
 + 14 H+ + 6 e – = 2 Cr3+ + 7 H2O.
+ 14 H+ + 6 e – = 2 Cr3+ + 7 H2O.
 ,
,
где m – искомая физическая масса вещества В, г; с эк –молярная концентрация эквивалентов раствора второго титранта, моль/л; V – объем раствора второго титранта, мл; M – молярная масса вещества В, г/моль; f эк – фактор эквивалентности вещества В; 1000 мл/л – пересчетный коэффициент.
12. К V 0 мл раствора вещества В прибавлено V 1 мл с эк,1 н. раствора первого титранта, избыток которого затем оттитровали V 2 мл с эк,2 н. раствора второго титранта. Найти массовую долю (%) вещества В в растворе, если плотность этого раствора равна ρ г/см3.
Решение.
Ионно-электронное уравнение полуреакции:
ClO  + 6 H+ + 6 e – = Cl– + 3 H2O.
+ 6 H+ + 6 e – = Cl– + 3 H2O.
 ,
,
где m – физическая масса вещества В в растворе, г; с эк,1 – молярная концентрация эквивалентов раствора первого титранта, моль/л; V 1 – объем раствора первого титранта, мл; с эк,2 – молярная концентрация эквивалентов раствора второго титранта, моль; V 2 – объем раствора второго титранта, мл; M – молярная масса вещества В, г/моль; f эк – фактор эквивалентности вещества В; 1000 мл/л – пересчетный коэффициент.
 ,
,
где ω – искомая массовая доля вещества В в растворе, %; V 0 – объем раствора вещества В, мл; ρ – плотность раствора вещества В, г/см3.
13. При сожжении навески m г вещества В элемент Э переведен в оксид ЭO z, который поглотили раствором вещества А и сразу оттитровали V 1 мл раствора первого титранта. Концентрация раствора первого титранта установлена с помощью с 2 М раствора второго титранта, причем V 2/ V 1 = y. Вычислить массовую долю (%) элемента Э в веществе В.
Решение.
Ионно-электронные уравнения полуреакций:
SO  + 4 H+ + 2 e – = SO2 + 2 H2O; 2 SO3S2– + 2 e – =
+ 4 H+ + 2 e – = SO2 + 2 H2O; 2 SO3S2– + 2 e – =  .
.
 ,
,
где n – количество вещества оксида ЭO z, моль; c 2 – молярная концентрация эквивалентов раствора второго титранта, моль/л; y – отношение объемов растворов второго и первого титрантов; V 1 – объем раствора первого титранта, мл;  – фактор эквивалентностиоксида ЭO z; 1000 мл/л – пересчетный коэффициент; f эк – фактор эквивалентности второго титранта.
– фактор эквивалентностиоксида ЭO z; 1000 мл/л – пересчетный коэффициент; f эк – фактор эквивалентности второго титранта.
 ,
,
где ω – искомая массовая доля элемента Э в веществе В, %; M – молярная масса элемента Э, г/моль; m – физическая масса вещества В, г.
14. Из сплава, содержащего элемент Э, последний перевели рядом операций в осадок В. Действием на этот осадок кислоты и некоторого вещества было выделено другое вещество, на титрование которого пошло V мл с М раствора титранта. Найти массу элемента Э в навеске сплава.
Решение.
Ионно-электронные уравнения полуреакций:
PbCrO4 + 8 H+ + 3 e – = Pb2+ + Cr3+ + 4 H2O; 2 SO3S2– + 2 e – =  .
.
 ,
,
где n – количество вещества осадка В, моль; c – молярная концентрация э раствора титранта, моль/л; V – объем раствора титранта, мл; f эк,1 – фактор эквивалентности осадка В; 1000 мл/л – пересчетный коэффициент; f эк,2 – фактор эквивалентности титранта.

где m – искомая физическая масса элемента Э в навеске сплава, г; M – молярная масса элемента Э, г/моль.
15. К смеси, содержащей избыток иодида и иодата калия, добавили V 1 мл раствора серной кислоты. Выделившийся дииод оттитровали V 2 мл с М раствора титранта. Вычислить титр серной кислоты по другому веществу.
Решение.
Ионно-электронные уравнения полуреакций:
I2 + 2 e – = 2 I–; 2 SO3S2– + 2 e – =  .
.
 ,
,
где n – количество вещества дииода, моль; c – молярная концентрация раствора титранта, моль/л; V – объем раствора титранта, мл; f эк,1 – фактор эквивалентности дииода; 1000 мл/л – пересчетный коэффициент; f эк,2 – фактор эквивалентности титранта.
Молекулярное уравнение реакции:
KIO3 + 3 H2SO4 + 5 KI = 3 I2 + 3 K2SO4 + 3 H2O.
Как видно из него, количества вещества дииода и серной кислоты совпадают, откуда
 ,
,
где  – искомый титр раствора серной кислоты по другому веществу, г/мл; M – молярная масса другого вещества, г/моль;
– искомый титр раствора серной кислоты по другому веществу, г/мл; M – молярная масса другого вещества, г/моль;  – фактор эквивалентности другого вещества; V 1 – объем раствора серной кислоты, мл; f эк – фактор эквивалентности серной кислоты.
– фактор эквивалентности другого вещества; V 1 – объем раствора серной кислоты, мл; f эк – фактор эквивалентности серной кислоты.
16. К раствору, содержащему m 0 г технического вещества В прилили V 1 мл с эк,1 н. раствора, избыток которого оттитровали V 2 см3 с эк,2 н. раствора второго титранта. Вычислите массовую долю (%) вещества В в образце.
Решение.
Ионно-электронное уравнение полуреакции:
ClO  + 6 H+ + 6 e – = Cl– + 3 H2O.
+ 6 H+ + 6 e – = Cl– + 3 H2O.
 ,
,
где m – физическая масса вещества В в образце, г; с эк,1 – молярная концентрация эквивалентов раствора первого титранта, моль/л; V 1 – объем раствора первого титранта, мл; с эк,2 – молярная концентрация эквивалентов раствора второго титранта, моль; V 2 – объем раствора второго титранта, см3; M – молярная масса вещества В, г/моль; f эк – фактор эквивалентности вещества В; 1000 мл/л – пересчетный коэффициент.
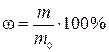 ,
,
где ω – искомая массовая доля вещества В в образце, %; m 0 – физическая масса образца, г.
17. К V мл раствора вещества В добавили V 1 мл раствора первого титранта с титром T 1 г/мл (избыток). Выпавший осадок отфильтровали, и избыток первого титранта в фильтрате оттитровали V 2 мл раствора второго титранта с титром T 2 г/мл. Определите титр исходного раствора и его молярную концентрацию.
Решение.
Ионно-электронные уравнения полуреакций:
MnO 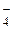 + 8 H+ + 5 e – = Mn2+ + 4 H2O; 2 CO2 + 2 H+ + 2 e – = Н2С2O4;
+ 8 H+ + 5 e – = Mn2+ + 4 H2O; 2 CO2 + 2 H+ + 2 e – = Н2С2O4;
 ,
,
где с эк,1 – молярная концентрация эквивалентов раствора первого титранта, ммоль/л; T 1 – титр раствора первого титранта, г/мл; f эк,1 – фактор эквивалентности первого титранта; M 1– молярная масса первого титранта, г/моль.
 ,
,
где с эк,2 – молярная концентрация эквивалентов раствора второго титранта, ммоль/л; T 2 – титр раствора второго титранта, г/мл; f эк,2 – фактор эквивалентности второго титранта; M 2– молярная масса второго титранта, г/моль.
 ,
,
где n – количество вещества В, моль; V 1 – объем раствора первого титранта, мл; V 2 – объем раствора второго титранта, мл; f эк – фактор эквивалентности вещества В.
 ,
,
где T – искомый титр исходного раствора, г/мл; M – молярная масса вещества В, г/моль; V – объем исходного раствора, мл.
 ,
,
где c – искомая молярная концентрация исходного раствора, моль/л; 1000 мл/л – пересчетный коэффициент.
ЭЛЕКТРОЛИЗ
1. Если годовой объем очищаемой воды равен V м3, а содержание в нем ионов M z + составляет ρ мг/дм3, то время, необходимое для выделения всего металла М электролизом при силе тока I А и выходе по току η %, составит ___ суток.
Решение.
 ,
,
где m – физическая масса металла М в годовом объеме очищаемой воды, г; V – годовой объем очищаемой воды, м3; ρ – концентрация ионов M x + в очищаемой воде, мг/дм3.
Согласно объединенному закону Фарадея
 , откуда
, откуда 
где h – выход по току, %; М – молярная масса металла М, г/моль; I – сила тока электролиза, А; t – время электролиза, с; 100% – пересчетный коэффициент; z – величина заряда катиона M z +; F = 96 500 Кл/моль – постоянная Фарадея.
 ,
,
где  – искомое время электролиза, сутки; 86400 с/сутки – пересчетный коэффициент.
– искомое время электролиза, сутки; 86400 с/сутки – пересчетный коэффициент.
2. Масса металла М, полученного электролизом раствора соли этого металла, в течение t мин при силе тока I А и выходе по току η %, равна ___ г.
Решение.
Согласно объединенному закону Фарадея
 ,
,
где m – искомая физическая масса металла М, полученного электролизом раствора, г; 60 с/мин – пересчетный коэффициент; h – выход по току, %; М – молярная масса металла М, г/моль; I – сила тока электролиза, А; t – время электролиза, с; 100% – пересчетный коэффициент; z – степень окисления металла M в соли; F = 96 500 Кл/моль – постоянная Фарадея.
Методы осаждения
3. Если годовой объем очищаемой воды равен V м3, а содержание в нем ионов M z + составляет ρ мг/дм3, то с учетом ω%-го избытка реагента, необходимого для полного осаждения, расход щелочи  составит __ кг в год.
составит __ кг в год.
Решение.
 ,
,
где n 1 – количество вещества металла М в годовом объеме очищаемой воды, моль; V – годовой объем очищаемой воды, м3; ρ – концентрация ионов M x + в очищаемой воде, мг/дм3; М 1 – молярная масса металла М, г/моль.
Краткое ионное уравнение реакции:
M z + + z OH– = M(OH) z ↓.
Уравнение диссоциации щелочи:
 .
.
Из них видно, что
n (OH–) = xn 2 = zn 1, откуда  ,
,
где n (OH–) – количество вещества ионов OH–, необходимое для осаждения, моль; n 2 – количество вещества щелочи  , необходимое для осаждения, моль; z – величина заряда катиона M z +; x – кислотность щелочи.
, необходимое для осаждения, моль; z – величина заряда катиона M z +; x – кислотность щелочи.
 ,
,
где m 2 – искомый расход щелочи, необходимый для полного осаждения, кг в год; М 2 – молярная масса щелочи, г/моль; ω – массовая доля избытка, %; 100% – пересчетный коэффициент; 1000 г/кг – пересчетный коэффициент.
pH
4. Если суточный объем очищаемой воды равен V м3, значение водородного показателя исходного раствора равно pH, то с учетом ω%-го содержания действующего вещества в пересчете на карбонат кальция в известняковой муке ее расход составит __ кг в сутки.
Решение.
n 1 = 1000 V ·10–pH = V ·103–pH,
где n 1 – количество вещества ионов H+ в суточном объеме очищаемой воды, моль; 1000 л/м3 – пересчетный коэффициент; V – суточный объем очищаемой воды, м3;pH – водородный показатель исходного раствора.
Краткое ионное уравнение реакции:
2 H+ + CaCO3 = Ca2+ + CO2↑ + H2O.
Из него видно, что
 ,
,
где n 2 – необходимое для нейтрализации количество вещества карбоната кальция, моль.
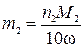 ,
,
где m 2 – искомый расход известняковой муки, кг в сутки; М 2 – молярная масса карбоната кальция, г/моль; 10 г/(кг·%) – пересчетный коэффициент; ω – массовая доля карбоната кальция в известняковой муке, %.
5. Сколько мл c эк н. раствора слабой одноосновной кислоты нужно добавить к V 2 мл c М раствора натриевой соли этой кислоты, чтобы получить раствор с водородным показателем pH?
Решение.
р Кa (CH3COOH) = 4,74.

где n c – количество вещества соли, ммоль; c – молярная концентрация раствора соли, моль/л; V 2 – объем раствора соли, мл.
 Согласно уравнению Гендерсона-Гассельбаха для кислотной буферной системы
Согласно уравнению Гендерсона-Гассельбаха для кислотной буферной системы
 откуда
откуда 
где pH – водородный показатель буферного раствора; р Кa – показатель константы диссоциации кислоты; n к – количество вещества кислоты, ммоль.
 ,
,
где V 1 – искомый объем раствора кислоты, мл; с эк – молярная концентрация эквивалентов раствора кислоты, моль/л.
6. Найти величину буферной емкости буферного раствора, если после добавления V 2 мл c эк н. раствора щелочи к V 1 мл этого раствора pH последнего увеличивается с pH1 до pH2.
Решение.
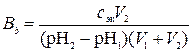 ,
,
где  – искомая буферная емкость по щелочи, моль/л; с эк – молярная концентрация эквивалентов раствора щелочи, моль/л; V 2 – объем раствора щелочи, мл; pH2 и pH1 – значения водородного показателя буферного раствора после и до добавления щелочи; V 1 – исходный объем буферного раствора, мл.
– искомая буферная емкость по щелочи, моль/л; с эк – молярная концентрация эквивалентов раствора щелочи, моль/л; V 2 – объем раствора щелочи, мл; pH2 и pH1 – значения водородного показателя буферного раствора после и до добавления щелочи; V 1 – исходный объем буферного раствора, мл.
7. Определить буферную емкость системы, если для изменения ее pH от pH1 до pH2 добавили к V 1 мл системы V 2 мл c эк н. сильной кислоты.
Решение.
 ,
,
где  – искомая буферная емкость по кислоте, моль/л; с эк – молярная концентрация эквивалентов раствора кислоты, моль/л; V 2 – объем раствора кислоты, мл; pH2 и pH1 – значения водородного показателя буферной системы после и до добавления кислоты; V 1 – исходный объем буферной системы, мл.
– искомая буферная емкость по кислоте, моль/л; с эк – молярная концентрация эквивалентов раствора кислоты, моль/л; V 2 – объем раствора кислоты, мл; pH2 и pH1 – значения водородного показателя буферной системы после и до добавления кислоты; V 1 – исходный объем буферной системы, мл.
8. Активная кислотность биологической жидкости равна [H+] моль/л. Найти pH жидкости.
Решение.
pH = –lg[H+],
где pH – искомое значение водородного показателя; [H+] – активная кислотность, моль/л.
9. Определить концентрации гидроксид-ионов в крови человека при t 1 °С и при t 2 °С, если при t 1 °С показатель ионного произведения воды равен р Кw, 1, а при t 2 °С – р Кw, 2. Водородный показатель крови при обеих температурах равен pH.
Решение.
 ,
,  ,
,
где  и
и  – искомые концентрации гидроксид-ионов, моль/л; pH – водородный показатель крови; р Кw, 1 и р Кw, 2 – показатели ионного произведения воды при температурах t 1 °С и t 2 °С соответственно.
– искомые концентрации гидроксид-ионов, моль/л; pH – водородный показатель крови; р Кw, 1 и р Кw, 2 – показатели ионного произведения воды при температурах t 1 °С и t 2 °С соответственно.
10. Определить pH раствора, содержащего n осн моль основания и n c моль соли, если показатель константы диссоциации основания равен р Кb.
Решение.
 Согласно уравнению Гендерсона-Гассельбаха для оснóвной буферной системы
Согласно уравнению Гендерсона-Гассельбаха для оснóвной буферной системы
 ,
,
где pOH – гидроксидный показатель раствора; р Кb – показатель константы диссоциации основания; n осн – количество вещества основания, моль; n c – количество вещества соли, моль.
При комнатной температуре
pH = 14 – pOH,
где pH – искомый водородный показатель раствора; 14 – показатель ионного произведения воды.
11. Каково соотношение между концентрацией гидрокарбонат-ионов и парциальным давлением диоксида углерода в крови, водородный показатель которой равен pH, если для такой буферной системы в крови человека суммарный показатель константы диссоциации равен р Кa?
Решение.
 Согласно уравнению Гендерсона-Гассельбаха для гидрокарбонатной кислот буферной системы
Согласно уравнению Гендерсона-Гассельбаха для гидрокарбонатной кислот буферной системы
 , откуда
, откуда  ,
,
где pH – водородный показатель крови; р Кa – суммарный показатель константы диссоциации;  – искомое соотношение между концентрацией гидрокарбонат-ионов и парциальным давлением диоксида углерода в крови.
– искомое соотношение между концентрацией гидрокарбонат-ионов и парциальным давлением диоксида углерода в крови.
Осмометрия
12. Смесь, содержащая m 1 г неэлектролитаВи m 2 г растворителя, плавится при t пл. р-ра 165 °С. Найти молекулярную массу неэлектролита В, если температура плавления растворителя t пл. р-ля °С, а ее криоскопическая постоянная равна K к К·кг/моль.
Решение.
D Т зам = t пл. р-ля – t пл. р-ра ,
где D Т зам – понижение температуры замерзания раствора относительно растворителя, К; t пл. р-ля – температура плавления растворителя, 0C; – t пл. р-ра – температура плавления раствора (смеси), 0C.
Согласно второму закону Рауля для растворов неэлектролитов
D Т зам = К к cm, откуда  ,
,
где К к – криоскопическая константа растворителя, К·кг/моль; cm – моляльная концентрация В, моль/кг.
По определению
 откуда
откуда 
где 1000 г/кг – пересчетный коэффициент; n – количество вещества В, моль; m 2 – физическая масса растворителя, г; m 1 – физическая масса В, г; M – молярная масса В, г/моль.
Mr = │M │,
где Mr – искомая молекулярная масса В, а.е.м.
12. При T К давление насыщенного пара над чистым растворителем равно p 0 кПа. Сколько граммов неэлектролитаВнадо растворить в m 1 г растворителя, чтобы понизить давление пара на Δ p Па?
Решение.
Согласно первому закону Рауля для растворов неэлектролитов
 ,
,
где χ– мольная доля В; Δ p –понижениедавления насыщенного пара над раствором относительно чистого растворителя; Па; 1000 Па/кПа – пересчетный коэффициент; p 0 – давление насыщенного пара над чистым растворителем, кПа.
По определению
 откуда
откуда 
где n 2 и n 1 – количества вещества В и растворителя, моль; m 1 – физическая масса растворителя, г; m 2 – искомаяфизическая масса неэлектролитаВ, г; M 1 и M 2 – молярные массы растворителя и В соответственно, г/моль.
13. При t °С давление насыщенного пара чистого растворителя составляет p 0 кПа. Найти при той же температуре давление насыщенного пара над ω %-ным раствором неэлектролитаВ.
Решение.
m 1 = ω, m 2= 100 – ω,
где m 1 и m 2 – физические массы В и растворителя в 100 г раствора, г; ω – массовая доля В, %.
 ,
,
где n 1 и n 2 – количества вещества В и растворителя в 100 г раствора, моль; M 1 и M 2 – молярные массы В и растворителя, г/моль.
По определению
 ,
,
где χ – мольная доля В.
Согласно первому закону Рауля для растворов неэлектролитов
 , откуда
, откуда 
где p 0 – давление насыщенного пара чистого растворителя, кПа; p – искомое давления насыщенного пара над раствором, кПа.
14. Раствор, содержащий m 1 г вещества В в m 2 г растворителя, кристаллизуется при температуре на D Т зам °С ниже, чем чистый растворитель. Определить, происходит ли диссоциация или ассоциация вещества В в этом растворе, и в какой степени. Криоскопическая константа растворителя равна К к К·кг/моль.
Решение.
Согласно второму закону Рауля для растворов неэлектролитов
D Т зам = К к cm, откуда 
где D Т зам – понижение температуры замерзания раствора относительно растворителя, °С; К к – криоскопическая константа растворителя, К·кг/моль; cm – моляльная концентрация В, моль/кг.
По определению
 откуда
откуда 
где 1000 г/кг – пересчетный коэффициент; n – количество вещества В, моль; m 2 – физическая масса растворителя, г; m 1 – физическая масса В, г; M – молярная масса В в растворе, г/моль.
Если M > M (В), то происходит ассоциация вещества В в этом растворе, и
 ,
,
где β – степень ассоциации; M ( В) – молярная масса индивидуального вещества В, г/моль.
Если M < M (В), то происходит диссоциация вещества В в этом растворе, и
 ,
,
где α – степень диссоциации.
15. Температура замерзания водного раствора неэлектролитаВравна Т зам р-ра К. Давление пара чистой воды при этой же температуре равно p 0 Па, а энтальпия плавления льда составляет Δ H пл Дж/моль. Найти давление пара раствора сахара.
Решение.
 ,
,
где К к – криоскопическая константа растворителя (воды), К·кг/моль; R = 8,31  – универсальная газовая постоянная; Т зам р-ля – температура замерзания растворителя (воды), К; M – молярная масса растворителя, г/моль; Δ H пл – энтальпия плавления растворителя (льда), Дж/моль.
– универсальная газовая постоянная; Т зам р-ля – температура замерзания растворителя (воды), К; M – молярная масса растворителя, г/моль; Δ H пл – энтальпия плавления растворителя (льда), Дж/моль.
D Т зам = T зам. р-ля – T зам. р-ра,
где D Т зам – понижение температуры замерзания раствора относительно растворителя, К; T зам. р-ра – температура замерзания раствора, K.
Согласно второму закону Рауля для растворов неэлектролитов
D Т зам = К к cm, откуда 
где cm – моляльная концентрация В, моль/кг.
 ,
,
где χ – мольная доля В.
Согласно первому закону Рауля для растворов неэлектролитов
 , откуда
, откуда  ,
,
где p 0 – давление насыщенного пара чистой воды, Па; p – искомое давления насыщенного пара раствора, Па.
16. Водный раствор неэлектролитаВкристаллизуется при t лзам. р-ра °С. Моляльная концентрация этого раствора равна __ моль/кг. Криоскопическая константа воды равна К к К·кг/моль.
Решение.
D Т зам = t зам. воды – t зам. р-ра,
где D Т зам – понижение температуры замерзания раствора относительно растворителя, К; t зам. р-ра – температура замерзания раствора, 0C; t зам. воды – температура замерзания воды, 0C.
Согласно второму закону Рауля для растворов неэлектролитов
D Т зам = К к cm, откуда  ,
,
где К к – криоскопическая константа растворителя, К·кг/моль; cm – искомая моляльная концентрация В, моль/кг.
17. Сколько моль неэлектролитаВ нужно растворить в m кг воды для получения раствора, температура кипения которого равна t кип. р-ра °С? Эбулиоскопическая константа воды равна К э К·кг/моль.
Решение.
D Т кип = t кип. р-ра – t кип. воды,
где D Т кип – повышение температуры кипения раствора относительно воды, К;
t кип. р-ра – температура кипения раствора, °С; t кип. воды – температура кипения воды, °С.
Согласно второму закону Рауля для растворов неэлектролитов
D Т кип = К э cm, откуда  ,
,
К э – эбулиоскопическая константа воды, К·кг/моль; cm – моляльная концентрация неэлектролитаВ, моль/кг.
По определению
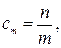 откуда
откуда 
где n – искомоеколичество вещества В, моль; m – физическая масса воды, кг.
18. Раствор, содержащий m 1 г неэлектролита В в m 2 кг воды, кипит при t кип. р-ра °С. Молярная масса этого вещества равна __ г/моль. Эбулиоскопическая константа воды равна К э К·кг/моль.
Решение.
D Т кип = t кип. р-ра – t кип. воды,
где D Т кип – повышение температуры кипения раствора относительно воды, К;
t кип. р-ра – температура кипения раствора, °С; t кип. воды – температура кипения воды, °С.
Согласно второму закону Рауля для растворов неэлектролитов
D Т кип = К э cm, откуда  ,
,
К э – эбулиоскопическая константа воды, К·кг/моль; cm – моляльная концентрация неэлектролитаВ, моль/кг.
По определению
 откуда
откуда 
где n – количество вещества В, моль; m 2 – физическая масса воды, кг.

где M – искомая молярная масса В, г/моль; m 1 – физическая масса В, г.
19. Температура кипения ω%-ного водного раствора электролита равна t кип. р-ра °С. Эбулиоскопическая константа воды равна К э К·кг/моль. Определите изотонический коэффициент раствора электролита.
Решение.
D Т кип = t кип. р-ра – t кип. воды,
где D Т кип – повышение температуры кипения раствора относительно воды, К;
t кип. р-ра – температура кипения раствора, °С; t кип. воды – температура кипения воды, °С.
m 1 = ω, m 2= 100 – ω,
где m 1 и m 2 – физические массы В и воды в 100 г раствора, г; ω – массовая доля В, %.
 ,
,
где n – количество вещества В в 100 г раствора, моль; M – молярная масса В, г/моль.
По определению

где cm – моляльная концентрация электролитаВ, моль/кг; 1000 г/кг – пересчетный коэффициент; m 2 – физическая масса воды, г.
Согласно второму закону Рауля для растворов электролитов
D Т кип = iК э c
|
|
|
|
|
Дата добавления: 2015-11-05; Мы поможем в написании ваших работ!; просмотров: 375 | Нарушение авторских прав
Лучшие изречения:




