Дистилляция (перегонка)– разделение жидких смесей, основанный на различии t кипения компонентов смеси. 5. Отгонка – определяемый компонент выделяют из жидкой или твердой пробы в виде газов. 6. Сублимация (возгонка)– перевод в-ва из твердой фазы в газообразную, минуя жидкую. 7. Внутренний электролиз – осуществляется без наложения внешнего напряжения определяемое в-во участвует работе гальванического элемента. 8. Электрофорез – разделение диспиргированных частиц в жидкость. В основе метода лежат различия в скорости перемещения разделяемых компонентов в электр. поле 9. Электродиализ - процесс диффузий ионов через полупроницаемую мембрану, регулируемый наложением напряжения постоянного тока.
Хим. равновесие.
При нцип Ле-Шателье-Брауна: если на систему, находящуюся в состоянии устойчивого хим. равновесия оказывать внешнее воздействие, то в системе начнут самопроизвольно осуществляться процессы в таком направлении, к-рое будет ослаблять внешнее воздействие и само равновесие сместится в том же направлении. Например, повышение t смещает равновесие в сторону –Q, а понижение +Q. При повышении давления в системе начинают протекать процессы, сопровождающиеся уменьшением его объема, а при понижении – увеличение объема системы. В 1867г. норвежские ученые Гульдберг и Ваге установили закон действующих масс: скорость хим. реакции прямопропорциональна произведению концентрации реагирующих в-в в степенях равных стехиометрическим коэффициентам.
Истинная константа:, где а, а, а, а - в-ва активности равновесных в-в. k – истинная термодин. константа, зависит от природы реагентов, t, и не зависит от С. Если в системе протекают и другие побочные реакции с участием реагентов A, B, C, D или одного, то в них могут достигаться и другие хим. равновесие. (уловная константа):. где [ ], [ ], [ ], [ ] – суммы равновесных концентраций всех форм реагентов.
Протолитическая теория.
Первой была теория Аррениуса: к-ты – в-ва при диссоциации обр. ионы H, а основания OH.
Теория Бренстеда-Лаури(1923): к-та – это в-во при ионизации выделяет протон, а основание – принимает протон. В-ва переносчики протонов – протолиты. Теряя протон, к-та превращается в сопряженное с ней основание, а основание приобретая протон – в сопряженную с ним к-ту.
. Для водных р-ров: HB+H2O=H3O(ион гидраксония)+B. Протолитические реакции где участвует вода.
Компонент протол. реакции – растворитель. Растворители:1). Апротонные(нет ни к-ных ни основных свойств) – углеводороды и их галогенопроизводные. 2). Протофильные (только основные свойства) – кетоны, простые эфиры, третичные амины. 3). Амфипротные (есть основные и кислотные свойства) – воды, спирты, карбоновые к-ты, первичные амины. У этих растворителей есть одна особенность – передача протона от одной молекулы к другой. (). Процессы, в к-рых одна молекула раст-теля проявляет св-ва к-ты, а другая основание называют автопротолизом. Катион, образующийся из молекулы растворителя () – лионий, а анион() – лиат.
Водородный показатель.
Это мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:  . Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH.
. Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH. 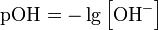 . как в любом водном растворе при 22 °
. как в любом водном растворе при 22 °  очевидно, что при этой температуре:
очевидно, что при этой температуре:  .
.




