I семестр
ЗАНЯТИЕ № 1
ТЕМА: Основы химической термодинамики и биоэнергетики. Химическое равновесие.
Задачи для самостоятельного решения:
Задача 1. На испарение 1 моля воды требуется 40 кДж. Сколько теплоты будет потеряно за день при выделении через кожу 720г воды?
Ответ: 1600 кДж
Задача 2. Пероксид водорода (Н2О2) в виде раствора с массовой долей 3 %. используется в медицине для обработки ран. Докажите, что процесс разложения пероксида водорода в присутствии фермента каталазы является самопроизвольным, используя для расчёта значения стандартной энтропии образования исходных веществ и продуктов реакции:
S0 298 (H2O2) =110 Дж/моль×К; S0 298 (Н2О) = 70 Дж/моль×К; S0298(O2) = 205 Дж/моль×К.
Ответ: Δ S = 62,5 Дж/моль × К
Задача 3. При сжигании метана объемом 2 м3 выделяется 79600 кДж теплоты. Рассчитайте стандартную теплоту сгорания метана.
Ответ: 891,52 кДж/моль
Задача 4. Рассчитайте стандартную энергию Гиббса для процесса окисления глюкозы по следующим данным: DН0обр (С6Н12О6) = - 1264,4 кДж/моль; DН0обр (СО2) = - 393 кДж/моль;
DН0обр (Н2О) = - 286 кДж/моль. Изменение энтропии всей реагирующей системы равно 0,259 кДж/моль×K
Ответ: DG = - 2886,8 кДж/моль.
Задача5. Вычислите стандартную энтальпию образования этанола, воспользовавшись необходимыми для этого стандартными энтальпиями сгорания.
Ответ: DН0обр. = -273 кДж/моль
Задача 6. Константа равновесия реакции N204(г) ↔ 2N02 (г) при 25°С равна 0,1. В каком направлении будет идти реакция при следующих концентрациях веществ:
а) С(N02) = С(N204) = 0,1 моль/л;
б) С(N02) = 0,01 моль/л; C(N204) = 0,02 моль/л?
Задача 7. Для реакции H2 + I2 ® 2HI при 4440С константа равновесия равна 50. Определите направление процесса, если исходная смесь имеет следующий состав: С(H2) = 2моль/л, С(HI) = 10моль/л.
Ответ: Состояние равновесия, т.к ∆G=0.
Задача 8.Рассчитайте константу равновесия, если DG0 298 для данной реакции равно 4,478 кДж/моль.
Ответ: 6,1
Задача 9. Константа равновесия разложения лекарственного вещества в автоклаве при 413К равна 0,396∙105 Па, а при 443К - 1,286∙105 Па. Вычислить тепловой эффект реакции.
Ответ: 59,6 кДж/моль.
Задача 10. Используя значение ΔG° установите, существует ли угроза отравления больного при использовании в качестве наркотического средства оксида азота(I), Токсичный оксид азота (II) может образовываться по реакции: 2N2O + O2 = 4NO. Все вещества находятся в газообразном состоянии. Справочные данные см. в таблице.
ЗАНЯТИЕ №2
ТЕМА: Окислительно – восстановительные реакции. Электродные потенциалы.
Задания для самостоятельного решения
1) Согласно уравнению Нернста потенциал электрода…
1) Зависит от его массы 2) Зависит от его природы
3)Не зависит от температуры 4) Не зависит от концентрации электролита
2) ЭДС гальванического элемента, состоящего из медного и цинкового электродов, погруженных в 0,01 М растворы их сульфатов
(Е0Сu2+/Cu=0,34B, Е0Zn2+/Zn=-0,76B) равна___ В.
1) 1,10 2) 0,70 3) 0.28 4)0,43
3) Если при электролизе водного раствора соли значение рН в катодном пространстве возросло, то электролизу подвергался раствор…
1) Cu(NO3)2 2)KCl 3) CuCl2 4) ZnCl2
4) В гальваническом элементе, состоящем из никелевого  и железного
и железного  электродов, погруженных в 1 М растворы их солей, на аноде протекает процесс …
электродов, погруженных в 1 М растворы их солей, на аноде протекает процесс …
1) 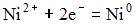 2)
2) 
3)  4)
4) 
5) Сумма коэффициентов в суммарном уравнении процесса электролиза водного раствора AgNO3 равна…
1) 11 2) 15 3) 3 4) 7
6) При электролизе раствора хлорида меди (II) на катоде выделилось 2,7 г меди. Объем газа (н.у.), выделившегося на аноде равен _______ л.
1) 4,48 2) 0,945 3) 2,24 4) 6,72
7) Сумма коэффициентов в левой части уравнения реакции KMnO4 + Na2SO3 + H2SO4®… составляет…
1) 6 2) 8 3) 12 4) 10
8) При прохождении через раствор нитрата серебра количества электричества величиной 48250Кл на катоде образуется ___граммов чистого серебра (F=96500Кл/моль).
1) 27 2) 54 3) 18 4) 108
9) Коэффициент перед молекулой восстановителя в уравнении реакции KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O равен.
1) 5 2) 3 3) 2 4) 1
10) Если гальванический элемент составлен из двух серебряных электродов, один из которых стандартный, то для достижения наибольшего ЭДС другой электрод следует погрузить в раствор AgNO3 c концентрацией
1) 0,5 М 2) 0,2 М 3) 0,4 М 4) 0,1 М
11) ЭДС гальванического элемента состоящего из железного и серебрянного электродов, погруженных в 0,1 М растворы их нитратов Е0(Fe+2/ Fe)= -0,44 В, Е0(Ag+/ Ag)= 0,80 В, равна_______В.
1) 1,21 2) 1,24 3) – 1,21 4)– 1,24
12) Для получения 54 г серебра электролизом водного раствора нитрата серебра (выход по току 100%), необходимо чтобы в растворе содержалось___граммов чистой соли
1) 255 2) 85 3) 340 4) 170
13) При электролизе воды на аноде выделилось 11,2 л (н.у.) кислорода. Объем водорода, выделившегося на катоде равен ____ л (н.у.)
1) 22.4 2) 5.6 3) 44.8 4) 11.2
14) Если гальванический элемент составлен из двух электродов, один из которых стандартный цинковый электрод Е0 = -0,76В, то для достижения наибольшего значения Э.Д.С. другим электродом должен бытьстандартный
1) медный Е0=+0,34 В 2) серебряный Е=+0,8 В
3)свинцовый Е=-0,13 В 4) водородный
15 ) Максимальное значение ЭДС (при одинаковых концентрациях солей) будет у гальванического элемента Ме|Me(NO3)2||Cu(NO3)2|Cu, если стандартный потенциал второго металла равен ___В.
1) – 0,76 2) – 2,36 3) + 1,19 4) +1,50






