Алгоритм решения задач по химическому уравнению, если один из реагентов взят в избытке.
Задачи на избыток - недостаток).

Помните: 1. Задача состоит из 3-ёх частей:
I - химическая – краткая запись данных, составление уравнения реакции;
II - аналитическая – анализ данных в условии и уравнения реакции;
III - математическая – расчеты по уравнению реакции.
2. Данный тип задач предполагает дополнительное действие: определение реагента, который взят в избытке.
3. Массу (количество, объем) продукта определяют по веществу, полностью израсходованному в реакции..
1. Метод пропорции.
| Порядок действий (пошаговый): | Пример: Какой объём газа выделится при взаимодействии 6,5 г цинка с 19,6 г серной кислоты? |
| I.Запишите краткое условие задачи и уравнение химической реакции, подчеркните вещества, о которых идет речь в задаче. |  Д а н о: Решение:
m(H2SO4)=19.6г Д а н о: Решение:
m(H2SO4)=19.6г
 m (Zn) = 6,5г Zn + H2SO4 = ZnSO4 + H2
V (H2)? m (Zn) = 6,5г Zn + H2SO4 = ZnSO4 + H2
V (H2)?
|
| II – 1.Данные из условия задачи запишите над формулами соответствующих веществ в уравнении. Чтобы решить, по какому из реагентов можно определить продукт, обозначьте один из них переменной (например, y) и составьте пропорцию относительно него. | 6,5г 19.6 г Хл
 Zn + H2SO4 = ZnSO4 + H2
Пусть масса H2SO4 – У г, тогда уравнение имеет вид: Zn + H2SO4 = ZnSO4 + H2
Пусть масса H2SO4 – У г, тогда уравнение имеет вид:
 6,5г У г
Zn + H2SO4 = ZnSO4 + H2 6,5г У г
Zn + H2SO4 = ZnSO4 + H2
|
 II – 2.Под этими же формуламизапишите данные из уравнения реакции в следующей последовательности:
а) количество вещества по уравнению перемножь-
б) молярную массу (или объем) вещества; те их
(воспользуйтесь формулой: m= M * n или V = Vm * n)
в) массу (объем) вещества по уравнению II – 2.Под этими же формуламизапишите данные из уравнения реакции в следующей последовательности:
а) количество вещества по уравнению перемножь-
б) молярную массу (или объем) вещества; те их
(воспользуйтесь формулой: m= M * n или V = Vm * n)
в) массу (объем) вещества по уравнению
|   6,5г Уг 6,5г Уг
 Zn + H2SO4 = ZnSO4 + H2 Zn + H2SO4 = ZnSO4 + H2
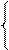 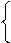 х 1 моль х 1 моль х 1 моль х 1 моль
  М=65г/моль М=98г/моль
m = 65г m=98 г
Помните: единицы измерения количеств веществ по условию и
по уравнению должны совпадать! М=65г/моль М=98г/моль
m = 65г m=98 г
Помните: единицы измерения количеств веществ по условию и
по уравнению должны совпадать!
|
| III -1.Составьте пропорцию и решите её. (крест-накрест) (Для этого впишите в неё самую верхнюю и самую нижнюю цифры, которые у Вас получились.) Сравните полученный результат с данным по усло- вию задачи: если У <, чем дано в условии, то этот реагент дан в в избытке если У >, чем дано в условии, то этот реагент дан в недостатке. Расчет ведём по веществу, данному в недостатке! | 6,5г ‗ Уг
65г 98г
У‗ 6,5г * 98г ‗ 9,8 г
65г
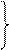 по условию масса серной кислоты = 19,6г 9,8 < 19,6
по уравнению на 6,5г цинка необходимо 9,8г
Серная кислота дана в избытке.
Расчет продукта реакции будем проводить по массе цинка.
по условию масса серной кислоты = 19,6г 9,8 < 19,6
по уравнению на 6,5г цинка необходимо 9,8г
Серная кислота дана в избытке.
Расчет продукта реакции будем проводить по массе цинка.
|
| III -2.Составьте пропорцию относительно реагента, данного в недостатке и продукта реакции. Определите массу (объем, количество) продукта реакции и запишите ответ. |     6,5г Хл
Zn + H2SO4 = ZnSO4 + H2 6,5 г ‗ Хл. 6,5г Хл
Zn + H2SO4 = ZnSO4 + H2 6,5 г ‗ Хл.
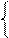  х 1 моль х 1 моль 65г 22,4л х 1 моль х 1 моль 65г 22,4л
  М=65г/моль Vm=22,4л/моль
m = 65г V = 22,4 л Х = 2,24 л. М=65г/моль Vm=22,4л/моль
m = 65г V = 22,4 л Х = 2,24 л.
|






