“ема. омплексонометрическое определение кальци€, магни€ в воде.
÷ель. ќзнакомитьс€ с методом комплексонометрического титровани€, со способом стандартизации раствора комплексона III, определить содержание кальци€ и магни€ в питьевой воде.
∆есткостью воды называетс€ совокупность свойств, обусловленных содержанием в ней щелочноземельных элементов, преимущественно ионов кальци€ и магни€.
¬ зависимости от рЌ и щелочности воды жесткость выше 10∞∆ может вызывать образование шлаков в распределительной системе водоснабжени€ и накипи при нагревании. ¬ода жесткостью менее 5∞∆ может оказывать коррозионное воздействие на водопроводные трубы. ∆есткость воды может вли€ть и на примен€емость дл€ потреблени€ человеком с точки зрени€ ее вкусовых свойств.
—огласно √ќ—“ 6055 Ц 86 различают:
Ø карбонатную жесткость Ц это совокупность свойств воды, обусловленных присутствием в ней гидрокарбонатов кальци€, магни€ и железа. „асто этот вид жесткости называют временной или устранимой;
Ø некарбонатную жесткость Ц совокупность свойств воды, обусловленных присутствием в ней сульфатов, хлоридов, силикатов, нитратов и фосфатов кальци€, магни€ и железа. Ётот вид жесткости также называют посто€нной или неустранимой;
Ø общую жесткость, складывающуюс€ из карбонатной и некарбонатной жесткости. ќна равна сумме концентраций ионов —а2+, Mg2+, Fе2+.
оличественно жесткость воды выражают единицами жесткости. ƒл€ общей жесткости воды она равна сумме мол€рных концентраций эквивалентов ионов кальци€ (½Ca2+) и магни€ (½Mg2+) в воде, т.е. одна единица жесткости соответствует массовой концентрации ионов —а2+, равной 20,4 мг/л или ионов Mg2+, равной 12,15 мг/л. ≈диницей измерени€ жесткости €вл€лс€ моль/м3. „исловое значение жесткости, выраженное в ммоль/л, совпадает со значением в моль/м3.
ѕри оценке жесткости воды обычно воду характеризуют следующим образом:
| ¬ода | ∆есткость, ммоль/л |
| очень м€гка€ вода | < 1,5 |
| м€гка€ вода | 1,5 - 4 |
| вода средней жесткости | 4 - 8 |
| жестка€ вода | 8 - 12 |
| очень жестка€ вода | > 12 |
ќбщую жесткость питьевых вод определ€ют по √ќ—“ – 52407-2005.
ћетод определени€ жесткости основан, на реакции комплекообразовани€ между катионами кальци€ и магни€ (катионы жесткости) и полидентатным лигандом - динатриевой солью этилендиаминтетрауксусной кислоты (комплексон III или “рилон Ѕ) при рЌ = 9 - 10. омплексон III имеет структуру:
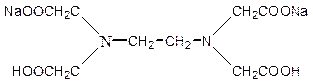
–еакции взаимодействи€ комплексона III с катионами —а2+ и ћg2+ в аммиачном буферном растворе при рЌ = 9-10 могут быть выражены уравнением:
Me2+ + HY3- + NH3 ó MeY2- + NH4+

ƒл€ титровани€ с комплексоном III используют металлохромный индикатор - эриохром черный “ (обща€ формула H3Ind):
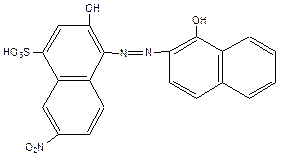
»ндикатор при рЌ =9 - 10 образует с ионами —а2+ и Mg2+ окрашенное в красный цвет комплексное соединение, менее прочное чем комплексонаты кальци€ и магни€:
Me2+ + HInd2Ц + NH3 ó MeIndЦ + NH4+
голубой красный
|
|
|
ќбразующийс€ комплекс имеет строение:

ѕри титровании раствором комплексона III, комплекс металла с индикатором менее прочный, он разрушаетс€:
MeIndЦ+ HY3Ц + NH3 ó MeY2Ц+HInd2-+NH4+
красный голубой
“аким образом, в точке эквивалентности наблюдают цвет свободного индикатора в аммиачном буфере.
–астворы: раствор комплексона III с концентрацией —(½ омплексон III) = 0,05 моль/л; стандартный раствор соли цинка(≤≤) с концентрацией —(½ Zn2+) = 0,05000 моль/л; аммиачный буферный раствор с рЌ 9,5-10; индикаторна€ смесь эриохрома черного “ с хлористым натрием (1:100).
—тандартизаци€ раствора комплексона III
јликвоту 10,00 мл стандартного раствора соли цинка перенос€т в коническую колбу дл€ титровани€, добавл€ют 70 мл дистиллированной воды, 10 мл буферного раствора и около 0,1 г индикаторной смеси эриохрома черного “. –аствор перемешивают и титруют из бюретки раствором комплексона III до перехода красной окраски раствора в голубую. “итрование повтор€ют несколько раз.
ћол€рную концентрацию раствора комплексона III рассчитывают по формуле:
| — (½ омплексона III) = | —(½Zn2+)ЈV(Zn2+) |
| VкомплексонаIII |
где —(½Zn2+) Ц мол€рна€ концентраци€ эквивалента стандартного раствора соли цинка, моль/л;
V(Zn2+) Ц объем аликвоты стандартного раствора цинка, мл;
VкомплексонаIII Ц объем раствора комплексона III, пошедший на титрование.
ќпределение общей жесткости воды комплексонометрическим методом
ќ“Ѕќ– ѕ–ќЅ
ќбщие требовани€ к отбору проб - по √ќ—“ – 51592 и √ќ—“ – 51593.
ѕробу анализируемой воды отбирают в емкость, изготовленную из полимерных материалов или стекла. —рок хранени€ пробы воды - не более 24 ч.в. ќтбор пробы производитс€ после спуска воды в течение не менее 15 минут при полностью открытом кране. ќбъем пробы воды дл€ определени€ общей жесткости должен быть не менее 400 мл. ƒл€ увеличени€ срока хранени€ пробы и дл€ предотвращени€ осаждени€ из воды карбонатов кальци€ (что характерно дл€ подземных или бутилированных вод) пробу подкисл€ют сол€ной кислотой до рЌ < 2. онтроль рЌ провод€т по универсальной индикаторной бумаге или с использованием рЌ-метра. —рок хранени€ подкисленной пробы воды - не более одного мес€ца.
¬ коническую колбу дл€ титровани€ внос€т 100 мл испытуемой воды или меньший объем, разбавленный до 100 мл дистиллированной водой. «атем прибавл€ют 5 мл аммиачного буферного раствора, приблизительно 0,1 г сухого индикатора эриохрома черного “ и сразу же титруют при сильном взбалтывании 0,05 ћ раствором комплексона ≤≤≤ до изменени€ окраски в эквивалентной точке из красной в синюю с зеленоватым оттенком.
≈сли после прибавлени€ к отмеренному объему воды буферного раствора и индикатора титруемый раствор постепенно обесцвечиваетс€, приобрета€ серый цвет, что указывает на присутствие марганца, то в этом случае к пробе воды, отобранной дл€ титровани€, до внесени€ реактив следует прибавить 5 капель 1%-ного раствора сол€нокислого гидроксиламина и далее определ€ют жесткость, как указано выше.
≈сли титрование приобретает крайне зат€жной характер с неустойчивой и нечеткой окраской в эквивалентной точке, что наблюдаетс€ при высокой щелочности воды, ее вли€ние устран€етс€ прибавлением к пробе воды, отобранной дл€ титровани€, до внесени€ реактивов 0,1н раствора HCl в количестве, необходимом дл€ нейтрализации щелочности воды, с последующим кип€чением или продуванием раствора воздухом в течение 5 мин. ѕосле этого прибавл€ют буферный раствор, индикатор и далее определ€ют жесткость, как указано выше.
|
|
|
«апись в лабораторном журнале:
ќбъем аликвоты воды, з€той дл€ анализа V(Ќ2ќ) = 100,0 мл
онцентраци€ раствора титранта C(½ омплексона III)Ј= _,_ _ _ _ моль/л
ќбъем раствора титранта, пошедший на титрованиеVкомплексонаIII (1) =_ _,_ _ мл
VкомплексонаIII (2) =_ _,_ _ мл
VкомплексонаIII (3) =_ _,_ _ мл
VкомплексонаIII (среднее)=_ _,_ _ мл
ќбщую жесткость воды —(½Ca2+, ½ Mg2+) в ммоль/л (∞∆) вычисл€ют по формуле:
| —(½Ca2+, ½ Mg2+) = | C (½ омплексона III)ЈVкомплексонаIIIЈ1000 |
| Vводы |
где C (½ омплексона III) - концентраци€ раствора комплексона ≤≤≤, рассчитанна€ при стандартизации раствора титранта, моль/л;
VкомплексонаIII Ц среднее значение объема раствора комплексона ≤≤≤, израсходованного на титрование, мл;
Vводы - объем воды, вз€тый дл€ определени€, мл.
–асхождени€ между повторными определени€ми не должно превышать 2 отн.%.
Ћитература
1. √ќ—“ – 52407-2005. ¬ода питьева€. ћетоды определени€ жесткости. Ц ћ.: —тандартинформ, 2006. -
2. Ўевчук ».ј., —имонова т.Ќ., –окун ј.Ќ. ѕрактикум по аналитической химии: гравиметрический и титриметрический методы в анализе природных и промышленных объектов. Ц ƒонецк: »зд-во Ђ¬еберї (ƒонецкое отделение), 2009. Ц 392 с.
3. ѕилипенко ј.“., ѕ€тницкий ».¬. јналитическа€ хими€. - ћ.:’ими€, 1990. - “.1. - —.273 - 291.






