В чём состоит различие процессов электролитического разложения раствора сульфата меди на угольном и медном анодах?
Ответ
На катоде могут разряжаться вода и катионы меди. Так как  >
> 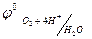 , восстанавливаться будет медь.
, восстанавливаться будет медь.
Конкурирующими анодными реакциями (угольный анод) являются окисление воды и окисление сульфат – иона. Так как  >
> 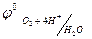 , следовательно, на аноде окисляется вода.
, следовательно, на аноде окисляется вода.
Схема электролиза CuSO4 на угольном аноде
 (-) Катод: (+) Анод:
(-) Катод: (+) Анод:
Сu2+ + 2ē → Cu 2Н2О - 4ē → О2 + 4Н+
SO42-
При использовании медного анода окислению подвергается материал анода - медь, в результате чего анод будет растворяться.
Схема электролиза CuSO4 на медном аноде
 (-) Катод: (+) Анод:
(-) Катод: (+) Анод:
Сu2+ + 2ē → Cu Сu - 2ē → Cu2+
SO42-
Следовательно, электролиз растворов сульфата меди (II) на угольном и растворимом аноде отличаются анодными процессами. При электролизе на инертном аноде окисляется вода, образуя кислород и кислоту, в случае растворимого анода данные процессы происходить не будут.
Процессы, протекающие при электролизе, подчиняются законам Фарадея.
I. Масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся веществ прямо пропорциональны количеству электричества, прошедшего через электролит.
m = k . q
где m - масса (г) образовавшегося, или подвергшегося превращению вещества;
q – количество электричества, прошедшего через электролит (Кл),
q = J . t,
J – сила тока, А; t – время, с.
k – электрохимический эквивалент.
Электрохимический эквивалент численно равен массе вещества, выделяемого 1 Кл электричества.
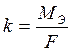
МЭ – молярная масса эквивалента, г/моль-экв;
F – постоянная Фарадея, равная 96500 Кл.
Постоянная Фарадея – это количество электричества, необходимое для осуществления электрохимического превращения одного моль эквивалента вещества.
Подставив все параметры, получим выражение:

II. При электролизе различных электролитов равные количества электричества выделяют на электродах массы веществ, пропорциональные их эквивалентным массам.







