Особливість задач даного типу полягає в тому, що в умові зазначається маса чи об’єм обох реагуючих речовин, одна з яких дається з кількості, більшій, ніж це необхідно для реакції (тобто, в надлишку). Під час проведення реакції частина такої речовини залишається в реакційній суміші після реакції, тому що не прореагує повністю. Для обчислення продукту реакції необхідно знати масу чи об’єм речовини, що прореагує повністю. Саме за даними цієї речовини (вважається, що вона знаходиться в недостачі) і будуть проводитися обчислення, необхідні для продукту реакції.
Алгоритм
1. Записати повну і скорочену умову задачі.
2. Записати рівняння реакції.
3. Обчислити коефіцієнти пропорційності реагуючих речовин.
4. Довести, яка з речовин у надлишку, для чого порівняти коефіцієнти пропорційності.
5. Обчислити масу (об’єм) продукту реакції за речовиною, коефіцієнт пропорційності якої менший.
6. Записати відповідь.
Опорні формули:
ν (X) = 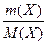 ; ν (X) =
; ν (X) =  ; k =
; k =  ;
;
M(прод)= k∙М(пр)∙υ (пр); V(прод)= k∙Vm∙υ (пр)
Приклад
Який об’єм водню виділиться при взаємодії алюмінію масою 2,16 г з розчином, що містить 9,6 г хлоридної кислоти?
| Дано: | Розв’язання: |
| m (Al) = 2,16 г m (HCl) = 9,6 г | 2,16г 9,6г х л
2Al + 6HCl à 2AlCl3 + 3Н2↑
2∙27=54г 6∙36,5=219г 3∙22,4=67,2л
Обчислюємо коефіцієнти пропорційності:
k (Al) =  =0,04; k (HCl) = =0,04; k (HCl) =  =0,044
4. Коефіцієнт пропорційності менший у алюмінію, отже знаходимо об’єм водню саме за ним:
V(H2) = 0,04 ∙22,4∙3=2,688 (л) =0,044
4. Коефіцієнт пропорційності менший у алюмінію, отже знаходимо об’єм водню саме за ним:
V(H2) = 0,04 ∙22,4∙3=2,688 (л)
|
| Відповідь: об’єм утвореного водню становить 2,688 л |
Вправа Знайти масу солі, яка утвориться в результаті зливання 0,5 л розчину з масовою часткою натрій гідроксиду 20% (густина 1,22 г/мл) і 0,2 кг розчину з масовою часткою сульфатної кислоти 19,6%.
Вправа У розчин сульфатної кислоти масою 200 г з масовою часткою 0,2 опустили 9,5 г магнію. Визначити об’єм газу, який утворився внаслідок реакції.
Вправа На магній хлорид масою 9,5 г подіяли натрій гідроксидом масою 5 г. Яка маса осаду при цьому утвориться?
Вправа Знайти масу солі, яка утвориться в результаті взаємодії алюмінію масою 5,4 г та сульфуру масою 7,1 г, що містить 10% домішок.
Вправа До розчину, що містить 4,9 г сульфатної кислоти, долили розчин, що містить 11 г барій хлориду. Яка маса осаду утвориться?
Вправа Знайти масу осаду, який утвориться в результаті зливання 0,1 моль барій гідроксиду та 20 г розчину з масовою часткою сульфатної кислоти 50%.
Вправа У розчин купрум сульфату масою 140 г з масовою часткою 16% опустили 5,6 г феруму. Обчислити масу солі, яка утворилась в результаті реакції.
Вправа Знайти масу осаду, який утвориться в результаті зливання 40 г розчину купрум сульфату з масовою часткою 25% та 20 г розчину натрій гідроксиду з масовою часткою 20%.
Вправа Який об’єм (н.у.) сульфур (ІV) оксиду можна добути, якщо для спалювання 1,6 г сірки взято 2,8 літри (н.у.) кисню?
Вправа Знайти масу солі, яка утвориться при зливанні 100 г розчину з масовою часткою натрій гідроксиду 10% і хлоридної кислоти кількістю речовини 0,5 моль.
Вправа Знайти масу солі, яка утвориться в результаті зливання 200 г розчину з масовою часткою хлоридної кислоти 0,073 та 200 г розчину з масовою часткою калій гідроксиду 0,056.
Вправа Знайти масу солі, яка утвориться при зливанні 500 г розчину з масовою часткою калій гідроксиду 14% і 200 г розчину з масовою часткою нітратної кислоти 25%.
Вправа Обчислити масу осаду, утвореного в результаті зливання 200 г розчину з масовою часткою барій гідроксиду 8% та 400 г розчину з масовою часткою сульфатної кислоти 1%.
Вправа Який об’єм амоніаку виділиться, якщо на амоній сульфат масою 67 г подіяти натрій гідроксидом масою 40 г?
Вправа Який об’єм газу (н.у.) виділиться при взаємодії 50 г розчину з масовою часткою нітратної кислоти 0,63 з 4 г кальцій карбонату?
Вправа Кальцій масою 20 г розчинили у сульфатній кислоті масою 200 г з масовою часткою кислоти 19,6 %. Який об’єм газу при цьому виділився?
Нітратна кислота
Молекулярна формула: HNO3
Структурна формула:

Пунктиром показана валентність, розподілена між двома атомами Оксигену й атомом Нітрогену; отже, електрони при утворенні зв’язку розподілені не між двома атомами, а між трьома.
У молекулі нітратної кислоти HNО3 Нітроген перебуває в ступені окиснення +5, але при цьому проявляє валентність, що дорівнює 4.
Фізичні властивості: Нітратна кислота за нормальних умов являє собою безбарвну, важку димну рідину (ρ = 1,52 г/см3), яка кристалізується при температурі -42 °С, а кипить при температурі +83 °С. Ця кислота має їдкий характерний запах. У твердому стані HNО3 є безбарвною кристалічною масою. При температурі близько +25 °С вона набуває жовтого забарвлення унаслідок виділення бурого газу NО2:
4 HNO3 → 4 NO2 + 2 H2O + O2
Нітратна кислота змішується з водою в будь-яких співвідношеннях. Як і сульфатна кислота, вона енергійно поглинає вологу, тобто проявляє гігроскопічні властивості.
Добування: вихідною сировиною у промисловому виробництві нітратної кислоти є амоніак NH3. Процес одержання HNO3 складається з трьох стадій:
1) каталітичне окиснення амоніаку:
4 NH3 + 5 O2 → 4 NO + 6 H2O
2) окиснення нітроген (ІІ) оксиду:
2 NO + O2 ↔ 2 NO2
3) взаємодія нітроген (ІV) оксиду з киснем та водою:
4 NO2 + 2 H2O + O2 → 4 HNO3
У лабораторних умовах нітратну кислоту можна добути дією концентрованої сульфатної кислоти на кристали нітратів:
NaNO3 + H2SO4 → NaHSO4 + HNO3
2 NaNO3 + H2SO4 → Na2SO4 + 2 HNO3
Хімічні властивості: належить до сильних кислот і проявляє всі характерні властивості кислот:
1) електролітична дисоціація:
HNO3 ↔ H+ + NO3 –
нітрат –йон
Утворені йони Н+ діють на індикатори, змінюючи їх забарвлення: лакмусу – на червоний, метилоранжу - на рожевий, фенолфталеїн залишається безбарвним.
2) взаємодія з основними та амфотерними оксидами:
MgO + 2 HNO3 → Mg(NO3)2 + H2O
MgO + 2 H+ + 2 NO3 - → Mg2+ + 2 NO3 - + H2O
MgO + 2 H+ → Mg2+ + H2O
K2O + 2 HNO3 → 2 KNO3 + H2O
Fe2O3 + 6 HNO3 → 2 Fe(NO3)3 + 3 H2O
3)взаємодія з основами та амфотерними гідроксидами:
NaOH + HNO3 → NaNO3 + H2O
натрій нітрат
Na+ + OH- + H+ + NO3 - → Na+ + NO3 - + H2O
H+ + OH- → H2O
Zn(OH)2 + 2 HNO3 → Zn(NO3)2 + 2 H2O
Zn(OH)2 + 2 H+ + 2 NO3 - → Zn2+ + 2 NO3 - + 2 H2O
Zn(OH)2 + 2 H+ → Zn2+ + 2 H2O
4) взаємодія з солями: нітратна кислота витісняє слабкі кислоти з їх солей:
Na2СO3 + 2 HNO3 → 2 NaNO3 + H2O + CO2 ↑
2 Na+ + CO3 2- + 2H+ + 2 NO3 - → 2 Na+ + 2 NO3 - + H2O + CO2 ↑
2H+ + CO3 2- → H2O + CO2 ↑
Особливості нітратної кислоти
Нітратна кислота практично ніколи не виділяє водень при взаємодії з металами. Продуктами реакції нітратної кислоти з металом є три речовини: нітрат металу, вода та один з продуктів відновлення Нітрогену:
+5
М + HNO3 → MNO3 + H2O + продукт відновлення Нітрогену
+4 +2 +1 0 -3
NO2 NO N2O N2 NH3 (NH4NO3)
Орієнтовно можливість утворення того чи іншого продукту відновлення Нітрогену можна передбачити за такою схемою:
HNO3
_____________________________ │ ____________________________
↓ ↓
Концентрована Розбавлена
N2O з активним металом N2, NH4NO3
NO2 з малоактивним металом NO
Нітратна кислота реагує також з металами, що розташовані у ряду активності після Гідрогену (крім золота Au та платини Pt), наприклад, з міддю:
Cu + 4 HNO3 (конц.) → Cu(NO3)2 + 2 NO2 + 2 H2O
Cu0 - 2e- → Cu+2 │ 1 │ відновник (процес окиснення)
N+5 +1e- → N+4 │ 2 │ окисник (процес відновлення)
3 Cu + 8 HNO3 (розв.) → 3 Cu(NO3)2 + 2 NO2 + 4 H2O
Cu0 - 2e- → Cu+2 │ 3 │ відновник (процес окиснення)
N+5 +3e- → N+2 │ 2 │ окисник (процес відновлення)
Концентрована НNO3 при взаємодії з активними метали (лужними і лужноземельними) відновлюється до N2O:
4Mg + 10HNO3 = N2O + 4Mg(NO3)2+ 5H2O.
У реакції з металами середньої активності (Zn, Cd, Sn, Pb, Cu, Ag, Hg) НNO3 відновлюється до NO2:
Cu + 4HNO3 = NO2 + Cu(NO3)2+ 2H2O.
Розбавлена НNO3 при дії на метали (лужні та лужноземельні) відновлюється до NH4NO3:
4Ca + 10HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O.
Менш активні метали (Fe, Co, Ni, Sn) відновлюють розбавлену HNO3 до N2O:
8Fe + 30HNO3 = 8Fe(NO3)3 + 3N2O + 15H2O.
При дії розбавленої HNO3 на Pb, Cu, Bi виділяється NO:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
Деякі метали реагують з розведеною нітратною кислотою й не реагують з концентрованою, тому що на їхній поверхні утворюється тонка, але міцна оксидна плівка, що захищає метал від подальшої дії кислоти («пасивація металу»). Така пасивність характерна для алюмінію, заліза, хрому та деяких інших металів.
Суміш концентрованої нітратної кислоти з хлоридною кислотою у об’ємному співвідношенні 1: 3 називається “царська горілка», у ній розчиняються золото й платина (активний елемент – атомарний хлор у момент виділення):
Au + HNO3 + 3 HCl → AuCl3 + NO + 2 H2O
3 Pt + 4 HNO3 + 12 HCl → 3 PtCl4 + 4 NO + 8 H2O
Концентрована HNO3 окиснює також неметали, такі як сірка, фосфор, вуглець:
S + 6 HNO3 → H2SO4 + 6 NO2 + 2 H2O
3P + 5 HNO3 + 2 H2O → 3 H3PO4 + 5 NO
3C + 4 HNO3 → 3 CO2 + 4NO + 2 H2O
Нітратна кислота настільки сильний окисник, що вона може окиснювати різні органічні речовини і матеріали. Так, під час дії концентрованої нітратної кислоти спалахують солома, папір, тирса, скипидар. Вона руйнує вовну, роз'їдає шкіру, забарвлює її у жовтий колір і спричинює на ній виразки, що не можуть довго загоїтися. Тому з нітратною кислотою треба поводитися дуже обережно.
Застосування нітратної кислоти:
1) виробництво мінеральних добрив;
2) виробництво пластмас;
3) виробництво барвників;
4) синтез лікарських засобів;
5) виробництво дезінфікуючих засобів;
6) виробництво фотоплівки;
7) виготовлення вибухових речовин;
8) виробництво синтетичних волокон;
9) виробництво нітролаків.
Нітрати
Нітратна кислота утворює солі – нітрати.
Як і більшість солей нітрати – йонні сполуки кристалічної будови, переважно безбарвні або білого кольору. Усі нітрати добре розчиняються у воді.
Деякі нітрати використовують як мінеральні добрива під загальною назвою селітри:
NaNO3 – натрієва (чилійська) селітра
KNO3 – калієва селітра
Ca(NO3)2 – кальцієва селітра
NH4NO3 – амонієва селітра
Добування нітратів
а) взаємодія нітратної кислоти з основою:
Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2H2O
б) взаємодія нітратної кислоти з основним оксидом:
CaO + 2HNO3 → Ca(NO3)2 + H2O
в) взаємодія нітратної кислоти з металом:
Cu + 4HNO3 → Cu(NO3)2 +2NO2 +2H2O
г) взаємодія нітратної кислоти з сіллю:
2HNO3 + Na2CO3 → 2NaNO3 + CO2 + H2O
д) взаємодія нітратної кислоти з амоніаком:
NH3 + HNO3 → NH4 NO3
Нітрати утворюються також і під час взаємодії нітроген(V) оксиду з лугами:
N2О5 + 2КОН = 2KNО3 + Н2О
Хімічні властивості: нітрати проявляють усі характерні властивості солей.
1) Взаємодія з металами:
Mg + 2 AgNO3 → Mg(NO3)2 + 2 Ag ↓
Mg + 2 Ag+ + 2 NO3- → Mg2+ + 2 NO3- + 2 Ag↓
Mg + 2 Ag+ → Mg2+ + 2 Ag↓
2) Взаємодія з лугами:
Fe(NO3)3 + 3 NaOH → Fe(OH)3 ↓ + 3 NaNO3
Fe3+ + 3 NO3- + 3 Na+ + 3 OH- → Fe(OH)3 ↓ + 3 Na+ + 3 NO3 –
Fe3+ + 3 OH- → Fe(OH)3 ↓
3) Взаємодія з солями:
3 Ca(NO3)2 + 2 Na3PO4 → Ca3(PO4)2 ↓ + 6 NaNO3
3 Ca2+ + 6 NO3- + 6 Na+ + 2 PO4 3- → Ca3(PO4)2 ↓ + 6 Na+ + 6 NO3-
3 Ca2+ + 2 PO4 3- → Ca3(PO4)2 ↓
4) Взаємодія з кислотами:
AgNO3 + HCl → AgCl ↓ + HNO3
Ag+ + NO3- + H+ + Cl- → AgCl ↓ + H+ + NO3-
Ag+ + Cl- → AgCl ↓
NaNO3 (тв.) + H2SO4 (конц.) → NaHSO4 + HNO3
2 NaNO3 (тв.) + H2SO4 (конц.) → Na2SO4 + 2 HNO3
5) Розклад при нагріванні. Нітрати при нагріванні розкладаються:
NH4NO3 → N2O ↑ + 2 H2O
Напрям реакції розкладу нітратів металів залежить від положення металу у ряду активності (витиску вальний ряд металів):
|
|
|
|
|
 у витискувальному ряді →
у витискувальному ряді → 
|

метал від Mg до Cu → MeO + NO2↑ + O2↑
включно
 метал після Cu → Me + NO2 + O2↑
метал після Cu → Me + NO2 + O2↑
Наприклад: 2KNO3 → 2KNO2 + 3O2
2Сu(NO3)2 → 2CuO + 4NO2 + O2
2AgNO3 → 2Ag + 2NO2 + O2
Застосування нітратів:
- у сільському господарстві як добрива;
- у піротехніці;
- для виготовлення чорного пороху, виробництва вибухових речовин;
- виробництво скла;
- виробництво ліків;
- для обробки та консервування харчових продуктів.
Ортофосфатна кислота
Молекулярна формула: Н3РО4
Структурна формула:
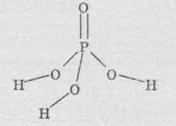
Фізичні властивості: Ортофосфатна кислота являє собою безбарвну й розпливчасту на повітрі кристалічну сполуку із температурою плавлення +42 °С. Ортофосфатна кислота добре розчиняється у воді (до 80% за масою). На відміну від багатьох сполук Фосфору, ортофосфатна кислота не отруйна.
Добування: Виробництво ортофосфатної кислоти проводиться шляхом спалювання білого (жовтого) фосфору у кисні повітря та наступним розчиненням у воді:
4 Р + 5 О2 → 2 Р2О5
Р2О5 + 3 Н2О → 2 Н3РО4
Хімічні властивості: належить до кислот середньої сили. Проявляє всі хімічні властивості кислот:
1) електролітична дисоціація (відбувається ступінчато):
H3PO4 ↔ Н+ + H2PO4ֿ
H2PO4ˉ ↔ Н+ + HPO4²ˉ
HPO4²ˉ ↔ Н+ + PO4³ˉ
H3PO4 ↔ 3 Н+ + PO4³ˉ
2) взаємодія з металами, що розташовані у ряду активності металів перед Н2:
6Na + 2H3PO4 = 2Na3PO4 + 3H2
3) взаємодія з основними оксидами:
3CaO + 2H3PO4 → Ca3(PO4)2 ↓ + 3H2O
4) взаємодія з основами:
H3PO4 + 3KOH → K3PO4 + 3H2O
3Н+ + PO4³ˉ + 3K+ + 3OHˉ → 3K+ + PO4³ˉ + 3H2O
3Н+ + 3OHˉ → 3H2O
Н+ + OHˉ → H2O
Залежно від молярних співвідношень реагентів можливе утворення також кислих солей:
H3PO4 + KOH → KH2PO4 + H2O
3Н+ + PO4³ˉ + K+ + OHˉ → K+ + H2PO4ˉ + H2O
3Н+ + PO4³ˉ + OHˉ → H2PO4ˉ + H2O
H3PO4 + 2KOH → K2HPO4 + 2H2O
3Н+ + PO4³ˉ + 2K+ + 2OHˉ → 2K+ + HPO42ˉ + 2H2O
3Н+ + PO4³ˉ + 2OHˉ → HPO42ˉ + 2H2O
5) Взаємодія із солями:
2H3PO4 + 3Na2CO3 → 2Na3PO4 + 3CO2↑ + 3H2O
6H+ + 2PO43- + 6Na+ + 3CO32- → 6Na+ + 2PO43- + 3CO2↑ + 3H2O
6H+ + 3CO32- → 3CO2↑ + 3H2O
2H+ + CO32- → CO2↑ + H2O
Застосування ортофосфатної кислоти:
1) для добування фосфатних добрив;
2) у лакофарбовій промисловості;
3) у металургійній промисловості;
4) у харчовій промисловості;
5) для запобігання корозії металів.
Солі ортофосфатної кислоти
Як триосновна кислота ортофосфатна кислота утворює три ряди солей:
Дигідрогенортофосфати: NaH2PO4 натрій дигідрогенортофосфат
NH4H2PO4 амоній дигідрогенортофосфат
Ca(H2PO4)2 кальцій дигідрогенортофосфат
Гідрогенортофосфати: Na2HPO4 натрій гідрогенортофосфат
(NH4)2HPO4 амоній гідрогенортофосфат
CaHPO4 кальцій гідрогенортофосфат
Ортофосфати: Na3PO4 натрій ортофосфат
(NH4)3PO4 амоній ортофосфат
Са3(РО4)2 кальцій ортофосфат
Фізичні властивості ортофосфатів: тверді, кристалічні речовини. У воді розчиняються тільки ортофосфати натрію та калію.
Хімічні властивості: ортофосфати проявляють усі хімічні властивості солей (крім взаємодії з металами, адже натрій і калій не витісняються з розчинів солей)
1) Взаємодія з сильними кислотами:
Ca3(PO4)2 + 3H2SO4 → 3CaSO4 + 2 H3PO4
2) Взаємодія з лугами:
2Na3PO4 + 3Ba(OH)2 → Ba3(PO4)2 ↓ + 6 NaOH
6Na+ + 2PO43- + 3Ba2+ + 6 OH- → Ba3(PO4)2 ↓ + 6Na+ + 6 OH-
3Ba2+ + 2PO43- → Ba3(PO4)2 ↓
3) Взаємодія з солями:
K3PO4 + 3 AgNO3 → 3KNO3 + Ag3PO4 ↓
3K+ + PO43- + 3Ag+ + 3NO3- → 3K+ + 3NO3- + Ag3PO4 ↓
3Ag+ + PO43- → Ag3PO4 ↓
При взаємодії ортофосфатів з розчином аргентум нітрату AgNO3 утворюється жовтий осад аргентум ортофосфату Ag3PO4. Ця реакція використовується для виявлення ортофосфат-йонів у розчині (якісна реакція на ортофосфат-йон).
Застосування солей ортофосфатної кислоти: Солі ортофосфатної кислоти використовують як мінеральні добрива. Фосфор, так само як і азот, є важливим елементом для забезпечення росту і життєдіяльності рослин. Рослини витягають фосфор з ґрунту, тому його запаси необхідно поповнювати, періодично додаючи фосфатні добрива. Фосфатні добрива виготовляють з кальцій ортофосфату, що входить до складу природних фосфоритів і фтор апатитів. Найважливішими фосфорними добривами є:
Фосфоритне борошно – розмелений фосфорит Са3(РО4)2, нерозчинний у воді, засвоюється не всіма рослинами і тільки на кислих грунтах.
Простий суперфосфат – суміш Са(Н2РО4)2 і СаSO4
Подвійний суперфосфат - Са(Н2РО4)2
Преципітат – СаНРО4
Комплексні добрива(крім Фосфору містять Нітроген, Калій):
Амофоси – (NH4)2HPO4, NH4H2PO4
Амофоска – (NH4)3PO4 + KCl
Нітроамофоска – (NH4)2HPO4 + NH4NO3 + KCl.
Карбонатна кислота
Хімічна формула – Н2СО3
Структурна формула: 
Карбонатна кислота – нестійка сполука, що може існувати тільки у водному розчині.
Н2О + СО2 ↔ Н2СО3
Внаслідок нестійкості молекул карбонатної кислоти її не можливо виділити в чистому вигляді.
Хімічні властивості.
1) Електролітична дисоціація: Н2СО3 ↔ Н+ + НСО3– (1 стадія)
НСО3– ↔ Н+ + СО32–. (2 стадія)
Карбонатна кислота – слабкий електроліт. Внаслідок низької концентрації йонів Н+ її розчин змінює колір лакмусу не на червоний, а на рожевий.
2) Взаємодія з активними металами:
Mg + H2CO3 → MgCO3 + H2 ↑
3) Взаємодія з основними оксидами:
СаО + Н2СО3 → СаСО3 + Н2О
4) Взаємодія з лугами (утворює як середні солі, так і кислі):
2 NaOH + H2CO3 → Na2CO3 + 2 H2O
натрій карбонат
NaOH + H2CO3 → NaHCO3 + H2O
натрій гідрогенкарбонат
Карбонати та гідрогенкарбонати
Карбонатна кислота утворює два ряди солей: середні та кислі.
| Кислота | Кислотний залишок | Характер солі | Склад солі, назва | Приклад |
| Н2СО3 | − НСО3 | кисла | Me(HCO3)у гідрогенкарбонати | NaHCO3 – натрій гідрогенкабонат Ca(HCO3)2 – кальцій гідрогенкабонат |
| = СО3 | середня | Meх(CO3)у карбонати | Na2CO3 – натрій карбонат CaCO3 – кальцій карбонат |
Фізичні властивості: солі карбонатної кислоти – кристалічні речовини, сполуки стійкі, хоча сама кислота не стійка. Розчиняються у воді тільки карбонати лужних металів. Серед гідрогенкарбонатів більшість розчинна у воді.
Хімічні властивості: карбонати проявляють притаманні солям властивості:
1) Взаємодія з іншими солями:
К2СО3 + MgCl2 → 2 KCl + MgCO3 ↓
2 K+ + CO32- + Mg2+ + 2 Cl- → 2 K+ + 2 Cl- + MgCO3 ↓
Mg2+ + CO32- → MgCO3 ↓
2) Взаємодія з кислотами: під дією більш сильних кислот карбонати та гідрогенкарбонати виділяють вуглекислий газ:
Na2CO3 + 2 HNO3 → 2 NaNO3 + H2O + CO2 ↑
2 Na+ + CO32- + 2 H+ + 2 NO3- → 2 Na+ + 2 NO3- + H2O + CO2 ↑
2 H+ + CO32- → H2O + CO2 ↑
Взаємодія солей карбонатної кислоти з сильними кислотами – якісна реакція на аніони CO32- у розчині.
3) Взаємоперетворення карбонатів та гідроген карбонатів:
під дією вуглекислого газу та води карбонати перетворюються на гідрогенкарбонати:
Na2CO3 + H2O + CO2 → 2 NaHCO3
CaCO3 + H2O + CO2 → Ca(HCO3)2
Зворотний перехід від гідрогенкарбонатів до карбонатів відбувається під час нагрівання:
2 NaHCO3 → Na2CO3 + H2O + CO2
Ca(HCO3)2 → CaCO3 + H2O + CO2
4) Термічний розклад: стійкі до нагрівання лише карбонати лужних металів. Решта карбонатів розкладається при нагріванні:
СаСО3 → СаО + СО2 ↑
Застосування карбонатів та гідрогенкарбонатів:
Na2CO3 (кальцинова сода) – у виробництві скла, мила, паперу, у побуті як миючий засіб, у нафтовій промисловості.
CaCO3 – як будівельний матеріал і як вихідний продукт для добування вапна. Мелена крейда як наповнювач для ґумових сумішей, паперу, лінолеуму, зубного порошку. Мармур – для виготовлення скульптур, у будівництві.
MgCO3 – для добування MgO і чистого CO2, який використовується для виробництва штучних мінеральних вод.
K2CO3 (поташ) – виробництво мила, скла, як калійне добриво.
NaHCO3 (питна сода) – у кондитерській справі, для виготовлення штучних мінеральних вод, у вогнегасниках, у медицині, у фотосправі.
NH4HCO3 (амоніяк) – у кондитерській справі, для фарбування тканин, у медицині.
PbCO3 – для виготовлення свинцевого білила. Фарба дає міцне покриття, зокрема для кораблів, але дуже отруйна.
Cu2(OH)2CO3 (малахіт) – для виготовлення зелених фарб, ювелірних виробів, у піротехніці.
Силікатна кислота.
Молекулярна формула: H2SiO3
Структурна формула: 
Фізичні властивості: Силікатна кислота дуже слабка. Вона слабша навіть за карбонатну кислоту.
У воді H2SiO3 нерозчинна, але у подрібненому стані має властивість утворювати колоїдний розчин.
Добування: Силікатну кислоту можна одержати дією будь-якої кислоти на розчини силікату калію або натрію, наприклад:
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl
2Na+ + SiO32- + 2H+ + 2Cl- → 2Na+ + 2Cl- + H2SiO3↓
2H+ + SiO32- → H2SiO3↓
При цьому вона виділяється у вигляді білого драглистого осаду, який містить значну кількість води.
Хімічні властивості:
1) Взаємодія з лугами: силікатна кислота не змінює кольору індикаторів, не реагує з металами, але розчиняється в лугах, утворюючи солі (силікати):
2 NaOH + H2SiO3 → Na2SiO3 + 2 H2O
2Na+ + 2OH- + H2SiO3 → 2Na+ + SiO32- + 2 H2O
H2SiO3 + 2OH- → SiO32- + 2 H2O
Силікати – тверді, кристалічні, тугоплавкі, термічно стійкі речовини. Розчинними у воді є тільки силікати натрію та калію.
2) Термічний розклад: при нагріванні силікатна кислота поступово зневоднюється, а при прожарюванні повністю втрачає воду і перетворюється на силікатний ангідрид SiO2:
H2SiO3 → SiO2 + H2O
Застосування силікатної кислоти та силікатів:
1) Водний розчин натрій силікату використовують для просочування деревини та тканин, щоб надати їм вогнетривкості; для виготовлення цементних розчинів, мийних засобів, силікатного клею; водний розчин натрій та (або) калій силікату ще називають рідким склом.
2) Алюмосилікати застосовують як адсорбенти і у силікатній промисловості.
Силікатна промисловість. Будівельні матеріали.






