НЕ 1.1 Іонообміні процеси в технології водопідготовки
Елементи теорії іонного обміну.
Методи регенерації
Основні види і властивості іонітів.
Натрій-катіонування води.
Водневе-катіонування води.
Елементи теорії іонного обміну.
Існує ряд твердих речовин, які здатні обмінювати свої іони на іони розчинених у воді солей. Ці речовини називаються іонітами. Вони діляться на дві групи: катіоніти - обмінюють позитивно заряджені іони (катіони) і аніоніти - обмінюють негативно заряджені іони (аніони). Іоніти застосовуються для очищення води від розчинених солей. Іонний обмін заснований на фільтрації води через шар катіонітів, при якому проходить заміщення іонів кальцію та магнію на іони натрію, водню або амонію, що містяться в твердій фазі катіоніту (схема 1.1).
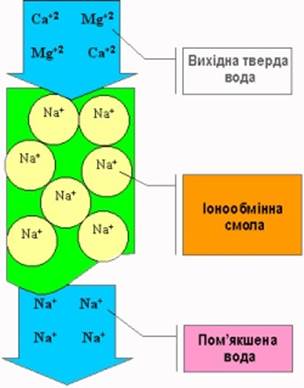
Схема 1.1 Іонний обмін з використанням натрій-катіонування
Молекула іоніту складається з твердої нерозчинної у воді частини - матриці і пов'язаних з матрицею функціональних груп, які у воді можуть дисоціювати (схема 1.2). У катіонітах функціональні групи дисоціюють з виходом в розчин простих позитивно заряджених іонів, які групуються навколо молекули і утворюють дифузійний шар. У аніонітах дифузійний шар утворюється з простих негативно заряджених іонів. Іони розчинених у воді солей можуть проникати в дифузійний шар.

Схема 1.2 Будова молекули іоніта
Нехай з функціональними групами [R] іоніту пов'язані прості обмінні іони А з валентністю ZА (Nа+1 А = Nа ZА = 1), а в розчині знаходяться іони В з валентністю ZB (Са+2 B = Са ZB = 2) якогось розчину води. Іони В починають сорбувати на поверхні функціональної групи R і витісняти в розчин обмінні іони А. Через якийсь час встановиться рівновага, що описується реакцією обміну
 (1.1)
(1.1)
Nа+ [КАТ] + Са+2 → Са+2[КАТ] + 2Nа+ (1.2)
2 Na+ [Кат.] + Ca (HCO3)2 → Ca+2 [Кат.] + 2 NаHCO3 (1.3)
 (1.4)
(1.4)
Величина KAB носить назву константи обміну, а формула (1.4) є математичним вираженням закону Нікольського, що описує рівновагу в системі іоніт-розчин в статичних умовах.
Щоб зрозуміти сенс константи обміну уявімо, що в (1.4) валентності іонів А і В рівні 1, тобто ZА=ZB=1. Тоді очевидно, що константа обміну показує в скільки разів співвідношення концентрації іонів А і В на поверхні іоніту більше, ніж співвідношення концентрацій цих іонів в розчині. Чим вище значення константи обміну KAB, тим краще витягається іонітом з розчину іон В. Константи обміну визначаються, як правило, експериментально. Чим вище заряд і менше радіус іона, тим вище константа обміну.
Розташовуючи іони по спадаючих значеннях констант обміну отримують ліотропний ряд. Для різних видів іонітів він різний. Для катіонітів ряд зазвичай має вигляд
Fe2+>Al3+>Ca2+>Mg2+>NH4+>Na+>H+>Li+
Для аніонітів
S042->N03->H2P04->Cr->HC03->HSi03->ОН-
Іони, що знаходяться лівіше сорбуються іонітом сильніше і здатні при однакових концентраціях витісняти з поверхні іоніту усі іони, що знаходяться від них правіше.
Основною характеристикою іонітів є обмінний об’єм. Розрізняють повний і робочий обмінний об’єм іоніта. Повний обмінний об’єм (N0) - ця кількість іонів солей, які можуть бути захоплені іонітом при повній заміні усіх обмінних іонів.
Використання повної обмінної місткості практично не можливе. Повний обмінний об’єм вимірюється в г-екв на 1м3 іоніту, або в г-екв на 1кг (1т) іоніту.
Робочий обмінний об’єм - це частина повної обмінної місткості, яку практично проявляє іоніт в робочих умовах. Вона залежить від ряду чинників: виду уловлюваних іонів, складу і рН води, виду іоніту і так далі.
Обмін іонів іонітом не може йти нескінченно, в якийсь момент часу обмінні іони виснажуються і процес припиняється. Потрібне відновлення обмінної місткості іоніту - регенерація. При відновленні обмінної місткості іоніт повинен знаходитися в розчині з високою концентрацією обмінних іонів (регенераційному розчині).
 | |||
 | |||
Рис. 1.3 Зміна концентрацій обмінюваних іонів іоніту протягом часу
На рис. 1.3 приведена зміна концентрацій обмінюваних іонів в шарі іоніту впродовж усього періоду роботи фільтру. У початковий момент часу обмін йде у верхньому шарі іоніту (фронт концентрації уловлюваного іона В при t=to) шар, в якому йде обмін іонів носить назву захисного шару. Шари, що пролягають нижче, в обміні іонів практично не беруть участь. Через якийсь час обмінний об’єм верхнього шару вичерпується, обмін іонів в нім припиняється і починає працювати шар, що пролягає нижче. Захисний шар зрушується вниз і фронт концентрації переходить в позицію при t=t1. При подальшій роботі фільтру фронт зрушується все нижче і коли він досягає дна фільтру - починається проскакування затримуваного іона у фільтрат (рис. 1.3) і досягає допустимої величини Сдоп. Період роботи фільтру протягом якого концентрація затримуваних іонів у фільтрі залишається менше за допустиму, називається часом захисної дії фільтру tзах. Подальший обмін іонів недоцільний, необхідно проводити регенерацію іоніту.






