Лекция 2, 3
Строение атома. Корпускулярно-волновой дуализм. Принцип неопределенности. Волновое управление. Квантово-механическая модель атома. Квантовые числа. Взаимосвязь квантовых чисел. Емкость уровня и подуровня. Правила заполнения электронами атомных орбиталей. Правило Клечковского. Принцип Паули. Правило Хунда. Периодическая система Д.И. Менделеева и электронная структура атомов. Периодические свойства элементов: радиус атома, энергия ионизации, сродство к электрону, электроотрицательность.
В 20-х годах ХХ века был создан новый раздел физики – квантовая, или волновая механика.
Квантовая механика – система понятий и уравнений, которые применяются для описания элементарных частиц, ядер, атомов, молекул.
Составными частями квантовой механики являются: 1) корпускулярно-волновой дуализм; 2) принцип неопределенности; 3) волновое управление.
2.1. Корпускулярно-волновой дуализм
В 1924 г. французский физик Луи де Бройль высказал предположение: «Любая движущаяся частица одновременно обладает и механическими и волновыми свойствами». Эта зависимость выражается уравнением:
 ,
,
где l – длина волны;
h – постоянная Планка, 6,6·10 -34 Дж·с;
m – масса частицы (электрона);
ν – скорость частицы.
Предположение де Бройля подтвердилось экспериментально на явлении дифракции электронов и нашло применение в электронных микроскопах.
2.2. Принцип неопределенности
В 1925 г. немецкий физик В. Гейзенберг высказал положение: «Для микрочастицы атомного масштаба невозможно одновременно и точно указать координату и скорость ее движения». Математическое выражение этого положения:
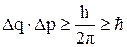 ,
,
где ∆q – неопределенность координат, или положения в пространстве;
∆p – неопределенность импульса, p = m·v, где m – масса, V – скорость;
h – постоянная Планка,
ћ – приведенная постоянная Планка.
Принцип неопределенности можно проиллюстрировать на примере маятника. Чтобы зафиксировать положение маятника его нужно остановить. Однако, остановив маятник, ничего нельзя сказать об амплитуде и частоте его колебаний. Для этого необходимо, чтобы маятник двигался. Но тогда его координата (местоположение) становится полностью неопределенной по всей амплитуде его колебания.
Из принципа неопределенности следует два вывода: 1) невозможно точно представить траекторию движения электрона в атоме; 2) электрон в атоме нельзя рассматривать с математической точностью. Можно лишь вычислить вероятность пребывания электрона в околоядерном пространстве.
2.3. Волновое уравнение
В 1926 г. австрийский ученый Э. Шредингер предложил уравнение с помощью которого вычисляют вероятность нахождения электрона в атоме:

 сумма вторых производных волновой функции Y (пси) по координатам x, y, z;
сумма вторых производных волновой функции Y (пси) по координатам x, y, z;
x, y, z – координаты трехмерного пространства, определяющие положение электрона в атоме при условии, что ядро атома находится в начале координат;
m – масса электрона;
h – постоянная Планка;
E – полная энергия электрона;
U – потенциальная энергия электрона, представляющая собой энергию электростатического взаимодействия электрона с ядром и зависящая от расстояния электрона от ядра, т.е. координат x, y, z;
Y – функция координат x, y, z, которая называется волновой функцией (орбиталью) и является основной характеристикой электрона в атоме. Кроме, того Y = f (n, ℓ, m), где n – главное квантовое число, ℓ - орбитальное (побочное) квантовое число, m – магнитное квантовое число.
Решить волновое уравнение – значит найти Y. Волновая функция Y - это амплитуда трехмерной электронной волны, т.е. является амплитудой вероятности присутствия данного электрона в определенной области пространства. Другими словами колеблется не сам электрон, а вероятность его обнаружения в той или иной точке пространства. Произведение Y 2·∆v – вероятность нахождения электрона в электронном объеме пространства ∆v.
Y 2 – плотность вероятности или электронная плотность.
2.4. Квантово-механическая модель атома
Квантово-механическая модель атома – это воображаемый вид атома, созданный на основе положений квантовой механики. Изобразить электронную плотность в околоядерном пространстве можно с помощью рисунков и графиков. Решая уравнение Шредингера и подставляя неоднократно значение различных переменных, получим изображение электронного облака:

Рис. Способы изображения распределения электронной плотности в атоме водорода: графики зависимости ψ – r(a), ψ2dv – r(б), электронное облако (в), орбиталь (2)
Электронная облако – это околоядерное пространство, в котором вероятность пребывания электрона максимальна.
Орбиталь – фигура, образованная движением электрона и составляющая примерно 95% электронного облака.
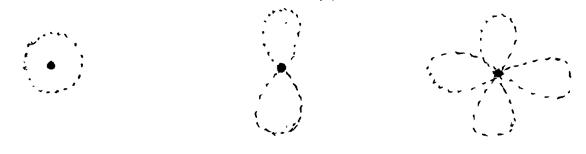
Возможны различные формы орбиталей:
s-, р-, d- и f-

Формы s-, p-, d- орбиталей
2.5. Квантовые числа
Нахождение электрона в атоме характеризуется четырьмя квантовыми числами; n – главное, ℓ - орбитальное, m – магнитное, s – спиновое. Все эти числа характеризуют определенную энергию электрона. Кроме этого n определяет размер электронного облака и принимает значение [1; ¥). Электроны с одинаковым значением n образуют уровень в атоме.
 n = 1 n = 2 n = 3
n = 1 n = 2 n = 3
| Чем больше n, тем выше энергия. Уровни имеют буквенные обозначения:
min max |
ℓ определяет форму электронного облака, принимает значения в зависимости от n [0; n-1]. Электроны с одинаковым значением ℓ образуют подуровень.
|
|
|
m определяет ориентацию электронного облака, принимает значения в зависимости от ℓ [-ℓ; 0; +ℓ].
Состояние электрона в атоме определяемое значением n, ℓ, m называется атомной орбиталью (АО). Обозначается или сокращено –.
S определяет внутреннее движение электрона, независящее от n, ℓ, m; принимает значения  :
:

Рис. Спин-орбитальное взаимодействие у электронов, находящихся на одной орбитали и отличающихся направлением спинов
2.6. Взаимосвязь квантовых чисел. Емкость уровня и подуровня
Это положение отразим в виде таблицы:
| n число уровней | ℓ | Буква | m | Число п/у = n | Число АО = = (2ℓ+1) | Емкость п/у = = 2(2ℓ+1) | Емкость уровня 2n2 |
| S | |||||||
| S p | -1, 0, +1 | ||||||
| S p d | -1, 0, +1 -2, -1, 0, +1, +2 | ||||||
| S p d f | -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 |
2.7. Правила заполнения электронами атомных орбиталей (АО)
1) Принцип минимальной энергии. Его предложил В. Клечковский: «АО заполняются электронами в порядке повышения энергии (Е) их уровней. Или при переходе от одного элемента к другому электроны размещаются последовательно на орбиталях, расположенных в порядке возрастания суммы главного и орбитального квантовых чисел (n+ℓ). При одинаковых энергиях этой суммы первой заполняется орбиталь с меньшим значением главного квантового числа». Например,
для 3d подуровня (n+ℓ) = 3+2 = 5 и
для 4р подуровня (n+ℓ) = 4+1 = 5.
E3d < E4p, так как главные квантовые числа 3d = 3; 4р = 4, то первым заполняет подуровень 3d.
Согласно принципу минимальной энергии имеем такой порядок заполнения АО:

Рассмотрим заполнение электронами атома Ag.
Ag находится в V периоде, в I B подгруппе.
47

Мы записали электрнно-структурную формулу (конфигурацию) атома Ag.
47 Ag 1S22S22p63S23p63d104S24p64d95S2 – это запись электронной формулы атома Ag.
2) Принцип В. Паули: «В атоме не может быть даже двух электронов, у которых все четыре квантовых числа одинаковы».
Следствие: «В одной АО может максимально находиться только два электрона с противоположными спинами».
3) Правило Ф. Хунда: «Суммарный спин электрона в подуровне должен быть максимальным, т.е. АО подуровня сначала заполняются по одному электрону, а затем спариваются».
Задача: Как разместить 3 электрона на р-подуровне?
 |  |

 |

 | |||||
 |  | ||||

 Запрещено
Запрещено 
 Разрешено
Разрешено 

2.8. Периодическая система Д.И. Менделеева
и электронная структура атомов
В 1869 г. Д.И. Менделеев сообщил об открытии периодического закона, современная формулировка которого такова:
«Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядер их атомов».
Физический смысл периодического закона: повторение свойств элементов связано с повторением электронного строения внешнего энергетического уровня.
Нагрядным выражением периодического закона служит периодическая система Д.И. Менделеева.
Рассмотрим связь между положением элемента в периодической системе и электронным строением его атомов.
Первый период состоит из двух элементов: Н и Не.
Атом гелия заканчивает формирование К-оболочки атома, обозначим ее [K] или [He]. Электрон, который последним заполняет орбиталь атома, называется формирующим и элемент относится к группе, называемой по формирующему электрону. Оба элемента имеют формирующие s-электроны и соответственно называются s-элементами.
У элементов второго периода формируется L-оболочка, заполняются s- и р- подоболочки (подуровни). Формирующими электронами у первых двух элементов являются s-электроны, поэтому Li и Be относятся к s-элементам. Остальные шесть элементов этого периода входят в число р- элементов, т.к. формирование их орбиталей заканчивается р- электроном. У элемента Ne полностью заполняется 2р подоболочка, обозначается она как [Ne].
Третий период начинается с атома Na, электронная конфигурация которого 1S22S22p63S1 и заканчивается аргоном Ar с электронной конфигурацией 1S22S22p63S23p6, обозначаемой [Ar]. Подоболочка 3d остается незаполненной.
В четвертом периоде начинается формирование N-уровня (n=4) и период начинается с s-элемента калия [Ar] 4S1. Это обусловлено тем, что энергия подуровня 4S несколько ниже, чем энергия 3d. После заполнения 4S заполняется 3d-подоболочка. Элементы от Sc до Zn, имеющие формирующие d-электроны, относятся к d-элементами. У атома Сr более устойчивой является конфигурация 3d54S1, чем 3d44S2. Такое явление получило название «провала» электрона. Провал электронов имеется также у атомов Cu, Nb, Mo, Pt, Pd. Четвертый период завершается формированием 4р подоболочки криптона Kr и обозначается [Ar] 3d104S24p6 или [Kr]. В этом периоде находится 18 элементов.
Пятый период аналогичен 4-ому и заканчивается р-элементом Хе; обозначается [Kr] 4d105S25p6 или [Хе].
В шестом периоде, как и в пятом, после завершения s-подоболочки начинается формирование d-подоболочки предвнешнего уровня у лантана La. Однако, у следующего элемента энергетически выгоднее формирование 4f-подоболочки по сравнению с 5d-подоболочкой. Поэтому после La следует 14 лантаноидов с формирующим f-электронами, т.е. f-элементов от церия Ce [Xe] 4f145d16S2 и до лютеция Lu [Хе] 4f145d16S2. Затем продолжается заполнение оставшихся орбиталей в 5d-подоболочке и 6р-подоболочке. Период завершает радон Rn [Xe] 4f145d106S26р6, или [Rn]. Таким образом, период имеет 32 элемента.
Седьмой период начинается и продолжается аналогично шестому периоду. Однако формирование его еще незавершено.
В настоящее время известно 112 элементов.
2.9. Периодические свойства элементов
Поскольку электронное строение атомов изменяется периодически, соответственно периодически изменяются и свойства элементов: атомный радиус, энергия ионизации, средство к электрону, электроотрицательность (ЭО).
Радиус атома (ra) это теоретически рассчитанное расстояние от ядра до наиболее удаленного от него электрона (орбитальный радиус) или половина расстояния между центрами двух смежных атомов в кристалле (эффективный радиус).
Энергия ионизации (Еu) – это энергия, необходимая для отрыва электрона от невозбужденного атома.
Сродство к электрону (Е  ) – это энергия, поглощаемая или выделяемая при присоединении электрона к частице (атому, иону, молекуле).
) – это энергия, поглощаемая или выделяемая при присоединении электрона к частице (атому, иону, молекуле).
Электроотрицательность – (ЭО) – это способность атома в ковалентной молекуле смещать к себе электроны химической связи).
Мера ЭО равна сумме Еu и Е  .
.
Л. Полинг (американский ученый) предложил относительную шкалу ЭО, приняв ЭО Li за единицу:

Рис. Шкала электроотрицательности по Полингу
Общий характер изменения периодических свойств в периодической системе можно представить схемой:

*Для элементов IIIA-VA групп Е  увеличивается!
увеличивается!
Д.з. Г., с.47-54; 57-100;
К., с. 17-31.






