Содержание
Введение
1. Фазы и структурные составляющие
2. Линии, точки, концентрации, температуры
3. Анализ фазовых превращений при охлаждении стали и чугуна
Библиографический список
Введение
Впервые на существование в стали критических точек и зависимость их положения от содержания углерода указал Д.К. Чернов, т.е. он дал первое представление о диаграмме состояния Fe–C. Впоследствии свои выводы о влиянии углерода на положение критических точек Чернов изобразил графически, воспроизводя очертания важнейших линий диаграммы Fe–C. Он определил положение точек на глаз, по цветам побежалости (каления) и назвал их точкой а (темно-вишневое каление) и точкой b (красное неблестящее каление). Точка а, по определению Чернова, соответствовала температуре, при нагреве ниже которой сталь не принимала закалку, как бы быстро ее не охлаждали. Точка b обозначает температуру, при нагреве ниже которой структура стали не изменяется. Температура, соответствующая точке b, изменяется в зависимости от содержания углерода в стали, понижаясь с его увеличением.
Французский ученый Ф. Осмонд, развивая дальше работу Чернова, установил в 1885 г. при помощи термоэлектрического пирометра точные числовые значения точек а и b. В соответствии с введенными Осмондом обозначениями тока а обозначается Ас1, а точка b – А3.
Первая диаграмма Fe–C в координатах температура – химический состав была опубликована в 1879 г. немецким ученым Р. Маннесманом и имела только историческое значение.
Первые попытки построения полной диаграммы были предприняты Р. Аустеном в 1897–1899 гг. Диаграмма Аустена имела много неточностей, но ее принципиальная схема, истолкование явлений, соответствующих большинству линий, и большая часть буквенных обозначений сохранились до наших дней.
В последующие годы в связи с более тщательным изучением сталей и чугунов в построение диаграммы вносили уточнения. В 1929 г. Союз немецких металлургов принял уточненную диаграмму Fe – C, разработанную К. Давесом. Это была принципиально законченная и удовлетворительная, с точки зрения практики графическая карта соотношений между железом и углеродом в состоянии равновесия. Таким образом, диаграмма состояния железоуглеродистых сплавов – результат многолетних и многочисленных исследований.
Фазы и структурные составляющие
Сплавы железо – углерод в зависимости от концентрации углерода и температуры состоят из нескольких фаз и структурных составляющих, что объясняется его аллотропией и способностью железа образовывать с углеродом химическое соединение.
Жидкость – жидкий раствор углерода в железе – фаза, имеющая ближний порядок с преобладанием металлической связи. Строение раствора зависит от концентрации углерода. При малых его содержаниях (до 0,2% по массе) первая координационная сфера соответствует размытой решетке о. ц. к. В интервале 0,2–0,6%С наблюдается переход к размытой г. ц. к. упаковке. При содержании углерода более 2% в жидком растворе появляются микрогруппировки атомов углерода, величина которых составляет 10-9–10-8 м. Тенденция к микроразделению компонентов – общая черта сплавов эвтектического типа. Кроме того, ионы углерода разрыхляют структуру жидкого раствора – вязкость и поверхностное натяжение снижаются, по мере увеличения концентрации углерода.
Графит – свободно выделившийся углерод, наблюдаемый в сплавах с содержанием углерода более 2,14%. Кристаллическая решетка графита гексагональная. Он имеет слоистое строение и обладает низкой твердостью, высокой электропроводимостью и теплопроводностью, способностью гасить вибрации.
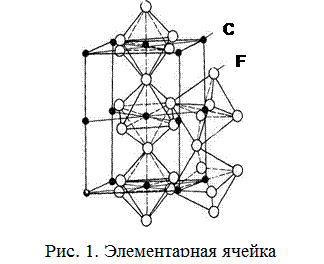
Цементит – это химическое соединение железа с углеродом со сложной ромбической кристаллической решеткой, содержит 6,67%С (по массе). В его элементарную решетку входят 12 атомов железа и 4 атома углерода. Упаковка атомов железа в цементите (субрешетка железа) имеет ромбическую симметрию. В субрешетке имеются октаэдрические и призматические поры. Один из вариантов изображения элементарной ячейки цементита приведен на рисунке 1.
Твердость цементита очень высока (1000 HV, 70 НRC, 800 НВ), но он хрупкий. Температура плавления цементита зависит от его состава (в состав цементита могут входить тугоплавкие элементы – хром, молибден и др.) и находится в широких пределах 1250–1600°С.
Магнитные свойства цементит теряет при температурах выше 210 С. Уместно подчеркнуть сходство в строении цементита и графита: в обеих фазах атомы внутри слоя ковалентно связаны, а между слоями существуют ненаправленные связи. Это сходство подтверждается обликом и слоистой структурой этих фаз, растущих в железоуглеродистых расплавах в виде плоских дендритов. Цементит, как и графит, обладает металлической проводимостью, обеспечиваемой коллективизацией электронов между слоями. Будучи метастабильной фазой, цементит может распадаться на феррит и графит или на аустенит и графит.
Феррит – твердый раствор внедрения углерода в a-железо с максимальным содержанием углерода 0,02% при 727°С и 0,006% при нормальной температуре. Феррит магнитен до температуры 768 °С. По своим свойствам феррит достаточно мягок и пластичен (НВ 65–130; 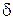 = 30%;
= 30%; 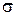 в = 300 МПа). Твердый раствор внедрения углерода в
в = 300 МПа). Твердый раствор внедрения углерода в 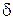 -железо называется высокотемпературным ферритом. Он существует в диапазоне температур 1392–1539°С.
-железо называется высокотемпературным ферритом. Он существует в диапазоне температур 1392–1539°С.
Аустенит – твердый раствор внедрения углерода в  -железо с максимальным содержанием углерода 2,14% при 1147°С и 0,8 % при 727°С. Аустенит немагнитен. При температуре ниже 727 °С аустенит или превращается в феррит при низком содержании углерода, или распадается на цементит и феррит, образуя перлит, при высоких содержаниях углерода. Аустенит пластичен, твердость его НВ 160–200,
-железо с максимальным содержанием углерода 2,14% при 1147°С и 0,8 % при 727°С. Аустенит немагнитен. При температуре ниже 727 °С аустенит или превращается в феррит при низком содержании углерода, или распадается на цементит и феррит, образуя перлит, при высоких содержаниях углерода. Аустенит пластичен, твердость его НВ 160–200, 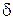 = 40–50%.
= 40–50%.
Микроструктуры феррита и аустенита приведены рисунке 2.

Рис. 2. Микроструктуры (а)феррита и (б) аустента, × 400
Перлит – это эвтектоид, состоящий из двух фаз – феррита и цементита (рис. 3). Образуется перлит при температуре ниже 727°С в результате разложения аустенита на феррит и цементит. Содержание углерода в нем 0,8 %.

Рис. 3. Микроструктура перлита, × 1000
Ледебурит – это эвтектика, состоящая из аустенита и цементита, образующаяся при концентрации углерода 4,3% в диапазоне температур 1147–727°С. При температурах ниже 727°С аустенит превращается в перлит, и ледебурит состоит из смеси перлита и цементита.
Следует обратить внимание на то, что твердые растворы на основе  - и
- и 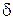 -железа с решеткой типа ОЦК резко отличаются по предельному содержанию углерода в сравнении с раствором на основе
-железа с решеткой типа ОЦК резко отличаются по предельному содержанию углерода в сравнении с раствором на основе  -железа с гранецентрированной кубической решеткой. Такая резкая разница в способности растворять углерод объясняется тем, что в гранецентрированной кубической решетке, несмотря на более плотную упаковку атомов, имеются большие незаполненные области в центрах элементарных ячеек. Именно в этих местах и размещаются атомы углерода, которые несколько деформируют кристаллическую решетку и вызывают увеличение линейных размеров элементарной ячейки. При определенной концентрации углерода в твердом растворе его атомы вызывают настолько большие искажения в решетке, что она делается неустойчивой, и появляется другая фаза – карбид. В железе с объемно-центрированной кубической решеткой атомы углерода размещаются в центрах граней элементарной ячейки; т.к. в этих местах промежутки между атомами железа значительно меньше, то предельные искажения решетки наступают при существенно меньших содержаниях углерода. Кроме того, атомы углерода могут располагаться в местах точечных дефектов кристаллической решетки – «вакансиях».
-железа с гранецентрированной кубической решеткой. Такая резкая разница в способности растворять углерод объясняется тем, что в гранецентрированной кубической решетке, несмотря на более плотную упаковку атомов, имеются большие незаполненные области в центрах элементарных ячеек. Именно в этих местах и размещаются атомы углерода, которые несколько деформируют кристаллическую решетку и вызывают увеличение линейных размеров элементарной ячейки. При определенной концентрации углерода в твердом растворе его атомы вызывают настолько большие искажения в решетке, что она делается неустойчивой, и появляется другая фаза – карбид. В железе с объемно-центрированной кубической решеткой атомы углерода размещаются в центрах граней элементарной ячейки; т.к. в этих местах промежутки между атомами железа значительно меньше, то предельные искажения решетки наступают при существенно меньших содержаниях углерода. Кроме того, атомы углерода могут располагаться в местах точечных дефектов кристаллической решетки – «вакансиях».






