2 F е3+ + 2 I – = 2 F е2+ + I 2
Налить в колбу с притертой пробкой 50 мл 0,03 М раствора FeСl3 и добавить к нему такой же объем 0,03 М раствора KI, колбу закрыть пробкой. Момент сливания растворов отметить по часам. Приготовить 4 конические колбы для титрования на 100 мл, в каждую влить около 50 мл дистиллированной воды.
Через 20 минут от момента смешивания из колбы отобрать 10 мл раствора и влить в колбу для титрования. Выделившийся иод оттитровать 0,015 М раствором Na2S2O3. Раствор тиосульфата прибавлять до образования бледно-желтой окраски. Затем добавить несколько капель раствора крахмала и титровать раствором тиосульфата до исчезновения синего окрашивания. Пипетку перед отбором пробы сполоснуть дистиллированной водой и исследуемым раствором.
Через 20 минут после отбора пробы из колбы взять снова 10 мл раствора и оттитровать тиосульфатом. Затем еще через 20 минут отобрать 3-ю пробу и т.д.
Одинаковое количество миллилитров раствора тиосульфата, израсходованное на титрование иода в 2-х последних пробах, указывает на достижение равновесия.
Расчет равновесных концентраций
1. Концентрация иода в состоянии равновесия равна:
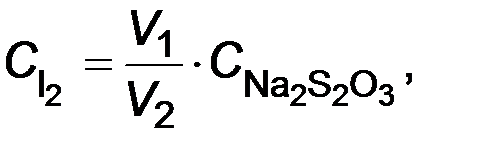
где V 1 - количество тиосульфата, израсходованного на титрование иода, мл; V 2 - объем взятой пробы, мл.
2. Концентрация ионов Fe2+ равна 2 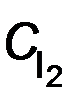 .
.
Концентрация ионов Fe3+ равна разности начальной концентрации FeCl3 и равновесной концентрации Fe2+:
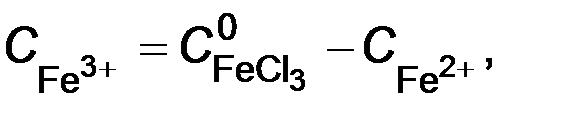
где 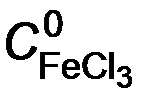 = 0,015 М.
= 0,015 М.
4. Концентрация иодид-ионов равна:
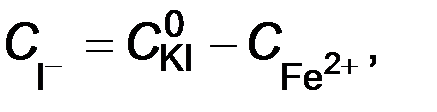
где 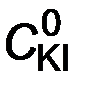 = 0,015 М.
= 0,015 М.
Таблица
Результаты изучения химического равновесия реакции
| № пробы | Время отбора пробы, мин. | Количество израсходованного Na2S2O3 | Реагирующее вещество | Равновесная концентрация |
Рассчитать концентрационную константу равновесия.
Контрольные вопросы
1. Что такое химическое равновесие? Сформулируйте основные условия химического равновесия.
2. Что такое константа равновесия? Как она определяется?
3. Сформулируйте принцип смещения химического равновесия. Приведите примеры.
4. Как сместить равновесие вправо для следующих реакций:
а) N2 + 3Н2↔ 2NН3, D Н < 0;
б) Н2 + I2 ↔ 2НI, D Н < 0;
в) 3О2 ↔ 2О3, D Н > 0;
г) Zn2+ + Н2S ↔ ZnS + 2Н+;
д) СаСО3 ↔ СаО + СО2, D Н > 0.
ПРИЛОЖЕНИЕ
Плотности водных растворов важнейших кислот и щелочей (г/мл)
| H2SO4 | HNO3 | HCl | NaOH | KOH | NH3 | |
| 5 | 1,033 | 1,026 | 1,023 | 1,052 | 1,044 | 0,977 |
| 10 | 1,067 | 1,054 | 1,043 | 1,110 | 1,090 | 0,958 |
| 15 | 1,102 | 1,084 | 1,073 | 1,162 | 1,138 | 0,940 |
| 20 | 1,140 | 1,115 | 1,098 | 1,220 | 1,187 | 0,923 |
| 25 | 1,178 | 1,147 | 1,124 | 1,272 | 1,236 | 0,907 |
| 30 | 1,219 | 1,180 | 1,149 | 1,329 | 1,288 | 0,892 |
| 35 | 1,260 | 1,215 | 1,174 | 1,380 | 1,341 | 0,880 |
| 40 | 1,303 | 1,246 | 1,198 | 1,430 | 1,394 | |
| 45 | 1,348 | 1,278 | 1,478 | 1,452 | ||
| 50 | 1,395 | 1,310 | 1,510 | |||
| 55 | 1,445 | 1,339 | ||||
| 60 | 1,498 | 1,366 | ||||
| 65 | 1,553 | 1,392 | ||||
| 70 | 1,610 | 1,414 | ||||
| 80 | 1,727 | 1,452 | ||||
| 90 | 1,815 | 1,482 | ||||
| 100 | 1,831 | 1,513 |
Хритохин Николай Александрович
Шиблева Татьяна Григорьевна
Можаев Георгий Михайлович
Кертман Александр Витальевич
Неорганическая химия. Часть I.
Учебно-методический комплекс. Методические указания для студентов
I курса направления 020100.62 «Химия».
Подписано в печать __________
Формат 60×84/16. Объем ____ п.л.
Тираж _____ экз. Заказ № ______
_____________________________________________________________
Издательство Тюменского государственного университета
625003, г. Тюмень, ул. Семакова, 10






