В химических реакциях происходит не только изменение химического состава, но и одновременно изменение запаса химической энергии системы. Если вещества, образующиеся при реакции, обладают меньшим запасом энергии, чем вещества, вступившие в реакцию, то в результате выделяется энергия (наиболее часто в вице тепловой энергии). Такие реакции называются экзотермическими. Если вещества, образующиеся при реакции, обладают большим запасом химической энергии, чем исходные вещества, то для протекания этой реакции необходимо затратить энергию. Такие реакции называются эндотермическими.
Принято считать тепловым эффектом реакции ту теплоту, которая поглощается или выделяется при условиях, когда:
- объем или давление постоянны;
- постоянна температура;
- не совершается никакой работы, кроме работы против сил внешнего давления (работа расширения-сжатия).
Тепловой эффект, измеренный при постоянном объеме, называется изохорным (Qv), а при постоянном давлении – изобарным (Qp):

где А - работа расширения, равная произведению давления на изменение объема:

Уравнение химической реакции, записанное с указанием агрегатного состояния веществ и величины теплового эффекта, называется термохимическим.
Например: СаСО3 (к) = СаО (к) + СО2 (г); Qv = 144,5 кДж/моль,
где к - кристаллическое вещество; г - газ.
Эта запись показывает, что при разложении 1 моль карбоната кальция поглощается 144,5 кДж теплоты.
При выделении теплоты в изохорных условиях происходит уменьшение внутренней энергии системы D U < 0.
Изохорный тепловой эффект равен изменению D U. Иначе можно записать:  . Изобарный тепловой эффект можно выразить следующим образом:
. Изобарный тепловой эффект можно выразить следующим образом: 
Сумму  называют изменением энтальпии и обозначают D Н; т.е.:
называют изменением энтальпии и обозначают D Н; т.е.: 
В настоящее время принята запись термохимических уравнений, в которых указывается изменение энергетического состояния системы (D U или D Н).
Для приведенного выше примера следует записать:
СаСО3 (к) = СаО (к) + СО2 (г); D U = 144,5 кДж/моль.
Чаще всего химические эксперименты, химические превращения в природе и технологические процессы идут при постоянном давлении, поэтому наиболее широко используются значения изменения энтальпии, которые приводятся в термодинамических таблицах и справочниках. Обычно справочные данные относят к стандартным условиям, Р = 1 атм (или 1,013·105 Па) и Т = 298 К. Изменение энтальпии системы, или энтальпия процесса, для таких условий записывается как  .
.
В соответствии с основным законом термохимии (закон Гесса, 1840 г.) изменение энтальпии системы зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути превращения. Из закона Гесса следует, что энтальпия реакции равна разности сумм энтальпий образования продуктов реакции и энтальпий образования исходных веществ, с учетом стехиометрических коэффициентов:

Энтальпией образования называется изменение энтальпии в реакции образования 1 моль химического соединения из простых веществ, устойчивых при данных условиях. Для стандартных условий энтальпии образования приводятся в справочниках.
Пример расчета
Вычислить изменение энтальпии системы в реакции горения ацетилена, если известно, что компоненты системы имеют следующие значения теплот (энтальпий) образования: D f H о(С2Н2) = 226,80 кДж/моль; D f H о(СО2) = -393,62 кДж/моль; D f H о(Н2О)(г) = -241,88 кДж/моль.
Составим уравнение реакции:
(С2Н2)(г) +2,5О2 (г) = 2СО2 (г) + Н2О (г); D Н
D Н = 2D f H о(СО2) + D f H о(Н2О)(г) - D f H о(С2Н2).
D Н = 2∙(-393,62) + (-241,88) - 226,80 = -1255,92 кДж/моль.
 Экспериментально энтальпии процессов определяют в специальных приборах – калориметрах, простейший из которых иллюстрируется в данном лабораторном практикуме (рис. 2). Он состоит из двух сосудов, вставленных один в другой. Воздушная прослойка между сосудами обеспечивает теплоизоляцию внутреннего сосуда, в котором протекает процесс.
Экспериментально энтальпии процессов определяют в специальных приборах – калориметрах, простейший из которых иллюстрируется в данном лабораторном практикуме (рис. 2). Он состоит из двух сосудов, вставленных один в другой. Воздушная прослойка между сосудами обеспечивает теплоизоляцию внутреннего сосуда, в котором протекает процесс.
Внутренний сосуд закрывается пробкой с тремя отверстиями: в первое из них вставлен термометр с ценой деления не более 0,1°; во второе – проволочная мешалка, третье предназначено для внесения веществ. Основной величиной, от которой зависит точность термохимических измерений, является изменение температуры калориметра, поэтому определение этой величины должно быть произведено с максимальной точностью. Обычно, это делается следующим образом.
Во внутренний сосуд калориметра наливается определенное количество калориметрической жидкости (например, воды) и за 8-10 мин. до начала исследуемого процесса (например, растворения) начинают наблюдать за температурой жидкости, непрерывно ее перемешивая. Отсчеты производят через каждую минуту и записывают в виде таблицы:
| Время от начала опыта t, мин. | 1 | 2 | 3 | и т. д. |
| Температура Т, °С |
Время в таблице сквозное, без обнуления, вплоть до завершения эксперимента. Перемешивание периодическое, в течение всего эксперимента.
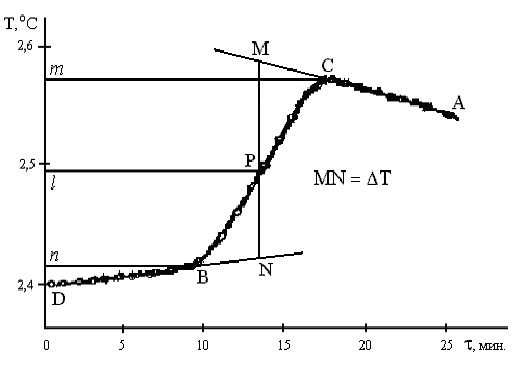
| Рис. 3. Изменение температуры во времени |
Затем в калориметр вводят второй компонент (например, соль). При этом температура резко изменяется (это главный период исследования), а затем происходит более медленное изменение, которое также фиксируют в течение 10 мин. Результаты измерений изображают в виде графика (рис. 3, экзотермический процесс).
Для определения изменения температуры D Т точки В и С проецируют на ось ординат (m, n), находят середину отрезка mn и проводят линию lp. Через точку р проводят вертикаль и экстраполируют линейные участки АС и ВD (тонкие линии) до пересечения с вертикалью МN в точках М и N. Отрезок соответствует изменению температуры в калориметрическом опыте D Т с учетом поправки на теплообмен. Для эндотермического процесса положение кривой на графике меняется, т.к. температура в процессе уменьшается.
Количество теплоты, выделившееся или поглощенное в калориметре, определяется по формуле:

где Σ m i Ci - тепловое значение калориметра – сумма произведений удельных теплоемкостей на массы веществ, составляющих калориметр.
Для простейшего калориметра

где C 1 и m 1 - удельная теплоемкость и масса сосуда;
C 2 и m 2 - то же для раствора в сосуде.
Теплоемкость раствора принять равной теплоемкости воды 4,184 Дж/г·К, плотность раствора ≈ 1 г/см3.
Пересчет на мольную энтальпию производится по формуле
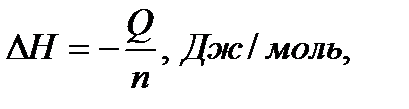
где n – мольное количество исследуемого вещества.
Экспериментальная часть






