Реакции, которые могут одновременно протекать в прямом и обратном направлениях, называются обратимыми. Состояние системы, когда скорость прямой реакции  равна скорости обратной реакции
равна скорости обратной реакции  , называется химическим равновесием. Химическое равновесие имеет динамический характер, то есть за определенный промежуток времени в определенном объеме реакционного пространства по прямой реакции образуется столько продукта, сколько и разлагается его по обратной реакции.
, называется химическим равновесием. Химическое равновесие имеет динамический характер, то есть за определенный промежуток времени в определенном объеме реакционного пространства по прямой реакции образуется столько продукта, сколько и разлагается его по обратной реакции.
Для гомогенной реакции, находящейся в состоянии равновесия,
а А + в В «d D + m M
будет выполняться соотношение
 или
или  ,
,
где  ,
,  - константы скорости прямой и обратной реакций; [A], [B], [D], [M] – концентрации участников реакции, установившиеся к моменту равновесия, иначе равновесные концентрации. Из уравнения следует, что
- константы скорости прямой и обратной реакций; [A], [B], [D], [M] – концентрации участников реакции, установившиеся к моменту равновесия, иначе равновесные концентрации. Из уравнения следует, что
 .
.
Соотношение констант  при постоянной температуре является постоянной величиной для данной реакции и называется константа химического равновесия К. Таким образом, связь между константой равновесия и равновесными концентрациями будет отражаться формулой
при постоянной температуре является постоянной величиной для данной реакции и называется константа химического равновесия К. Таким образом, связь между константой равновесия и равновесными концентрациями будет отражаться формулой
 .
.
Это уравнение является вариантом математической записи закона действующих масс для химического равновесия: при постоянной температуре отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, является величиной постоянной.
Если все участники реакции являются газообразными веществами, то вместо равновесных концентраций удобнее пользоваться равновесными парциальными давлениями компонентов Р А, Р В, Р Dи Р M, тогда закон действующих масс пример вид  .
.
Для гетерогенных реакций закон действующих масс выполняется при условии, что в уравнения констант равновесия не входят равновесные концентрации (парциальные давления) твердых исходных веществ и продуктов реакции. Например, для гетерогенной реакции
Сграфит + 2Н2Огаз «СО2 + 2Н2
константа равновесия выражается уравнением
 .
.
Константа химического равновесия зависит от природы реагирующих веществ и от температуры. Влияние температуры на К определяется знаком теплового эффекта реакции. Для эндотермической реакции (Q < 0) при повышении температуры константа равновесия увеличивается, и наоборот, для экзотермической реакции (Q > 0) при возрастании температуры К уменьшается. Строгую связь между температурой и константой равновесия реакции, протекающей при постоянном давлении, отражает уравнение изобары Вант-Гоффа
 ,
,
где ln К – натуральный логарифм константы равновесия; D Н – изменение энтальпии реакции; R – универсальная газовая постоянная; Т –абсолютная температура, К. Из уравнения видно, что при увеличении абсолютного значения энтальпии реакции и уменьшении температуры чувствительность К к изменению температуры повышается. Используя уравнение изобары Вант-Гоффа, можно вывести формулу для расчета среднего значения D Н реакции, если известны значения константы равновесия при двух температурах
 ,
,
где К 1, К 2 – константы равновесия реакции при температурах Т 1 и Т 2 соответственно.
Пример 1. В состоянии равновесия для реакции N2 + 3H2 «2NH3 концентрации участников реакции равны (моль/дм3): [N2] = 3; [H2] = 9; [NH3] = 4. Вычислите константу равновесия реакции и определите исходные концентрации азота и водорода, полагая, что до начала реакции аммиак в системе отсутствовал.
Р е ш е н и е
Данная реакция является гомогенной, поэтому константа равновесия равна

 .
.
Из уравнения реакции следует, что для образования 4 моль продукта требуется 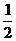 × 4 = 2 моль азота и
× 4 = 2 моль азота и 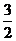 × 4 = 6 моль водорода. Следовательно, исходная концентрация азота составляет [N2]0 = 3 + 2 = 5 моль/дм3, а исходная концентрация водорода равна [H2]0 = 9 + 6 = 15 моль/дм3.
× 4 = 6 моль водорода. Следовательно, исходная концентрация азота составляет [N2]0 = 3 + 2 = 5 моль/дм3, а исходная концентрация водорода равна [H2]0 = 9 + 6 = 15 моль/дм3.
Пример 2. Константа равновесия реакции FeOтв + СО «Feтв + СО2 при некоторой температуре равна 0,5. Определите равновесные концентрации газов, если до начала реакции газовая смесь содержала 0,05 моль/дм3 СО и 0,01 моль/дм3 СО2.
Р е ш е н и е
Для данной гетерогенной реакции константа равновесия определяется выражением  . Пусть к моменту равновесия в реакцию вступило х моль СО. Тогда, согласно уравнению реакции, образовалось столько же моль СО2. Следовательно, равновесные концентрации газов будут равны: [CO] = (0,05 – х) моль/дм3; [CO2] = (0,01 + х). Подставим эти концентрации в выражение для константы равновесия
. Пусть к моменту равновесия в реакцию вступило х моль СО. Тогда, согласно уравнению реакции, образовалось столько же моль СО2. Следовательно, равновесные концентрации газов будут равны: [CO] = (0,05 – х) моль/дм3; [CO2] = (0,01 + х). Подставим эти концентрации в выражение для константы равновесия
 или
или 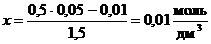 .
.
Таким образом, [CO] = 0,05 – 0,01 = 0,04 моль/дм3;
[CO2] = 0,01 + 0,01 = 0,02 моль/дм3.
Пример 3. Константа равновесия реакции Н2 + I2 «2HI равна 64,8. Определите равновесные концентрации компонентов, если исходная смесь содержала 1,4 моль/дм3 водорода и 1,0 моль/дм3 йода.
Р е ш е н и е
Выражение для константы равновесия имеет вид
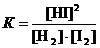 .
.
Пусть к моменту равновесия образовалось х моль HI. Тогда, согласно уравнению реакции, было израсходовано по 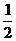 х моль йода и водорода. Следовательно, можно составить уравнение
х моль йода и водорода. Следовательно, можно составить уравнение
 или 15,2 х 2 – 77,76 х + 90,72 = 0.
или 15,2 х 2 – 77,76 х + 90,72 = 0.
Решение данного квадратного уравнения даст корни: х 1 = 3,32 моль/дм3;
х 2 = 1,8 моль/дм3. Первый корень не удовлетворяет условию задачи по физическому смыслу (концентрация HI не может быть больше, чем удвоенная концентрация йода или водорода, то есть 2 или 2,8 моль/дм3). Таким образом, используем второй корень уравнения. Равновесные концентрации компонентов равны (моль/дм3):
[HI] = 1,8; [H2] = 1,4 -  1,8 = 0,5; [I2] = 1,0 -
1,8 = 0,5; [I2] = 1,0 -  1,8 = 0,1.
1,8 = 0,1.
Пример 4. Вычислите константу равновесия реакции 2СО «Ств + О2, если известны значения констант равновесия реакций:
1) СО2 «Ств + О2, К 1 = 1,8×10-21;
2) 2СО2 «2СО + О2, К 2 = 2×10-5.
Р е ш е н и е
Запишем выражение для искомой константы равновесия  . Равновесное парциальное давление СО выразим из константы равновесия второй реакции
. Равновесное парциальное давление СО выразим из константы равновесия второй реакции
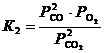 , откуда
, откуда  .
.
Тогда, 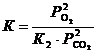 . Соотношение равновесных парциальных давлений кислорода и оксида углерода (IV) найдем из выражения для константы равновесия первой реакции
. Соотношение равновесных парциальных давлений кислорода и оксида углерода (IV) найдем из выражения для константы равновесия первой реакции  . Следовательно
. Следовательно
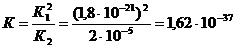 .
.
Пример 5. Константа равновесия некоторой реакции при 298 К равна 12,3 дм3/моль, а при 350 К - 1,07 дм3/моль. Вычислите изменение энтальпии реакции в данном интервале температур.
Р е ш е н и е
Используем уравнение изобары Вант-Гоффа
 Дж/моль.
Дж/моль.
З а д а ч и
1. Константа равновесия реакции Н2 + I2 «2HI при 445 °С равна 50. Сколько моль водорода необходимо взять на 1 моль йода, чтобы 80 % последнего превратить в йодоводород?
2. Исходные концентрации азота и водорода в реакционной смеси для получения аммиака составляли 4 и 10 моль/дм3 соответственно. Вычислите равновесные концентрации компонентов в смеси, если к моменту наступления равновесия прореагировало 50 % азота.
3. Обратимая реакция протекает по уравнению А + В «С + D. Исходная концентрация каждого из веществ в смеси составляет 1 моль/дм3. После установления равновесия концентрация компонента С равна 1,5 моль/дм3. Вычислите константу равновесия реакции.
4. Определите исходные концентрации NO и O2 и константу равновесия обратимой реакции 2NO + О2 «2NO2, если равновесие установилось при следующих концентрациях реагирующих веществ (моль/дм3): [NO2] = 0,12; [NO] = 0,48; [O2] = 0,24.
5. Исходные концентрации СО и паров воды равны 0,08 моль/дм3. Вычислите константу равновесия реакции СО + Н2Огаз «СО2 + Н2, если равновесная концентрация СО2 оказалась равной 0,05 моль/дм3.
6. При некоторой температуре константа равновесия термической диссоциации N2O4 «2NO2 равна 0,26. Равновесная концентрация NO2 равна 0,28 моль/дм3. Вычислите начальную концентрацию N2O4 и массовую долю этого вещества, прореагировавшую к моменту установления равновесия.
7. Вычислите константу равновесия реакции Н2 + I2 «2HI, если до начала реакции в сосуде объемом 5 л содержалось 1 моль водорода и 2 моль йода, а к моменту равновесия образовалось 35 г HI.
8. В состоянии равновесия системы СО2 + Н2 «СО + Н2Огаз реакционная смесь имела состав (% объемн.): СО2 – 22; Н2 – 41; СО – 17; Н2О – 20. Вычислите константу равновесия, если общее давление в системе равно 98501 Па.
9. Для реакции синтеза аммиака из азота и водорода при 500 К константа равновесия, выраженная через парциальные давления компонентов равна 5,34×10-8 Па-2. Определите равновесное парциальное давление аммиака, если парциальное давление азота и водорода в состоянии равновесия равно 65717 и 20380 Па соответственно.
10. Вычислите константу равновесия реакции PCl5 «PCl3 + Cl2, если к моменту равновесия прореагировало 54 % пентахлорида фосфора, а его исходная концентрация составляла 1 моль/дм3.
11. При нагревании протекает обратимая реакция SO2Cl2 «SO2 + Cl2. Из 1 моль вещества SO2Cl2, находящегося в закрытом сосуде объемом 20 дм3, разлагается 0,5 моль. Определите константу равновесия данной реакции.
12. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции 2NO2 «2NO + O2 установилось при концентрациях компонентов (моль/дм3): диоксида азота – 0,8; оксида азота – 2,2; кислорода – 1,1. Вычислите константу равновесия и исходную концентрацию NO2.
13. В замкнутом сосуде протекает гомогенная реакция АВ «А + В. Константа равновесия процесса равна 0,04. Равновесная концентрация В составляет 0,02 моль/дм3. Вычислите начальную концентрацию вещества АВ и определите, сколько процентов АВ разложилось к моменту наступления равновесия.
14. Для гомогенной газовой реакции Н2 + Br2 «2HBr при некоторой температуре константа равновесия равна 1. Определите равновесный состав реакционной смеси в объемных %, если исходная смесь состояла из 3 моль водорода и 2 моль брома.
15. Для реакции ZnOтв + СО «Znтв + СО2 равновесные концентрации СО и СО2 одинаковы и равны 1 моль/дм3. Вычислите константу равновесия и определите начальную концентрацию СО в системе.
16. Равновесие гомогенной системы 4HCl + O2 «2H2O + 2Cl2 установилось при следующих концентрациях (моль/дм3): Н2О – 0,14; Cl2 – 0,14; HCl – 0,20; О2 – 0,32. Вычислите исходные концентрации хлороводорода и кислорода.
17. При 400 К константа равновесия реакции синтеза аммиака из азота и водорода равна 0,1×10-10 Па-2. Изменение энтальпии реакции равно –100  . Вычислите константу равновесия данной реакции при 345 К.
. Вычислите константу равновесия данной реакции при 345 К.
18. Выразите константу равновесия реакции СО2 + Ств «2СО, используя константы равновесия реакций:
1) Ств + О2 «СО2, К 1; 2) 2СО + О2 = 2СО2, К 2.
19. Константа равновесия реакции 4HCl + O2 «2H2O + 2Cl2 составляет 0,0562, а для реакции Н2О «Н2 + 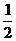 О2 равна 2,5×10-6. Вычислите константу равновесия реакции Н2 + Cl2 «2HCl.
О2 равна 2,5×10-6. Вычислите константу равновесия реакции Н2 + Cl2 «2HCl.
20. Вычислите D Н реакции Feтв + Н2Огаз «FeОтв + Н2, если при температурах 1298 К и 1173 К константы равновесия реакции равны 1,28 и 1,45 соответственно.
21. Исходные концентрации NO и Cl2 в гомогенной системе
2NO + Cl2 «2NOCl
составляют соответственно 0,5 и 0,2 моль/дм3. Вычислите константу равновесия, если к моменту равновесия прореагировало 20 % NO.
22. Выразите константу равновесия реакции Sтв + О2 «SO2 через константы равновесия реакций:
1) SO2 «Sтв + 2О, К 1; 2) О2 «2О, К 2.
23. Константа равновесия реакции MgCO3 «MgO + CO2 при 823 К равна 0,983 атм., а при 843 К равна 1,763 атм. Вычислите изменение энтальпии данной реакции в указанном интервале температур.
24. Вычислите константу равновесия реакции Н2 + I2 «2HI, если до начала реакции в сосуде объемом 5 л содержалось 2 г водорода и 254 г йода, а к моменту равновесия образовалось 0,4 моль HI.
25. Для реакции ZnOтв + СО «Znтв + СО2 равновесные концентрации СО и СО2 равны 0,5 и 0,2 моль/дм3 соответственно. Вычислите константу равновесия и определите начальную концентрацию СО в системе.






