ХИМИЯ
Методические указания для подготовки к лабораторным занятиям
по химии для студентов 1 курса
05.03.06 Экология и природопользование
направленность «Природопользование»
Курган 2017
Кафедра: «Физическая и прикладная химия»
Дисциплина: «Химия» (05.03.06 Экология и природопользование)
Составитель: доцент, канд. хим. наук А.И. Рыкова
Утверждены на заседании кафедры «___»_________2017 г.
Рекомендованы методическим советом университета «____»________2017 г.
СОДЕРЖАНИЕ
Раздел 1. Основы строения вещества…………………………………………… 4
Тема 1: Основные понятия и законы химии…………………………………… 4
Тема 2: Строение атома………………………………………………………… 4
Тема 3: Периодический закон и периодическая система элементов
Д.И. Менделеева.........................................................................................… 6
Тема 4: Виды химической связи. Строение вещества…………………………. 8
Раздел 2. Химическая термодинамика и кинетика…………………………….. 10
Тема 1: Основы химической термодинамики…………………………………. 10
Тема 2: Скорость химических реакций………………………………………… 11
Тема 3: Химическое равновесие………………………………………………… 14
РК №1
Раздел 3. Растворы……………………………………………………………… 16
Тема 1: Способы приготовления растворов…………………………………… 16
Тема 2: Растворы неэлектролитов………………………………………………. 17
Тема 3: Теория электролитической диссоциации. Реакции ионного обмена … 19
Тема 4: Гидролиз солей. Буферные растворы……………………….......... 22
Раздел 4. Окислительно-восстановительные реакции………………………… 21
Тема 1: Окислительно-восстановительные реакции. Электрохимические процессы. Коррозия..............................................…………………………. 23
Раздел 5. Основы органической химии......................................................... 27
Тема 1: Органические соединения. Углеводороды........................................ 27
Тема 2: Кислородсодержащие органические соединения............................ 29
РК №2
Список литературы ……………………………………………………… 32
Раздел 1. Основы строения вещества
Тема 1: Основные понятия и законы химии
Основные вопросы теории
1. Атомно-молекулярное учение.
2. Химический элемент. Изотопы. Простое вещество. Аллотропия. Сложное вещество
3. Атомы и молекулы. Размеры и массы атомов и молекул. Относительные атомные и молекулярные массы.
4. Моль − единица количества вещества. Число Авогадро. Молярная масса. Молярный объём.
5. Закон сохранения массы и энергии при химических реакциях. Понятие о взаимосвязи массы и энергии. Уравнение химической реакции как отражение закона сохранения массы вещества.
6. Закон постоянства состава вещества. Химическая формула как отражение закона постоянства состава. Простейшие и истинные формулы вещества. Дальтониды и бертоллиды.
7. Закон кратных отношений. Границы применимости закона.
8. Эквивалент и эквивалентная масса элемента и соединения. Закон эквивалентов.
9. Закон простых объёмных отношений. Закон Авогадро и следствия из него.
Задачи для самостоятельного решения
1. Вычислите: а) относительную молекулярную массу Na2CO3•10H2O; б) абсолютную молекулярную массу H2SO4.
2. Масса образца сероводорода равна 1,7 г. Вычислите число молекул сероводорода в данном образце и массу одной молекулы.
3. Смешали растворы, содержащие 15 г ВаCl2 и 11 г Na2SO4. Какое вещество и в каком количестве останется в избытке после смешения?
4. В состав химического соединения входят Nа, Р, О. Массовая доля натрия составляет 34,6%, фосфора – 23,3%, кислорода – 42,1%. Определите простейшую формулу соединения.
5. На воздухе прокалили 5,4 г металла, при этом получили 10,2 г его оксида Ме2О3. Определите, какой металл был взят.
Тема 2: Строение атома
Основные вопросы теории
1. Экспериментальные обоснования сложности строения атома.
2. Атомные модели Томсона, Резерфорда, Бора.
3. Экспериментальные и теоретические основы квантовой механики: волновые и корпускулярные свойства света. Фотоэффект, фотоны; корпускулярно- волновой дуализм микрочастиц, волны де Бройля; принцип неопределённости Гейзенберга. Описание состояния электрона в атоме квантовой механикой.
4. Современная модель строения атома. Атомное ядро. Изотопы (на примере водорода, кислорода, хлора). Волновая функция, атомная орбиталь.
5. Квантовые числа, их физический смысл.
6. Принципы заполнения атомных орбиталей.
Тестовое задание
1. Ядро атома криптона-80  содержит:
содержит:
а) 80p и 36n; б) 36p и 44e; в) 36p и 80n; г) 36p и 44n.
2. Какое число электронов содержится в ионе хрома Cr3+?
а) 21; б) 24; в) 27; г) 52.
3. Электронную конфигурацию благородного газа имеет:
а) Te2-; б) Ga+; в) Fe2+; г) Cr3+.
4. Три частицы: Ne, Na+, F- имеют одинаковое:
а) массовое число; в) число электронов;
б) число нейтронов; г) число протонов.
5. Закончите схему реакции 94Be + 42He → 126C + …, выбрав один из предложенных вариантов:
а) 11p; б)  ; в)
; в) 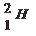 ; г)
; г) 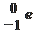 .
.
6. В случае перехода 4120Ca → 4119K имеет место превращение типа:
а) α-распад; в) электронный захват;
б) β-распад; г) испускание протона.
7. Атомы  и
и  являются
являются
а) изобарами; б) изотопами в) изотонами.
Задачи для самостоятельного решения
1. Энергетическое состояние внешнего электрона атома описывается следующими значениями квантовых чисел: n = 3, l =0, ml = 0. Атомы каких элементов имеют такой электрон?
2. Напишите электронную формулу иона Mn2+.
3. Напишите электронные формулы атомов элементов с порядковыми номерами 33 и 43. Чему равен максимальный спин р–электронов у атомов первого и d–электронов у атомов второго элемента?
Тема 3: Периодический закон и периодическая система химических элементов Д.И. Менделеева
Основные вопросы теории
1. Таблица химических элементов. Периодический закон и периодическая система химических элементов в свете теории строения атома.
2. Группы и подгруппы (главная и побочная). Периоды и ряды.
3. Периодичность в изменении свойств элементов; радиусов атомов, энергии ионизации и сродства к электрону, электроотрицательности, валентности и степени окисления.
4. Периодичность в изменении свойств кислородных соединений элементов (оксидов и гидроксидов) по периодам и группам.
5. Периодичность в изменении свойств водородных соединений элементов в периодах и группах.
ПЛАН ИЗУЧЕНИЯ ХИМИЧЕСКОГО ЭЛЕМЕНТА
1. По положению элемента в периодической системе опишите строение атома (заряд ядра, электронная конфигурация – распределение электронов по квантовым ячейкам), его возможные степени окисления.
2. По структуре атома сделайте заключение:
а) образует ли элемент в обычных условиях молекулу простого вещества?
б) какую кристаллическую решетку (атомную, молекулярную, металлическую) имеет простое вещество в твердом состоянии?
в) какие можно предположить физические свойства данного простого вещества: агрегатное состояние, легко- или тугоплавкость, наличие запаха, растворимость в воде, металлический блеск, электрическая проводимость, теплопроводность, хрупкость?
3. Исходя из возможных степеней окисления элемента, определите, в какой роли – окислителя или восстановителя – может выступать простое вещество?
4. По положению элемента в периодической системе и его возможным степеням окисления определите:
а) форму высшего оксида и его гидроксида;
б) кислотно-основные свойства оксида и гидроксида;
в) форму летучего водородного соединения и его характер.
Тестовое задание
1. Сколько неспаренных электронов имеет ион Со3+?
а) 4; б) 3; в) 2; г) 1.
2. Энергия, которая указана в уравнении Clо(г) → Cl+(г) + е − 1254 кДж, является для атома хлора
а) энергией химической связи; в) электроотрицательностью;
б) энергией ионизации; г) сродством к электрону.
3. Какой ион имеет наибольший радиус? Дайте ответ на основании положения соответствующих элементов в периодической системе:
а) Ca2+; б) K+; в) F-; г) Cl-.
4. Элемент с порядковым номером 114 должен обладать свойствами, сходными
а) с платиной; б) со свинцом; в) с мышьяком; г) с ртутью.
5. Высший оксид элемента отвечает формуле ЭО3. Его водородное соединение содержит 2,47% водорода. Этот элемент
а) S; б) Se; в) Te; г) Po.
6. Символ элемента с валентными электронами атома … 3d104s1
а) Cr; б) Mn ; в) Cu; г) Zn.
7. Порядковый номер элемента с сокращенной электронной формулой атома [Ar]3d34s2
а) 20; б) 24; в) 19; г) 23.
8. Какой из элементов имеет наибольшее значение энергии ионизации?
а) 3Li; б) 9F; в) 26Fe; г) 53I.
9. Какая частица имеет большее число протонов, чем электронов?
а) ион Na; б) сульфид-ион; в) атом Na; г) атом S.
10. В ряду S − Se − Sn − Sr пара элементов с однотипными химическими свойствами – это:
а) Sn, Sr; б) S, Sn; в) Se, Sn; г) S, Se.
Задачи для самостоятельного решения
1. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Составьте формулы соединений алюминия с данными элементами в этой степени окисления и назовите их.
2. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Исходя из положения приведенных элементов в периодической системе, расположите элементы в порядке уменьшения сродства к электрону: Ga, Br, Se, Ge, As.
3. Что такое энергия ионизации? В каких единицах она выражается? Как изменяется величина энергии ионизации в периоде, в группе периодической системы с увеличением порядкового номера? Расположите перечисленные элементы в порядке увеличения энергии ионизации: Li, F, Fe, I.
4. Каков физический смысл порядкового номера элемента? Опишите химические свойства элемента с порядковым номером 23 по его положению в периодической системе.
5. Какие электронные семейства элементов вы знаете? Укажите, к какому электронному семейству относится каждый из следующих элементов: 72Нf, 14Si, 88Ra, 35Br, 10Ne.
6. Какую высшую и низшую степени окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Тема 4: Виды химической связи. Строение вещества
Основные вопросы теории
1. Химическая связь. Основные характеристики химической связи (энергия, длина).
2. Характеристика ковалентной связи. Ковалентная полярная и неполярная связь. Полярность связи и полярность молекулы. Два механизма образования связи: обменный и донорно-акцепторный.
3. Гибридизация орбиталей. ϭ- и p-связи. Кратность связи.
4. Ионная связь, механизм её образования.
5. Металлическая связь.
6. Межмолекулярные взаимодействия (силы Ван-дер-Ваальса, водородная связь).
7. Твёрдое состояние вещества: атомные, ионные, молекулярные и металлические кристаллические решётки.
Тестовое задание
1. Примером неполярной молекулы, имеющей полярную ковалентную связь, будет:
а) N2; б) H2O; в) NH3; г) CCl4.
2. Наиболее ионным является соединение
а) ССl4 (ж); б) SiO2 (тв.); в) KСl(тв.); г) NH3.
3. Валентные орбитали атома бора в молекуле BF3 гибридизованы по типу:
а) sp; б) sp2; в) sp3; г) d2sp3;
а молекула имеет структуру: 1) линейную; 2) плоскую;
3) тетраэдрическую; 4) октаэдрическую.
4. Наибольшее число молекул содержится при обычных условиях в 1л
а) H2S; б) H2O; в) HCl; г) H2.
5. При одинаковых T и P 1,0 л газообразного кислорода и 1,0 л газообразного водорода имеют равные
а) массы; в) плотности;
б) число молекул; г) скорости движения молекул.
6. Между атомами кислорода и водорода может образоваться только:
а) σ-связь; б) π-связь; в) ионная связь.
7. «Твёрдое, легкоплавкое, летучее» – можно сказать о веществе
а) сахароза; б) диоксид кремния; в) фенол; г) этанол.
Задачи для самостоятельного решения
Вариант 1
1. Ковалентная связь (характеристики и виды ковалентной связи). Примеры веществ с ковалентной связью.
2. Расположите формулы соединений в порядке возрастания полярности химической связи: SnO, B2O3, CO2, NO, H2O.
3. Даны вещества: Br2, ZnCl2, SO3.
Определите:
а) виды химической связи;
б) тип кристаллической решетки в твердом состоянии;
в) свойства веществ (агрегатное состояние, летучесть, температура кипения и температура плавления, растворимость в воде).
Вариант 2
1. Механизмы образования ковалентной связи.
2. Полярность ковалентной связи. Расположите вещества в порядке увеличения полярности связи: HCl, F2, H2O, H2S?
3. Определите вид химической связи в соединениях: NCl3, O2, Cl2, H2O, CaCl2, H2S. Cоставьте электронные формулы молекул хлора и сероводорода. Какой тип кристаллической решетки у этих веществ в твердом состоянии?
Вариант 3
1. Ионная связь.
2. Какой атом выступает в роли донора, а какой – в роли акцептора электронной пары при образовании иона BF4- по реакции BF3 + F- = BF4-? Ответ обоснуйте.
3. Определите вид химической связи в соединениях: I2, CuO, HCl, H2S, CH4.
Какой тип кристаллической решетки у I2, HCl, CuO? Какими свойствами в связи с этим должны обладать данные соединения?
Вариант 4
1. Металлическая связь.
2. Как определить, какая связь в молекуле H-O-Cl более полярна?
3. На конкретных примерах покажите зависимость свойств веществ от типа кристаллической решетки.






