Неорганические соединения обычно делят на четыре важнейших класса: оксиды, основания, кислоты и соли.
Оксиды – это соединения, состоящие из двух элементов, одним из которых является кислород. Образование названия оксида (его номенклатура) подчиняется следующим правилам:
а) Если элемент, соединяясь с кислородом, проявляет единственную степень окисления, то название такого соединения состоит из слова «оксид» и названия металла, например: Na2O – оксид натрия, BaO – оксид бария.
б) Если элемент, соединяясь с кислородом, проявляет различные степени окисления, то после названия элемента в круглых скобках римскими цифрами указывается степень окисления элемента или систематическое название с числовыми приставками, например: N2O – оксид азота (I) или оксид диазота, NO2 – оксид азота (IV) или диоксид азота.
Оксиды делятся на солеобразующие и несолеобразующие. Солеобразующие оксиды делятся на основные, кислотные и амфотерные.
Основные оксиды образуются металлами, степень окисления которых не выше трех (например, оксиды щелочных и щелочно-земельных металлов). Кислотные оксиды образуются неметаллами, а также металлами со степенью окисления +4, +5, +6, +7, например: Р2О3, SiО2, Mn2О7 и т.д. Амфотерные оксиды образуются металлами, проявляющими амфотерные свойства и степень окисления которых равна +2, +3, например: Al2О3, Cr2О3, Ga2О3, Fe2О3, SnО, BeО, ZnО и т.д.
Если элемент образует несколько оксидов (например, хром: 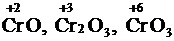 ), то по мере увеличения его степени окисления усиливается кислотный характер оксида. Таким образом, CrO – основной оксид, Cr2O3 – амфотерный оксид, CrO3– кислотный оксид.
), то по мере увеличения его степени окисления усиливается кислотный характер оксида. Таким образом, CrO – основной оксид, Cr2O3 – амфотерный оксид, CrO3– кислотный оксид.
Химические свойства оксидов
1. Оксиды щелочных и щелочноземельных металлов, а также кислотные оксиды непосредственно реагируют с водой:
Nа2O + Н2О = 2NаOН;
основной вода щелочь
оксид
N2O5 + Н2О = 2НNO3.
кислотный вода кислота
оксид
2. Основные и кислотные оксиды реагируют между собой:
Nа2O + СО2 = Nа2СО3.
основной кислотный соль
оксид оксид
3. Амфотерные оксиды реагируют с кислотными и основными оксидами:
ZnO + SO3 = ZnSO4;
амфотерный кислотный соль
оксид оксид
ZnO + Nа2O = Nа2ZnO2.
амфотерный основной соль
оксид оксид
4. Основные оксиды взаимодействуют с кислотами:
Nа2O + H2SO4 = Nа2SO4 + Н2О.
основной кислота соль вода
оксид
5. Кислотные оксиды взаимодействуют с основаниями:
N2O5 + 2NаOН = 2NaNO3 + Н2О.
кислотный основание соль вода
оксид
6. Амфотерные оксиды взаимодействуют с кислотами и основаниями, проявляя при этом:
– основные свойства:
ZnO + H2SO4 = ZnSO4 + Н2О;
амфотерный кислота соль вода
оксид
б) кислотные свойства:
ZnOт + NаOНт  Nа2ZnO2 + Н2О.
Nа2ZnO2 + Н2О.
амфотерный основание соль вода
оксид
Гидроксиды можно рассматривать как продукты соединения оксидов с водой. Они бывают трех видов: основные (основания), кислотные (кислоты) и амфотерные (амфолиты).
Амфолиты – гидроксиды, которые проявляют как основные, так и кислотные свойства. Чтобы установить амфотерность гидроксида, следует провести две реакции взаимодействия его с кислотой и с основанием. Если обе реакции осуществимы, то гидроксид амфотерен.
Основания – электролиты, которые при диссоциации в качестве анионов образуют только гидроксид-ионы ОН–, например:
NаOН ↔ Nа+ + ОН–.
Кислотность основания определяется числом гидроксильных групп. В связи с этим различают:
– однокислотные основания (например: NаOН, LiOH);
– двухкислотные основания (например: Mg(OH)2, Cu(OH)2);
– трехкислотные основания (например: Al(OH)3, Fe(OH)3).
Основания, в составе которых находится более одной гидроксильной группы, называются многокислотными. Диссоциация многокислотных оснований протекает ступенчато:
Cu(OH)2 ↔ CuOH+ + ОН– I ступень
CuOH+ ↔ Cu2+ + ОН– II ступень
По растворимости основания делят на сильные, т.е. растворимые в воде (к ним относятся гидроксиды щелочных и щелочноземельных металлов), и слабые, т.е. малорастворимые в воде (гидроксиды остальных металлов).
Номенклатура основанийоснована на следующих положениях:
1. Если металл имеет постоянную степень окисления, то названия образуются из слова «гидроксид» и названия металла, например: Mg(OH)2 – гидроксид магния, NаOН – гидроксид натрия.
2. Если металл имеет переменную степень окисления, то к слову «гидроксид» добавляется приставка латинского числительного или после названия катиона в круглых скобках римскими цифрами указывается его степень окисления, например: Cr(OH)3 – тригидроксид хрома, или гидроксид хрома (III); Fe(OH)2 – дигидроксид железа, или гидроксид железа (II).
Химические свойства оснований
1. Основания взаимодействуют с кислотами (реакция нейтрализации):
NаOН + HCl = NаCl + Н2О.
основание кислота соль вода
2. Растворимые основания взаимодействуют с кислотными оксидами:
2NаOН + СО2 = Nа2СО3 + Н2О.
основание кислотный соль вода
оксид
3. Растворимые основания взаимодействуют с солями (условие: один из продуктов нерастворим):
2КОН + MgCl2 = Mg(OH)2↓ + 2KCl.
основание соль основание соль
4. Нерастворимые основания при повышении температуры разлагаются на оксид и воду:
Cu(OH)2  CuO + Н2О.
CuO + Н2О.
5. Амфотерные гидроксиды взаимодействуют с кислотами и основаниями, проявляя при этом:
а) основные свойства:
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O;
амфотерный кислота соль вода
гидроксид
б) кислотные свойства:
Zn(OH)2 т + 2NаOНт = Na2ZnO2 + 2H2O.
амфотерный основание соль вода
гидроксид
6. Растворы оснований изменяют цвет индикаторов: фенолфталеин – с бесцветного на малиновый, лакмус – с фиолетового на синий, метиловый оранжевый – с оранжевого на желтый.
Кислоты – это электролиты, которые в водных растворах диссоциируют на катион водорода Н+ и кислотный остаток, например:
HCl ↔ H+ + Cl−.
Основность кислоты определяется числом катионов водорода, поэтому HCl, HNO3 – одноосновные кислоты; H2SO4, H2S – двухосновные кислоты; H3PO4 – трехосновная кислота. Многоосновные кислоты диссоциируют ступенчато, например:
H2SO4 ↔ H+ + HSO4− I ступень
HSO4− ↔ H+ + SO42− II ступень
Кислоты могут быть бескислородными (не содержащими кислород в своем составе: HCl, H2S) и кислородсодержащими (содержащими в своем составе кислород: H2SO4, HNO3).
Номенклатура кислот подчиняется следующим правилам:
1. Названия бескислородных кислот образуются путем прибавления к корню русского названия элемента через соединительную гласную «о» и словосочетания «водородная кислота», например: HCl– хлороводородная кислота, HF – фтороводородная кислота.
2. Названия кислородсодержащих кислот образуются из названия неметалла с прибавлением - ная, - вая, если степень окисления неметалла равна номеру группы. При понижении степени окисления суффиксы меняются в следующем порядке: - оватая,
- истая, - оватистая, например: HCl+7O4 – хлорная кислота, HCl+5O3 – хлорноватая кислота, HCl+3O2 – хлористая кислота, HCl+O – хлорноватистая кислота.
3. Если элемент в одной и той же степени окисления образует две кислоты, различающиеся «по содержанию воды», то перед названием кислоты, содержащей меньшее количество атомов кислорода, ставят приставку мета-, а перед названием кислоты с большим числом атомов кислорода ставят приставку орто-, например: HP+ 5 O 3 – метафосфорная кислота,Н3P+5O 4 – ортофосфорная кислота.
Химические свойства кислот
1. Кислоты взаимодействуют с основными оксидами:
2HCl + Na2O = 2NaCl + H2O.
кислота основной соль вода
оксид
2. Кислоты взаимодействуют с основаниями (реакция нейтрализации):
HCl + NаOН = NaCl + H2O.
кислота основание соль вода
3. Кислоты взаимодействуют с солями с образованием новой кислоты и новой соли (условие: образование осадка или выделение газа):
HCl + AgNO3 = AgCl↓ + HNO3.
кислота соль соль кислота
4. Кислоты взаимодействуют с металлами:
а) соляная и разбавленная серная кислоты с металлами, стоящими в ряду стандартных электродных потенциалов до водорода, с выделением водорода:
2HCl + Mg = MgCl2 + H2↑;
б) азотная кислота, в зависимости от положения металла в ряду стандартных электродных потенциалов и концентрации кислоты, с выделением NO2, NO, N2O, N2 или NH3, например:
Pb + 4HNO3 = Pb(NO3) 2 + 2NO2↑ + 2H2O;
в) концентрированная серная кислота, в зависимости от положения металла в ряду стандартных электродных потенциалов, с выделением SO2 илиH2S,например:
Cu + 2H2SO4 (конц) = CuSO4 + SO2 ↑ + 2H2O.
5. Раствор кислоты изменяет цвет индикатора: лакмус – с фиолетового на красный, метиловый оранжевый – с оранжевого на розовый, конго красный – с красного на синий.
Соли – электролиты, при диссоциации которых образуются катионы металлов (или катион аммония NH4+) и анионы кислотных остатков. Соли делятся на средние, кислые, основные, двойные, комплексные и гидратные.
Средние соли – продукты полного замещения атомов водорода на металл, например: BaSO4, NaCl. Диссоциацию средней соли можно выразить уравнением
NaCl ↔ Na+ + Cl−.
Кислые соли (гидросоли) – продукты неполного замещения атомов водорода многоосновных кислот на металл. Образуются только многоосновными кислотами, например: Ba(HCO3)2, MgHPO4. Диссоциацию кислой соли можно выразить уравнением
Ba(HCO3)2 = Ba2+ + 2HCO3 –.
Основные соли (гидроксосоли) – помимо металла и кислотного остатка содержат гидроксильные группы ОН–. Образуются только многокислотными основаниями, например: AlOHCl2, Cr(OH)2NO3. Диссоциацию основной соли можно выразить уравнением
AlOHCl2 = AlOH+ + 2Cl–.
Двойные соли образуются при действии на многоосновную кислоту двух различных оснований. Двойная соль содержит катионы двух металлов и анионы одной и той же кислоты, например:
K2NaPO4 ↔ 2K+ + Na+ + PO43–;
KAl(SO4)2 ↔ K+ + Al3+ + 2SO42–.
Комплексные соли – это вещества, в состав которых входят сложные ионы (в формулах они заключаются в квадратные скобки), способные отщепляться при диссоциации, например:
K4[Fe(CN)6] ↔ 4K+ + [Fe(CN)6]4–;
[Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl–.
В большинстве комплексных соединений различают внутреннюю и внешнюю сферы. Например, в К2[BeF4] и [Zn(NH3)4]Cl2 внутреннюю сферу составляют группировки атомов в квадратных скобках [BeF4]2– и [Zn(NH3)4]2+, а внешнюю сферу, соответственно, ионы К+ и Сl–. Центральный атом (ион) внутренней сферы называется комплексообразователем, а координированные вокруг него молекулы (ионы) – лигандами.
Гидратные соли – это соли, содержащие молекулы кристаллизационной воды, например: Na2SO4 · 10H2O.
Номенклатура солейобразуется по следующим правилам:
1. Название средней соли образуется из названия аниона (кислотного остатка) в именительном падеже и катиона (металла или основания) в родительном падеже. Если металл проявляет переменную степень окисления, то после названия катиона указывают римскими цифрами в скобках степень его окисления, например: NaCl – хлорид натрия, FeS– сульфид железа (II).
2. Названия кислых солей образуются добавлением к названию аниона приставки гидро-,например: KНSO4 – гидросульфат калия, Ca(H2PO4)2 – дигидрофосфат кальция.
3. Названия основных солей образуются добавлением к названию катиона приставки гидроксо-, например: AlOHSO4 – сульфат гидроксоалюминия, Al(OH)2Cl – хлорид дигидроксоалюминия.
4. Названия двойных солей образуются из названия аниона (кислотного остатка) в именительном падеже и катионов (металла или основания) в родительном падеже в алфавитном порядке, например: KAl(SO4)2 – сульфат алюминия-калия.
5. Название комплексного иона начинается с указания лигандов и заканчивается названием металла (комплексообразователя) с указанием соответствующей степени окисления (римскими цифрами в скобках). В названиях комплексных катионов используют русский корень названия металла, например: [Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II),[Ag(NH3)2]2SO4 – сульфат диамминсеребра (I). При образовании названия комплексных анаионов применяют латинский корень названия металла с суффиксом - ат, например: K[Al(OH)4] – тетрагидроксиалюминат калия, K4[Fe(CN)6] – гексацианоферрат (II) калия.
6. Названия гидратных солей образуются чаще всего, начиная с численной приставки к слову гидрат,далее следует название средней соли в родительном падеже, например: СaCl2 · 2H2O – дигидрат хлорида кальция.
Химические свойства солей
1. Соли взаимодействуют с кислотами с образованием новой соли и новой кислоты. Условиями протекания реакций являются:
– образование осадка или газа;
– сильная кислота вытесняет слабую из ее соли в соответствии с рядом уменьшения силы кислот (см. прил. 3), например:
2KNO3 + H2SO4 = 2HNO3 + K2SO4;
BaCl2 + H2SO4 = BaSO4↓ + HCl.
2. Соли взаимодействуют с растворимыми основаниями с образованием новой соли и нового основания (условие: образование осадка), например:
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH.
3. Соли взаимодействуют с другими солями с образованием двух новых солей (условие: образование осадка), например:
Na2SO4 + Ba(NO3)2 = BaSO4↓ + 2NaNO3.
4. Соли взаимодействуют с металлами с образованием новой соли и нового металла (условие: новый металл в ряду стандартных электродных потенциалов стоит ближе к началу ряда, чем исходный металл), например:
CuSO4 + Mg = MgSO4 + Cu;
NaCl + Mg ≠.
Получение кислых солей
1. Взаимодействием основания с избытком кислоты, например:
NaOH + H2CO3 = NaHCO3 + H2O.
2. Взаимодействием средней соли с избытком кислоты, например:
Na2SO4 + H2SO4 = 2NaHSO4.
Получение основных солей
1. Взаимодействием кислоты с избытком основания, например:
H2SO4 + 2Са(ОН)2 = (СаOH)2SO4 + 2H2O.
2. Взаимодействием средней соли с избытком основания, например:
CuSO4 + 2NaOH = (CuOH)2SO4 + Na2SO4.
Перевод кислых (основных) солей в среднюю соль
1. Взаимодействием кислойсоли с основанием, например:
NaHSO4 + NaOH = Na2SO4 + H2O.
2. Взаимодействием основнойсоли с кислотой, например:
(CuOH)2SO4 + H2SO4 = 2CuSO4 + 2H2O.
Порядок выполнения работы
Приборы и реактивы: штатив, пробирки, спиртовка, шпатели, пипетки, стеклянные палочки, вода дистиллированная, растворы HCl, H2SO4, HNO3, CuSO4, AgNO3, NaOH, MgSO4, Al(NO3)3, (NH4)2C2O4, Pb(NO3)2, KI, Na2HPO4, NH4OH, фенолфталеина, лакмуса, метилового красного, твердые вещества – СаО, ZnO, Cu, Mg, CH3COONa.
Х о д р а б о т ы
Получение и свойства оксидов
Опыт 1. В пробирку внести 3 капли раствора сульфата меди (II). Добавить по каплям раствор щелочи до образования осадка. Пробирку с осадком осторожно нагреть в пламени спиртовки. Как изменяется цвет осадка? К полученному осадку добавить 5 – 6 капель 2 н раствора серной кислоты. Наблюдать растворение осадка и появление окраски раствора.
Опыт 2. Налить в пробирку 2 капли раствора нитрата серебра, добавить по каплям раствор щелочи до образования осадка оксида серебра. К полученному осадку добавить раствор азотной кислоты. Что наблюдаете?
Опыт 3. Небольшое количество оксида кальция поместить в пробирку с водой. Добавить в пробирку несколько капель раствора фенолфталеина. Отметить растворимость в воде оксида кальция и изменение окраски индикатора.
Опыт 4. В две пробирки внести небольшое количество оксида цинка, добавить в первую пробирку 10 капель 2 н раствора соляной кислоты, во вторую 10 капель 2 н раствора гидроксида натрия. При необходимости нагреть содержимое пробирок.
Получение и свойства гидроксидов
Опыт 5. В три пробирки внести по 5 – 6 капель 2 н раствора гидроксида натрия. В каждую пробирку добавить по 2 – 3 капли индикаторов – фенолфталеина, лакмуса и метилового красного.
Опыт 6. В пробирку внести 5 – 6 капель раствора гидроксида натрия. Добавить каплю фенолфталеина. Перемешивая, добавлять по каплям раствор соляной кислоты до исчезновения окраски индикатора.
Опыт 7. Внести в две пробирки по 3 капли раствора соли магния и в каждую из них добавить по каплям раствор щелочи до образования осадков. Отметить цвет осадков. В одну пробирку прибавить раствор соляной кислоты. В другую пробирку добавить избыток раствора гидроксида натрия. Что происходит с осадками?
Опыт 8. В две пробирки внести по 2 – 3 капли раствора соли алюминия, добавить в каждую пробирку по каплям раствор гидроксида натрия до образования осадка гидроксида алюминия. В одну пробирку к полученному осадку прибавить 3 – 5 капель 2 н раствора соляной кислоты, в другую – столько же 2 н раствора гидроксида натрия. Что происходит в обоих случаях?
Получение и свойства кислот
Опыт 9. В три пробирки внести по 5 – 6 капель 2 н раствора соляной кислоты. В каждую пробирку добавить по 2 – 3 капли растворов индикаторов – фенолфталеина, лакмуса и метилового красного.
Опыт 10. В пробирку внести немного кристалликов ацетата натрия и прибавить 5 – 6 капель 2 н раствора серной кислоты. Определить по запаху, какое вещество образовалось.
Опыт 11. В три пробирки поместить по кусочку меди и прибавить по 5 – 6 капель 2 н растворов кислот: в первую – соляной, во вторую – серной, в третью – азотной. При необходимости нагреть содержимое пробирок. В каких случаях наблюдается химическая реакция и где она более интенсивна?
Опыт 12. В три пробирки поместить по небольшому кусочку магния и прибавить по 5 – 6 капель 2 н растворов кислот: в первую – соляной, во вторую – серной, в третью – азотной.
Получение и свойства солей
Опыт 13. Внести в пробирку 4 – 5 капель раствора сульфата меди (II). Добавить 3 – 4 капли раствора оксалата аммония (NH4)2С2О4. Отметить цвет образовавшегося осадка.
Опыт 14. В пробирку внести 3 – 4 капли раствора соли нитрата свинца (II) и добавить 2 – 3 капли раствора йодида калия. Отметить цвет полученного осадка. К осадку по каплям, помешивая смесь стеклянной палочкой, прибавить избыток раствора йодида калия до полного растворения осадка.
Опыт 15. Внести в пробирку 3 – 5 капель раствора соли магния. Добавить 3 – 5 капель растворов гидрофосфата натрия Nа2НРО4 и 2 – 3 капли 2 н раствора аммиака. Отметить цвет выпавшего осадка.
Обработка экспериментальных данных
Опыт 1. Составить уравнения реакций:
а) взаимодействия сульфата меди (II) с раствором щелочи;
б) разложения гидроксида меди при нагревании;
в) взаимодействия оксида меди (II) с раствором серной кислоты.
Указать цвет осадка и образовавшегося оксида меди (II). Назвать полученные соединения. Сделать вывод о характере полученного оксида меди (II).
Опыт 2. Написать уравнение реакции образования оксида серебра. Указать цвет и характер осадка. Что происходит с осадком после добавления азотной кислоты? Составить уравнение реакции и сделать вывод о характере оксида.
Опыт 3. Составить уравнение реакции взаимодействия оксида кальция с водой. Объяснить появление окраски раствора при добавлении индикатора. Сделать вывод о характере оксида.
Опыт 4. Составить уравнения реакций взаимодействия оксида цинка с соляной кислотой и гидроксидом натрия. Объяснить наблюдаемые явления. Сделать вывод о характере оксида.
Опыт 5. Составить таблицу изменения окраски индикатора в растворе щелочи.
Опыт 6. Написать уравнение реакции, объяснить исчезновение окраски раствора, указать тип реакции.
Опыт 7. Составить уравнения реакций:
а) получения гидроксида магния;
б) растворения гидроксида магния в кислоте.
Сделать вывод о характере полученного гидроксида.
Опыт 8. Сделать вывод о свойствах гидроксида алюминия. Написать:
а) молекулярное и ионное уравнение реакции получения гидроксида алюминия;
б) молекулярные и ионные уравнения взаимодействия гидроксида алюминия с соляной кислотой и гидроксидом натрия.
Указать названия полученных при этом соединений алюминия.
Опыт 9. Составить таблицу изменения окраски индикатора в растворе кислоты.
Опыт 10. Написать молекулярное и ионное уравнение реакции.
Опыт 11. Написать уравнения реакции взаимодействия меди с азотной кислотой, считая, что при этом образуется оксид азота (II). Почему медь не взаимодействует с соляной и серной кислотами?
Опыт 12. Что происходит с магнием? Какой газ выделяется при взаимодействии магния с:
соляной кислотой;
серной кислотой;
азотной кислотой?
Написать уравнения реакций.
Опыт 13. Написать молекулярное и ионное уравнения реакций. Назвать полученные соединения.
Опыт 14. Написать молекулярные и ионные уравнения реакций:
получение йодида свинца (II);
растворение осадка с образованием тетрайодоплюмбата (II) калия (К2[PbI4]).
Опыт 15. Написать уравнения реакций в молекулярной и ионной форме, учитывая, что получается двойная соль MgNH4PO4.
Контрольные задания
Вариант 1
1. Какими свойствами обладает гидроксид кальция и алюминия? Написать реакции, подтверждающие эти свойства. Назвать все соединения.
2. Написать формулы веществ: гидрокарбоната кальция, фосфата аммония, оксида железа (III), гидроксида цинка, серной кислоты, дигидроксохлорида хрома (III).
3. Ангидридом какой кислоты является Р2О5:
фосфористой;
двуфосфорной;
ортофосфорной?
Ответ подтвердить уравнением реакции.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
S → H2S → SO2 → Na2SO3 → Na2SO4 → BaSO4.
Вариант 2
1. Назвать следующие оксиды и определить, к какому типу они относятся: Cl2O7, Cr2O3, FeO. Ответ подтвердить уравнениями реакций. Назвать все соединения.
2. Протекают ли в растворах реакции:
CuSO4 + BaCl2 → BaSO4 + CuCl2;
FeS + K2SO4 → FeSO4 + K2S?
Ответ мотивировать.
3. Какие из гидроксидов могут образовать основные соли: а) NaOH, б) Cu(OH)2, в) Са(ОН)2? Ответ подтвердить уравнениями реакций. Назвать все соединения.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
Mg(OH)2 → Mg(NO3)2 → MgCO3 → MgCl2 → Mg → MgO.
Вариант 3
1. Какие из указанных кислот могут образовать кислые соли: а) H2S, б) H2SO4, в) HNO3? Ответ подтвердить уравнениями реакций. Назвать все соединения.
2. Назвать следующие соединения: SO2, КН2PO4, (MgOH)2SO4, K[Cr(ОH)4(H2O)2], NaNO2.
3. Ангидридом какой кислоты является Cl2О7:
хлорной;
хлорноватой;
хлорноватистой?
Ответ подтвердить уравнением реакции.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
Al → NaAlO2 → Al2(SO4)3 → Al(NO3)3 → Al(OH)3 → Al2O3.
Вариант 4
1. Написать формулы соединений фосфата аммония-магния, оксида марганца (VII), сульфида водорода, гидросульфита бария, карбоната дигидроксохрома (III).
2. Как доказать амфотерный характер Zn, ZnO и Zn(OH)2? Ответ подтвердить уравнениями реакций. Назвать все соединения.
3. Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: SiO2, SO2, SO3, NO2, N2O3? Написать соответствующие уравнения реакций.
4.Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
NO2 → HNO3 → NaNO3 → NaNO2 → NO2 → NaNO3.
Вариант 5
1. Написать реакции превращения хлорида алюминия в основные соли, назвать все соединения.
2. Назвать следующие соединения: Zn(NO3)2, Al(OH)(NO3)2, Fe(OH)2, NaHS, H3BO3, Na2CrO4, СО.
3. Написать формулы оксидов, соответствующих следующим гидроксидам и кислотам: H2SiO3, Fe(OH)3, H3AsO4, Mn(OH)2. Назвать все соединения.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
Na3PO4 → NaCl → Na → Na2O2 → NaOH → Na3PO4.
Вариант 6
1. В сокращенном ионном уравнении
2H+ +? = CO2 + H2O
пропущена формула иона. Написать и назвать этот ион.
2. Ангидридом какой кислоты является Cl2О:
хлорной;
хлорноватой;
хлорноватистой?
Ответ подтвердить уравнением реакции.
3. Какие вещества могут быть получены при взаимодействии кислоты с солью? кислоты с основанием? Написать соответствующие уравнения реакций и назвать все соединения.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
Сa3(PO4)2 → Р → Mg3Р2 → РН3 → Р2O5 → К3PO4.
Вариант 7
1. Ангидридом какой кислоты является SО3:
cероводородной;
сернистой;
серной?
Ответ подтвердить уравнением реакции.
2. Назвать следующие соединения: (NH4)2HPO4, Al(OH)2Cl, KClO3, HNO2, Sn(OH)2, Na2Cr2O7, СО2, NaAlO2.
3. Написать уравнения реакций, свидетельствующих об основных свойствах FeO и Cs2O. Назвать все соединения.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
ВaCl2 → Ba(NO3)2 → BaO → Ba(ОН)2 → BaCl2 → BaSO4.
Вариант 8
1. Написать реакции превращения ортофосфата натрия в кислые соли, назвать эти соли.
2. Ангидридом какой кислоты является N2О5:
азотной;
азотистой;
азотистоводородной?
Ответ подтвердить уравнением реакции.
3. Какие вещества могут быть получены при взаимодействии оксида с кислотой? соли с солью? Написать соответствующие уравнения реакций и назвать все соединения.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
Сa → СаО → Са(ОН)2 → СаСО3 → Са(НСО3)2 → СаСl2.
Вариант 9
1. Написать формулы соединений метахромита натрия, сульфата гидроксоалюминия, гидроарсената натрия, оксида хрома (VI), хлорной кислоты, фосфата кальция.
2. Какое соединение образуется при реакции 1 моль гидроксида цинка и 2 моль ортофосфорной кислоты? Написать соответствующее уравнение реакции и назвать все соединения.
3. Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: СO2, SO2, SO, NO, N2O5? Написать соответствующие уравнения реакций.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
К → К2O → КOH → К3PO4 → КOH → КNO3.
Вариант 10
1. Написать уравнения реакций, доказывающие кислотные свойства SeO2, Mn2O7, CrO3. Назвать все соединения.
2. Ангидридом какой кислоты является N2О3:
азотной;
азотистой;
азотистоводородной?
Ответ подтвердить уравнением реакции.
3. Назвать следующие соединения: Са(H2PO4)2, (Сr(OH)2)2SO4, NaClO, NH4NO2, Sn(OH)4, K2MnO4, SО3.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe → FeCl2.
Вариант 11
1. Какое соединение образуется при реакции 1 моль гидроксида алюминия и 1 моль серной кислоты? Написать соответствующее уравнение реакции и назвать все соединения.
2. Ангидридом какой кислоты является Р2О3:
фосфористой;
двуфосфорной;
ортофосфорной?
Ответ подтвердить уравнением реакции.
3. Написать формулы соединений хромата натрия, гидроксокарбоната хрома (III), гидроксида железа (III), оксида марганца (IV), хлорноватой кислоты, дигидрофосфата аммония.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
SiO2 → Si → Mg2Si → SiH4 → SiO2 → SiF4.
Вариант 12
1. С какими веществами реагирует соляная кислота: а) N2O5; б) Zn(OH)2; в) AgNO3; г) H2SO4? Написать соответствующие уравнения реакций и назвать все соединения.
2. Какое соединение образуется при реакции 1 моль гидроксида натрия и 1 моль оксида углерода (IV)? Написать соответствующее уравнение реакции и назвать все соединения.
3. Назвать следующие соединения: Ba(OCl)2, MgSO4 ∙ 7H2O, К2Н2Р2О7, СrOHSO4, MnO, Н2СО3, SbONO3.
4.Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
Al → Al2O3 → NaAlO2 → Al(OH)3 → Al2O3 → Al.
Вариант 13
1. Как доказать амфотерный характер Al, Al2O3 и Al(OH)3? Ответ подтвердить уравнениями реакций. Назвать все соединения.
2. Ангидридом какой кислоты является SО3:
сероводородной;
сернистой;
серной?
Ответ подтвердить уравнением реакции.
3. Написать формулы соединений сульфида свинца (II), ортофосфата серебра, хлористой кислоты, гидроксосульфата алюминия, гидросульфита алюминия, оксида марганца (VII).
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
Li → Li2O → LiOH → Li2SO4 → LiOH → LiCl.
Вариант 14
1. Назвать следующие оксиды и определить, к какому типу они относятся: BeO, CO2, CaO. Ответ подтвердить уравнениями реакций. Назвать все соединения.
2. Какое соединение образуется при реакции 2 моль гидроксида натрия и 1 моль оксида углерода (IV)? Написать соответствующее уравнение реакции и назвать все соединения.
3. Назвать следующие соединения: Ba(OCl4)2, CuSO4 ∙ 5H2O, CaНРО4, FeOHCO3, SnO2, Н2CrО4, KMnO4.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
Zn → ZnBr2 → Zn(NO3)2 → Zn(OH)2 ® Na2ZnО2 → ZnSO4.
Вариант 15
1. Ангидридом какой кислоты является SО2:
сероводородной;
сернистой;
серной?
Ответ подтвердить уравнением реакции.
2. Какие вещества могут быть получены при взаимодействии кислоты с металлом? соли с основанием? Написать соответствующие уравнения реакций и назвать все соединения.
3. Назвать следующие соединения: Ca(OCl2)2, Na2CO3 ∙ 10H2O, К2НРО4, AlOHCl2, Mn2O7, Н2SiО3, CaCrO4.
4. Осуществить следующие превращения. Уравнения реакций написать в молекулярной и сокращенной ионной формах. Назвать получающиеся вещества.
Р → Сa3P2 → РН3 → Р2O5 → Н3PO4 → NaН2PO4.
Работа 3






