А + В ® С + D
можно выразить различными способами, например:
 или
или 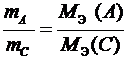 .
.
Если один из участников реакции – газ, а другой – твердый реагент, то формула, выражающая закон эквивалентов, принимает вид
 .
.
В химических расчетах при необходимости осуществить переход от н.у. к другим физическим условиям (или наоборот) используется выражение объединенного га зового закона:
 ,
,
где P 0, V 0, T 0 – давление, объем и температура при н.у.; Р, V, T – те же параметры данного количества газообразного вещества при других условиях.
Если газообразная фаза представляет собой смесь нескольких газов, химически не взаимодействующих друг с другом, то общее давление такой смеси Р можно определить по закону Дальтона:
Р = Р 1 + Р 2 + Р 3 + …,
где Р – общее давление; Р 1, Р 2, Р 3 … – парциальные давления газов 1, 2, 3 ….
Парциальным давлением газа Р i в смеси называется давление, которое производил бы этот газ, если бы при тех же физических условиях он занимал объем всей газовой смеси.
Порядок выполнения работы
Приборы и реактивы: штатив, бюретки, пробка, резиновые трубки, сосуды Ландольта, цилиндр мерный, воронка, бумага фильтровальная, раствор серной кислоты w(H2SО4) = 20 % мас., исследуемый металл, вода дистиллированная, термометр, барометр.
Х о д р а б о т ы
Прибор для определения молярной массы эквивалента металла эвдиометр (см. рис. 1) состоит из двух бюреток, укрепленных в лапках штатива и соединенных резиновой трубкой. Сообщающийся сосуд заполняют водой до половины объема бюреток. К одной из бюреток через отводную трубку присоединяют сосуд Ландольта, который представляет собой двухколенчатую пробирку. В сосуде проводят реакцию между кислотой и металлом. Другая бюретка служит емкостью для приема воды, вытесняемой выделяющимся при реакции водородом.

Рис. 1. Эвдиометр:
1, 2 – бюретки; 3 – сосуд Ландольта; 4 – штатив; 5 – пробка; 6 – резиновые трубки
Объем выделившегося водорода определяют по разности уровней воды в одной из бюреток до и после опыта. Давление газа в закрытой бюретке будет равно атмосферному давлению, если вода в обеих бюретках находится на одном уровне.
Проведение эксперимента
1. Получить у лаборанта навеску исследуемого металла (известно, что валентность металла равна двум). Массу навески записать в таблицу формы 1.
2. С помощью мерного цилиндра отмерить 5 см3 раствора серной кислоты с концентрацией 20 % мас.
3. Взять сухой сосуд Ландольта и в одно из его колен осторожно поместить навеску металла.
4. Перелить отмеренный раствор Н2SO4 в другое колено сосуда Ландольта.
5. Смочить пробку 5 (см. рис. 1) водой и присоединить сосуд Ландольта.
6. Проверить установку на герметичность: отсоединить бюретку 2 (см. рис.1) и переместить её вверх или вниз (уровень жидкости в бюретке 1 должен меняться соответствующим образом).
7. Выровнять уровни жидкостей в обеих бюретках и измерить первоначальный объем воды в бюретке 2 (V 1, см3). Отсчет производить по нижнему мениску жидкости с точностью до 0,1 см3. Значение V 1 записать в таблицу формы 1.
8. Наклонив сосуд Ландольта, прилить кислоту к металлу.
9. Наблюдать выделение водорода и вытеснение воды из бюретки. По окончании реакции, соединив бюретки, как в п.7, измерить конечный объем воды (V 2, см3). Значение V 2 записать в таблицу формы 1.
10. Опыт повторить с другой навеской.
11. С помощью термометра измерить температуру Т, а с помощью барометра определить давление Р в лаборатории. Результаты измерений записать в таблицу формы 1.
Форма 1






