Парообразованием называется переход вещества из жидкого состояния в пар. Парообразование, происходящее при любых температурах с открытой поверхности жидкости, называется испарением.
Явление испарения объясняется тем, что молекулы жидкости обладающие достаточно большой кинетической энергией, преодолевают притяжение соседних молекул и вылетают с её поверхности, что ведёт к уменьшению внутренней энергии жидкости, т. е. ее охлаждению. Обратный процесс перехода пара в жидкость называется конденсацией.
Процессы испарения и конденсации идут одновременно и пар. находящийся в динамическом равновесии с жидкостью, называется насыщенным.
Давление (упругость) насыщенного пара возрастает с повышением температуры. При нагревании жидкости до температуры, при которой давление её насыщенных паров станет равным внешнему (атмосферному) давлению, испарение жидкости будет происходить не только с поверхности, во и во всем её объёме, где начинают возникать пузырьки пара, всплывающие на поверхность и разрывающиеся над ней. Бурное выделение паров изнутри жидкости называется кипением. В течение всего процесса кипения температура остаётся постоянной, если кипение жидкости происходит при постоянном давлении. Чтобы жидкость кипела, необходимо нагреть её до температуры кипения, а затем сообщить добавочное количество тепловой энергии.
Количество теплоты, необходимое для превращения в пар единицы массы жидкости, нагретой до температуры кипения, называется удельной теплотой парообразования – r. При конденсации не происходит понижения температуры пара. При этом выделяется теплота за счёт уменьшения потенциальной энергии молекул вещества[I~И переходе его из одного агрегатного состояния в другое. Количество теплоты, выделяемое в окружающую среду при переходе единицы массы пара в жидкое состояние называется удельной теплотой конденсации. (Удельная теплота конденсации равна удельной теплоте парообразования).
Удельная теплота парообразования r идёт на работу А, совершаемую молекулами при прохождении сквозь поверхностный слой жидкости, и на работу А связанную с увеличением удельного объема V0 вещества при его переходе из жидкого состояния в газообразное: r = А + А’. Толщина поверхностного слоя, в пределах которого на молекулу действуют силы притяжения, равна радиусу молекулярного действия R. Обозначив среднюю силу, действующую на длине этого радиуса молекулярного действия через F, получим выражение для работы вырывания одной молекулой: D А = FR.
Работа А, совершаемая всеми молекулами, находящимися в единице массы жидкости:
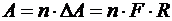
где n – число молекул в единице массы.
Работа расширения 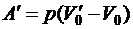 ,
,
где  – удельный объем пара, т.е. объём занимаемый единицей массы пара;
– удельный объем пара, т.е. объём занимаемый единицей массы пара;
V 0 – удельный объём жидкости;
р – давление, при котором происходит кипение.
Тогда 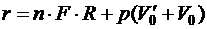
Это соотношение не позволяет непосредственно вычислить значение r так как остаются неизвестными F и R, но оно показывает, что r зависит от той же силы молекулярного взаимодействия F, которая обулавливает и наличие поверхностного натяжения. Для определения удельной теплоты парообразования пользуются калориметрическим методом, для чего составляют на основании опыта уравнение теплового баланса. Установка для такого опыта изображена на рис. 12.
Пар из сосуда В через сухопарник С поступает в калориметр К с водой, где конденсируется, нагревая при этом воду.
Предполагая‚ что тепловой обмен происходит без потери тепла в окружающую среду, можно составить уравнение теплового баланса:

где 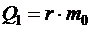 – количество теплоты, отданное паром при конденсации его в жидкость;
– количество теплоты, отданное паром при конденсации его в жидкость;
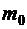 – масса сконденсированного пара;
– масса сконденсированного пара;
 – количество теплоты, выделенное при охлаждении образовавшейся из пара воды от температуры конденсации t1 до температуры смеси t;
– количество теплоты, выделенное при охлаждении образовавшейся из пара воды от температуры конденсации t1 до температуры смеси t;
 – количество теплоты, полученное водой в калориметре при прохождении пара;
– количество теплоты, полученное водой в калориметре при прохождении пара;
 – количество теплоты, полученное калориметром, где с и с1 – удельные теплоемкости воды и калориметра,
– количество теплоты, полученное калориметром, где с и с1 – удельные теплоемкости воды и калориметра,
m 1 и m 2 – масса воды в калориметре и внутреннего сосуда калориметра;
t 0 – начальная температура воды и калориметра;
t – температура смеси.
Подставив значения Q1, Q2, Q3, Q4 в (1), получим
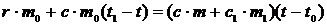 ,
,
откуда
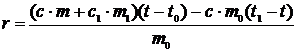 (2)
(2)
Порядок выполнения работы
1. Убедившись, что в кипятильнике В есть вода, нагревают её до кипения.
2. Определяют массу m 1 внутреннего cсосуда калориметра.
3. Наливают в калориметр воды до 3/4 объёма и определяют массу калориметра с водой m 2, тогда масса воды m = m 2 - m 1.
4. Измеряют начальную температуру воды и калориметра t0.
5. После того, как вода закипит и из трубки сухопарника С начнёт выходить пар, опускают конец стеклянной трубки в калориметр на глубину 2—3 см (до интенсивного парообразования под трубкой ставят стакан).
6. Помешивая термометром воду в калориметре, наблюдают затем температурой. После повышения температуры на 5-6°C вынимают стеклянную трубку из калориметра, отставляют его (на его место опять ставят стакан, чтобы вода не капала на стол) и, тщательно перемешивая, отсчитывают максимальную температуру смеси t.
7. Определяют общую массу м3 калориметра с водой и водой, образованной из пара m 0:
m0=m3-m2
8. Определяют удельную теплоту парообразования по формуле (2)
9. Все результаты измерений и вычислений заносят в таблицу.
10. Опыт повторяют ещё раз. Из найденных двух значений < r > находят среднее значение < r >.
Таблица наблюдений
| № | m 1 | m 2 | m | m 3 | m 0 | t 0 | t 1 | t | r | <r> |
| Ед. изм. | кг | кг | кг | кг | кг | 0 С | 0 С | 0 С | 
| 
|
| 1. | ||||||||||
| 2. | ||||||||||
| 3. |
Справочная таблица
| Удельная теплоемкость | вода | с | 4190 
|
| алюминий | с1 | 890 
|
Контрольная вопросы
1. Что называется парообразованием, испарением, кипением, конденсацией?
2. От чего зависит скорость испарения жидкости?
3. Что называется удельной теплотой парообразования?
4. Как зависит температура кипения от внешнего давления?
5. Какой пар называется насыщенным?
6. Объяснить явление испарения и кипения с точки зрения молекулярно-кинетической теории.
7. Почему испарение сопровождается охлаждением, а конденсация выделением теплоты?
8. Почему не повышается температура кипящей жидкости при её нагревании?
9. Выведите формулу для определения удельной теплоты парообразования.






