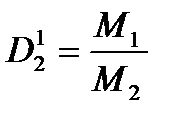1. Напишите хим. знаками металл и кислотный остаток и поставьте над формулами валентность.
2. Найдите наименьшее общее кратное этих валентностей
3. Найдем число атомов металла и число кислотных остатков в формуле. Для этого разделим наименьшее кратное на валентность металла и кислотного остатка.
Например:
1. Сульфат алюминия состоит из алюминия (пишем знак), он имеет валентность ІІІ, и сульфата.Рассуждаем следующим образом: сульфат - это соль серной кислоты, ее формула H2SO4, значит остаток - SO4 (пишем формулу), он имеет валентность II, т.к. в молекуле кислоты 2 водорода, т. е. AlIIISO4II
2. Находим наименьшее валентностей. Общее кратное 2 и 3, это 6.
3. Делим 6 на валентность алюминия и получаем 2 атома, делим 6 на валентность кислотного остатка и получаем индекс 3 для кислотного остатка, т. е. Al2(SO4)3
Между химическими соединениями существует генетическая связь.
Например: Са→ СаО→Са(ОН)2→ СaСl2 – это генетический ряд металла кальция. Все эти вещества можно получить одно из другого с помощью химических реакций. Аналогичные ряды существуют и для других металлов. Но не всегда можно получить оксид при взаимодействии с кислородом или гидроксид из оксида при взаимодействии его с водой. Здесь надо учитывать активность металла. Для этого надо научиться пользоваться рядом металлов. В реакцию с кислородом вступают все металлы, кроме самых «ленивых» - серебра, золота и платины. А в реакцию с водой вступают оксиды только «активных» металлов, т.е. стоящих в ряду до магния. Генетические ряды неметаллов более разнообразны, но в большинстве случаев мы имеем дело с рядом фосфора P→P2O5 →H3PO4 →Mg3(PO4)2, углеродаC→CO2 →H2CO3→NaCO3, или серы S→SO2→ Н2SO3→ Na2SO3.
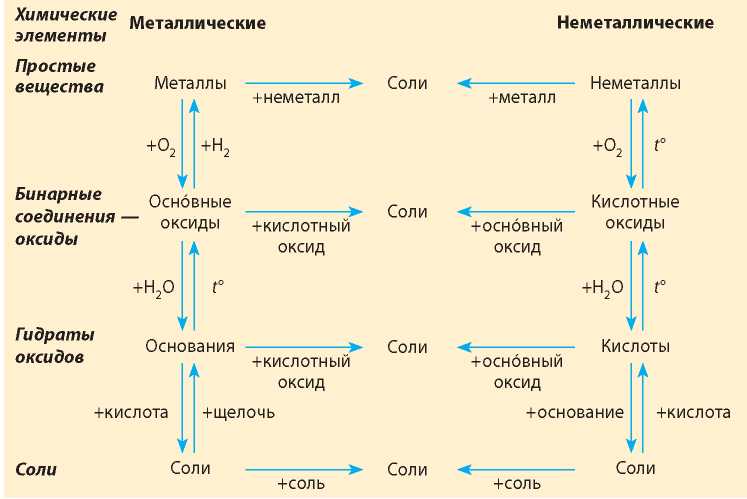
Реакций, в которые могут вступать оксиды, кислоты, основания множество. Но важнейшие из них легко запомнить, потому что вещества обычно реагируют с веществами из противоположного генетического ряда, и при этом образуются соли. Важнейшей из всех этих реакций является реакция нейтрализации – реакция между основаниями и кислотами. ВСЕ основания взаимодействуют со ВСЕМИ кислотами. Остальные реакции протекают в зависимости от активности веществ и их растворимости.
6. Массы атомов и молекул очень маленькие и выражать их в граммах очень неудобно. Но в каких единицах можно измерять их? В настоящее время за атомную единицу массы принята масса 1/12 массы 12С:
1 а.е.м.=1/12 m(12С) = 1,66∙10-24 г
Но на практике мы чаще пользуемся понятием «относительная атомная масса» химического элемента (Аr). Это величина, которая равна отношению средней массы химического элемента к 1/12 m(12С). Здесь граммы сокращаются и поэтому величина становится безразмерной. А понятие «средняя масса химического элемента» используется потому, что почти у каждого химического элемента есть изотопы, т.е. атомы с разной массой и надо учитывать не только их существование, но и распространение этих изотопов в природе. Именно эта «относительная атомная масса химического элемента» указана около каждого химического знака в ПС и является важной характеристикой каждого элемента.
А вот относительную молекулярную массу вещества надо научится рассчитывать по формуле вещества. Молекула состоит из атомов, значит, чтобы найти массу молекулы надо сложить массы всех атомов.
Mr= ∑Ar Например, М r (H2SO4)=2∙Ar(Н)+Ar(S)+4∙Ar(О) = 2+32+4∙16 = 98
Число атомов или молекул в самом малом образце вещества очень велико, и когда надо при расчетах учесть число этих частиц пользуются понятием «количество вещества». Количество вещества - физическая величина, которая определяется числом структурных частиц (молекул, атомов и т.д.), содержащихся в данной порции вещества. Обозначается:  - «ню». Единица количества вещества - моль. Один моль любого вещества содержит одно и то же число структурных частиц. Это число – величина постоянная и равно 6 .1023. Это число названо в честь итальянского химика «постоянная Авогадро»
- «ню». Единица количества вещества - моль. Один моль любого вещества содержит одно и то же число структурных частиц. Это число – величина постоянная и равно 6 .1023. Это число названо в честь итальянского химика «постоянная Авогадро»



Т.к. масса частиц в чистом веществе величина постоянная, то масса 1 моль (т.е. определенного количества частиц) любого вещества тоже величина постоянная и называется «молярная масса». Числовое значение молярной массы равно относительной молекулярной массе, но выражается в г/моль. Например: М r (H2SO4)= 98; M (H2SO4)= 98 г/моль 
7. Объем частиц (размеры) у разных веществ тоже разные. Но газы отличаются от других веществ тем, что расстояние между частицами в сотни раз превышают размеры самих частиц. Поэтому для газов объем определяется не размерами частиц газа, а их количеством этих частиц, т.е.  .
.
Закон Авогадро: в равных объемах разных газов при одинаковых условиях содержится одинаковое число молекул.
Но особое практическое значение имеют следствия из закона Авогадро.
1 следствие т.к. в 1 моль любого газа одинаковое число молекул => 1 моль любого газа при одинаковых условиях занимает одинаковый объем. При нормальных условиях – н.у. (0*С и 1 атм) 1 моль любого газа занимает объем 22,4 л, этот объем называют молярным и обозначают Vmт.е. Vm= 22,4 л/ моль.
Зная количество вещества (ν), легко найти V = ν ·Vm
2 следствие из закона Авогадро: т.к. в одинаковых объемах газов одинаковое число молекул => то для 1 моля любого газаV1= V2= Vm, а массаm1= M1,am2 = M2 (Mвозд.= 29) => относительная плотность газа определяется отношением масс молекул этих газов или их молярных масс, т.е.