ББК Г1я73
О 280
Г. М. Можаев, Н. А. Хритохин, А. В. Кертман, Т. Г. Шиблева. Общая химия: учебно-методический комплекс. Методические указания для студентов I курса направления 020100.62 «Химия». Тюмень: Издательство Тюменского государственного университета. 2014. 50 с.
Учебно-методический комплекс написан в соответствии с рабочей программой курса «Общая химия», читаемого студентам I курса Института физики и химии направления 020100.62 «Химия». Данный выпуск содержит описание занятий, предназначенных для знакомства с основными навыками работы в химической лаборатории: сборкой простейших приборов, приготовлением растворов, методами синтеза, разделения и очистки веществ, их исследованию и определению. Приведены краткие теоретические сведения по некоторым разделам курса, даны контрольные вопросы.
Рабочая учебная программа дисциплины опубликована на сайте ТюмГУ: Общая химия [электронный ресурс] / Режим доступа: http // www. umk 3. utmn. ru свободный.
Рекомендовано к изданию кафедрой неорганической и физической химии. Утверждено первым проректором по учебной работе Тюменского государственного университета.
ОТВЕТСТВЕННЫЙ ЗА ВЫПУСК: О. В. Андреев, зав. кафедрой неорганической и
физической химии, д-р хим. наук, проф.
РЕЦЕНЗЕНТЫ:
Е.А. Турнаева, канд. хим. наук, доцент кафедры общей и специальной химии ТюмГАСУ
Г.Н. Шигабаева, канд. тех. наук, доцент кафедры органической и экологической химии ТюмГУ
© ФГБОУ ВПО Тюменский государственный университет, 2014
© Г. М. Можаев, Н. А. Хритохин, А. В. Кертман, Т. Г. Шиблева, 2014
Лабораторная работа № 1
ПРОСТЕЙШЕЕ ЛАБОРАТОРНОЕ ОБОРУДОВАНИЕ
И ПРАВИЛА РАБОТЫ
Правила работы в лаборатории
Химическая лаборатория относится к помещениям с повышенной опасностью, и при работе в ней следует соблюдать определенные правила. Прежде всего, это относится к организации рабочего места. Во время проведения опытов лабораторный стол следует освободить от ненужных в данный момент книг, тетрадей, убрать личные вещи. Должны быть свободны проходы от Вашего стола к ближайшей раковине, выходу из лаборатории.
Во время лабораторных работ все студенты должны быть в рабочих халатах. При проведении особо опасных работ (с большими количествами концентрированных кислот, растворов щелочей и т.п.) используются резиновые перчатки, фартуки, защитные очки и щитки.
При работе следует избегать попадания химических веществ на кожу: не брать их руками (использовать шпатель), не просыпать, не проливать, просыпанное и пролитое незамедлительно убирать. С дурно пахнущими или летучими ядовитыми веществами нужно работать в вытяжных шкафах при включенной тяге. Посуду из-под таких веществ следует мыть там же.
В химической лаборатории запрещается пить, принимать пищу. Не следует просто заносить и держать открытыми в лаборатории продукты питания.
Каждый работающий в лаборатории должен знать, где в этой лаборатории находится главный рубильник, как включается и выключается тяга, где расположены и как приводятся в действие противопожарные средства, где находятся средства первой помощи при несчастных случаях (аптечка) и как их применять.
Меры предосторожности при работе в химической лаборатории
1. Работать в химической лаборатории разрешается только в специальной одежде – халате.
2. Растворы и реактивы для химических реакций необходимо брать в минимальном количестве, как указано в описании.
3. Взяв реактив для опыта, следует внимательно прочитать этикетку (надпись) и в случае сомнения обратиться к преподавателю или лаборанту, использовать растворы и реактивы без надписей запрещается.
4. Запрещается выполнение опытов в грязной посуде.
5. При переносе химического стакана с горячей жидкостью необходимо стакан держать обеими руками, положив под дно стакана полотенце.
6. Все опыты с ядовитыми, неприятно пахнущими веществами, а также упаривание кислот и кислых растворов производится только в вытяжном шкафу.
7. Запрещается исследовать свойства веществ без разрешения преподавателя, а также пить воду из химической посуды.
8. При работе с металлическим натрием и другими щелочными металлами следует остерегаться влаги. Обрезки щелочных металлов сдавать лаборанту и ни в коем случае не бросать в банки для мусора.
9. При нагревании растворов в пробирке всегда следует держать ее таким образом, чтобы отверстие пробирки было направлено в сторону от работающего и его соседей по рабочему столу.
10. Не наклоняться над сосудом с нагреваемой жидкостью, т.к. иногда ее может выбросить из сосуда,
11. При сливании реактивов не наклоняться над сосудом, во избежание попадания брызг или частиц на лицо или одежду.
12. Не следует вдыхать пахучие вещества, в том числе и выделяющиеся газы, близко наклоняясь к сосуду с этими веществами. Следует легким движением руки направить струю воздуха от отверстия сосуда к себе и осторожно вдохнуть.
13. При разбавлении концентрированных кислот, особенно серной, вливать кислоту в воду, а не наоборот. Если на лицо или руки попадут брызги кислоты, надо тотчас же смыть их водой, после чего промыть пораженное место разбавленным раствором соды.
14. При работе с твердыми щелочами (измельчение крупных кусков, наполнение щелочью осушительных колонок и т. д.) обязательно надевать защитные очки. Брать щелочь разрешается только шпателем, щипцами или пинцетом. При попадании щелочи на руки или лицо, ее смывают водой до тех пор, пока пострадавший участок кожи не перестанет быть скользким, затем промыть слабым раствором уксусной кислоты.
15. В случае ожога (пламенем или нагретыми предметами) обожженное место смочить концентрированным раствором КМnО4 так, чтобы кожа побурела, или же использовать средства от ожогов, имеющиеся в аптечках.
16. При отравлении хлором, бромом, сероводородом, оксидом углерода (II) необходимо вывести пострадавшего на воздух, а затем обратиться к врачу.
17. Перед уходом из лаборатории привести в порядок рабочее место, отключить электронагревательные приборы и воду.
Простейшее лабораторное оборудование
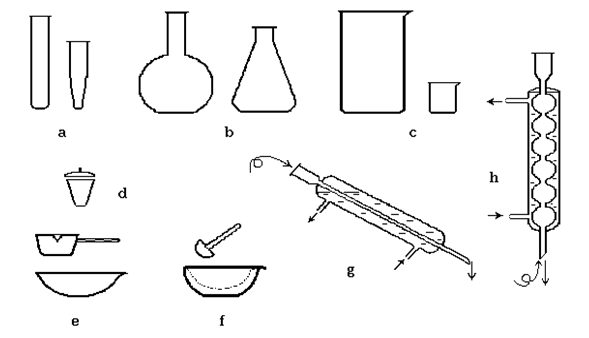
Познакомьтесь с представленным оборудованием, запишите название и применение (см. рис. 1).
Пробирки (рис. 1а) - применяются для проведения реакций с небольшими количествами веществ. Кроме обычных, используют также конические пробирки. При нагревании веществ в пробирке применяют пробиркодержатели.
Колбы (рис. 1b) - для проведения реакций с большими (до нескольких литров) количествами веществ. Бывают различных размеров и форм: плоскодонные, круглые и конические (колбы Эрленмейера); круглодонные. Специальные колбы: колба Вюрца – круглодонная, с боковым отводом (рис. 2а) – для перегонки жидкостей, реакций с выделением газов; колба Бунзена – коническая, толстостенная (рис. 6b) для фильтрования при пониженном давлении и другие.
|
| Рис.1. Лабораторная посуда. Холодильники |
Стаканы (рис. 1с) - применяются в том случае, если реакционную смесь нет необходимости закрывать, для приготовления растворов. Могут быть тонко- и толстостенные, различной термостойкости. Следует помнить, что толстостенная посуда (стаканы, колбы, склянки) не термостойка и не может применяться, если реакция проводится при нагревании или сопровождается выделением большого количества тепла.
Фарфоровые чашки (рис. 1е) - обычно применяются для выпаривания растворов, высушивания веществ, они тонкостенные, термостойкие, но хрупкие. Для проведения реакций при очень высокой температуре используют фарфоровые тигли (рис. 1d).
Ступки (рис. 1f) - для растирания веществ. Они толстостенные, прочные, но не термостойкие, их нельзя использовать для нагревания. При измельчении веществ пестиком не ударяют по кускам вещества, а растирают их вращательными движениями.
Лабораторный штатив служит для сборки достаточно сложных приборов. Для закрепления отдельных частей прибора применяют различные лапки и кольца, при этом следует соизмерять прилагаемые усилия и прочность детали, часто стеклянной. Зажимая лапку штатива, не следует стараться сделать это «намертво», лучше, если деталь прибора проворачивается в лапке с небольшим усилием. Чтобы защитить стекло, используют прокладки из резины, асбестовой нити, в крайнем случае, можно свернуть ее из листа бумаги.
Сборка приборов
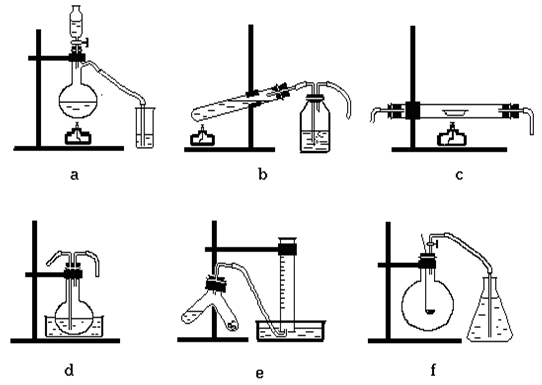
Познакомьтесь с основными правилами сборки приборов и соберите один из приборов по указанию преподавателя. Проверьте прибор на герметичность. Собранный прибор зарисуйте в тетради, подпишите названия его деталей (см. рис. 2).
При сборке приборов отдельные его детали соединяют между собой, как правило, с помощью резиновых пробок и трубок. При этом нужно учитывать, что некоторые вещества (например: хлор, бром, концентрированные серная и азотная кислоты) способны разрушать резину. В таких случаях используют другие материалы, или соединяют стеклянные детали непосредственно друг с другом на шлифах.
Чтобы избежать травм, при сборке приборов нужно придерживаться определенных правил. Так, концы стеклянных трубок должны быть ровными, их грани следует оплавить или закруглить напильником. Стеклянную трубку смачивают небольшим количеством глицерина и вставляют в трубку или в отверстие пробки, не прилагая чрезмерных усилий. Стеклянную деталь держат при этом как можно ближе к месту соединения.
|
| Рис. 2. Простейшие приборы для работы с газами |
Когда вставляют пробку в горлышко колбы, нельзя ее дно упирать в стол, пробка вставляется ввинчивающим движением, усилия нужно соизмерять с толщиной стенок колбы или пробирки. Наоборот, чтобы вынуть пробку, ее осторожно покачивают из стороны в сторону.
Для надежного соединения пробки и трубки должны соответствовать по своим размерам стеклянным деталям. Подрезание большой пробки или обматывание ее изолентой приведет к тому, что прибор будет негерметичен. Для проверки герметичности приборов обычно опускают его газоотводную трубку в стакан с водой и согревают какую-то часть прибора хотя бы руками. Если при этом из трубки начинают выделяться пузырьки воздуха – прибор герметичен.
Зарисовка прибора. Умение зарисовать прибор, установку, на которой был проведен эксперимент, – это важное качество специалиста-химика. Это должен быть аккуратный технический рисунок, правильно передающий устройство прибора, соотношение размеров его составных частей, их соединение друг с другом. Незначимые подробности при этом опускают, все детали показывают расположенными в одной плоскости, избегая пересечения на рисунке трубок.
Содержащиеся в приборе при проведении реакции вещества показывают различной штриховкой. Отдельные детали рисунка помечают буквами и приводят надписи, объясняющие их. Размер рисунка должен быть оптимальным, 1/4-1/2 страницы в зависимости от его сложности.
а) Прибор для получения газа (капельная воронка, резиновая пробка, колба Вюрца, газоотводная трубка, стеклянный наконечник).
b) Прибор для получения и очистки газа (большая пробирка, пробка, газоотводная трубка, промывалка, газоотводная трубка).
c) Прибор для реакции газа с твердым веществом (стеклянная трубка, закрытая с двух сторон пробками с газоотводными трубками).
d) Прибор для реакции газа с жидкостью при охлаждении (колба с пробкой, в которую пропущены газоподводящая и газоотводная трубка, кристаллизатор с холодной водой).
е) Прибор для получения газа и собирания его методом вытеснения воды (двухколенная пробирка Ландольта – Оствальда, пробка, газоотводная трубка, кристаллизатор, цилиндр).
f) Прибор для сжигания веществ (круглодонная колба, пробка, газоотводная трубка с краном, ложечка для сжигания).
Нагревательные приборы
Спиртовка. Вспомните и запишите основные правила обращения со спиртовкой. Запрещается переносить зажженную спиртовку с одного рабочего места на другое, зажигать одну спиртовку от пламени другой!
Электроплитка. Проверяйте целостность изоляции электропроводов перед включением прибора в сеть!
Водяные, песчаные, воздушные и другие бани применяются для более равномерного нагрева и представляют собой емкости, заполненные водой, песком, воздухом или др., в которые опускаются нагреваемые объекты.
Охлаждение
Водяные холодильники – предназначены для охлаждения паров жидкостей, могут быть прямые (холодильник Либиха, рис. 1g) и обратные (шариковые – рис. 1h).
Охлаждающие бани: с холодной водой, ледяные (вода + лед), с охлаждающими смесями (например: лед + соль).
Оборудование и реактивы: На каждое рабочее место: Лабораторный штатив, лапка, кольцо, асбестированная сетка, пробиркодержатель, пробирки, колбы разные, стакан, фарфоровая чашка, ступка с пестиком, спиртовка, детали для сборки одного из приборов.
Лабораторная работа № 2
ВЕСЫ. ВЗВЕШИВАНИЕ
Одним из важнейших измерений в химии является измерение масс веществ. Для этого применяются разнообразные по конструкции и точности измерения весы. В настоящее время все большее употребление находят весы лабораторные электронные. Их используют для взвешивания до 200-500 г вещества с точностью не более 0.1 - 0.01 г.
Такой точности достаточно для большинства лабораторных работ, связанных с синтезом веществ. Для точных работ, химического анализа веществ используют аналитические весы, точность измерения на которых 0.0001 г и более. Они более сложны по устройству, защищены от колебаний воздуха. К работе с аналитическими весами студенты допускаются после дополнительного инструктажа.
Для работы с механическими весами применяются разновесы - наборы гирь различной массы. Чтобы избежать загрязнения разновесов, рекомендуется брать их пинцетом. Нельзя помещать гирьки куда-нибудь, кроме футляра и чашки весов. Аналитические механические весы, как правило, имеют встроенный разновес, устройство для помещения его на коромысло, шкалу с подсветкой.
Порядок работы на лабораторных электронных весах.
1. Проверьте установку весов. Они должны стоять без перекосов (по уровню, если имеется).
2. Включите весы в сеть, нажмите кнопку включения питания. Спустя несколько секунд на шкале высветится «0.00 г». Весы готовы к работе.
3. Взвешивание предметов (стаканов, колб). Осторожно поставьте предмет на чашку весов, дождитесь постоянного значения на табло. Не опирайтесь на стол в процессе взвешивания. Запишите значение.
4. Взвешивание заданной порции вещества ("взятие навески"). Вещества взвешивайте только в таре (стаканчик; бюкс (стаканчик с притертой крышкой); колба; лист бумаги, лучше кальки).
5. На чашку весов поместите тару, после установления значения нажмите кнопку «Тара» - показания весов обнуляются. Осторожно добавляйте в тару вещество до нужного значения на шкале.
Взвешивание контрольного образца
Познакомьтесь с представленной моделью весов, выясните назначение кнопок, проверьте их установку. Получите у преподавателя контрольные образцы для взвешивания и взвесьте их (п. 3). Запишите в тетради номера образцов и их массы и проверьте результат у преподавателя, рассчитайте относительную ошибку.
Взятие навески вещества.
Подготовьте тару (листочки бумаги) для взвешивания вещества. Отвесьте по заданию преподавателя 3-20 г вещества (п. 4-5). Навеску заверните в пакет, подпишите и сдайте преподавателю.
Технохимические весы
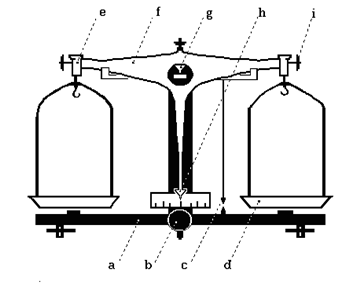
Технохимические весы (рис. 3) состоят из основания (а), снабженного уровнем или отвесом (с), коромысла (f), сережек (e), к которым подвешены чашки весов (d), и арретира (b) – устройства, выключающего весы и, тем самым, предохраняющего их от преждевременного изнашивания. На коромысле весов закреплены три призмы. В рабочем состоянии коромысло опирается центральной призмой (g) на стальную пластинку, а на двух других призмах подвешены сережки с чашками.
|
| Рис. 3. Технохимические весы |
К коромыслу прикреплена стрелка весов (h), позволяющая судить о том, находятся ли весы в равновесии. В выключенном (арретированном) состоянии центральная призма не должна касаться опоры, а чашки находятся на основании весов. При любой предварительной работе с весами (установка, насыпание веществ, добавление или снятие гирек) весы должны быть выключены!
Порядок работы на технохимических весах
1. Установка весов. Поставьте весы перед собой так, чтобы удобно было работать. Вращая винты основания весов, установите их по отвесу или уровню. Проверьте чистоту чашек и правильность сборки весов: сережки должны находиться на боковых призмах, при включении весов стрелка или чашки не должны касаться основания.
2. Уравновешивание весов. Если после включения стрелка весов отклоняется в правую и левую сторону на одинаковое число делений - весы уравновешены. Если это не так, их уравновешивают, используя калибровочные винты коромысла (рис. 3i). Можно уравновешивать весы, нагружая более легкую чашку (например, кусочками бумаги).
3. Подготовка тары. Химические вещества нельзя непосредственно помещать на чашку весов. Для этого используется разнообразная тара: стаканчики, бюксы (стаканчик с притертой крышкой), колбочки и т. п. Во многих случаях в качестве тары используют листки бумаги (лучше лощеной или кальки). Понятно, что эта тара должна быть предварительно взвешена. Вместо взвешивания тары можно уравновесить ее, поместив, например, на обе чашки весов одинаковые листки бумаги.
4. Взвешивание веществ и предметов. Взвешиваемый предмет помешают на левую чашку весов, на правую устанавливается гирька разновеса (рекомендуется идти от более крупных к мелким гирькам). Кратковременно включают весы и определяют, какая чашка перетягивает. Выключают весы и, либо добавляют следующую гирьку, либо предыдущую убирают и ставят более легкую. Так, постепенно переходят к все более мелким разновесам и добиваются уравновешивания весов. Затем пересчитывают разновесы на правой чашке, записывают массу предмета, после чего разгружают весы и разновесы убирают в футляр.
5. Взвешивание заданной порции вещества («взятие навески»). На правую чашку весов помещают тару и уравновешивают весы. На левую чашку помещают разновес необходимой массы. Затем насыпают порцию взвешиваемого вещества и, кратковременно включая весы, определяют, какая чашка легче. Весы выключают. Если легче чашка с веществом, добавляют следующую порцию; в противном случае отбирают часть вещества на ложечку, шпатель и снова включают весы. Окончательно добиться уравновешивания можно осторожным стряхиванием вещества со шпателя при включенных весах. Затем весы выключают и разгружают.
Аналитические весы
Взвешивание на аналитических весах является одной из самых важных операций химического анализа, требующей точного исполнения. Результаты анализа зависят от точности взвешивания.
Правильность и воспроизводимость
Правильность и воспроизводимость точного взвешивания на аналитических весах характеризуются соответственно ошибкой взвешивания и недостоверностью единичного взвешивания. Например, если абсолютная ошибка единичного взвешивания 0,0001, то абсолютная недостоверность также равна 0,0001г.
На аналитических весах можно взвешивать различные образцы с массой не более 200 г. Точность взвешивания на аналитических весах составляет 0,0002 г.
Конструкция весов.
Коромысло. Коромысло включает три агатовые призмы, которые лежат в одной плоскости. Коромысло опирается на агатовую пластинку средней призмы и колеблется относительно точки соприкосновения этой призмы с пластинкой. Агатовая пластинка не является частью коромысла. Она устанавливается сверху на опорной колодке.
Стрелка. Точку равновесия весов определяют по положению оптической шкалы, находящейся на нижнем конце стрелки весов. Оптическая шкала располагается перед микрообъективом оптической системы и проецируется на экран. Подвижная световая шкала должна остановиться на делении 0.
Чашки. Взвешиваемые объекты и гирьки кладут на чашки, которые являются частью коромысла. Обе чашки подвешиваются на серьгах, которые соединены с призмами. Если весы находятся в нерабочем положении, то с помощью арретира призмы и чашки разъединяются.
Арретир поднимает серьги, при этом призмы не касаются опорных площадок. Весы в нерабочем состоянии называются арретированными.
Призмы. Призмы делают из очень твердого материала – агата. Это обеспечивает долговечность работы призм. Точность взвешивания зависит от того, насколько остро отточены ребра всех трех призм и насколько хорошо отполированы поверхности, с которыми они соприкасаются. При работе весов призмы и опорные площадки постепенно изнашиваются и точность взвешивания понижается. Чтобы изнашивание было как можно меньшим, весы снабжены арретиром. Особенно сильно весы изнашиваются от резких толчков и движений, т.к. агат очень хрупкий материал и легко ломается от механического удара. Поэтому при работе с аналитическими весами необходима крайняя осторожность, в частности, нельзя прикасаться к неарретированным весам. В соответствии с этим помещать на чашки весов и снимать взвешиваемый предмет и разновески можно только предварительно арретировав весы. Следует избегать резких толчков и при самом арретировании весов. Диск арретира поворачивают медленно. Чтобы избежать резких ударов, весы открывают полностью только тогда, когда взвешиваемый объект достаточно точно уравновешен с гирьками.
Набор гирь, необходимых для взвешивания на аналитических весах, называются аналитическим разновесом. Разновески помещают в специальный ящик, где находится также пинцет, при помощи которого берут разновески, кладут их на чашки весов и снимают. Пинцет, которым берут разновески, должен быть снабжен роговыми кончиками. Прикосновение руками к разновескам ни в коем случае не допускается. Во избежание коррозии, а следовательно – изменения массы, разновески покрыты слоем золота, платины, никеля. Разновески расположены в ящике в определенном порядке. По окончании взвешивания каждую разновеску следует обязательно класть в предназначенное для нее гнездо ящичка. Строгое соблюдение этого правила позволяет работающему контролировать правильность подсчета разновесок, который проводят сначала по пустым гнездам в ящике, а затем проверяют при снятии разновесок с весов. Такой контроль крайне необходим, так как всякая ошибка, допущенная при подсчете разновесок, делает негодным весь анализ.
Аналитические разновесы имеют следующий набор гирь: граммы 100, 50, 20, 10, 10, 5, 2, 2, 1, комбинируя которыми можно получить любую массу от 0 до 200 г.
Обращение с аналитическими разновесами должно быть очень аккуратным. В нерабочем состоянии футляр должен быть закрыт.
Правила пользования весами:
- перед каждым взвешиванием необходимо проверить состояние весов и установить их по уровню в горизонтальное положение;
- нельзя прикасаться к неарретированным весам. Класть взвешиваемый предмет и разновески на чашки весов или снимать с них следует, предварительно арретировав весы. Открывать весы надо медленно и плавно, чтобы не повредить призмы;
- нельзя сдвигать весы с занимаемого места;
- нельзя нагружать весы сверх установленной предельной нагрузки (обычно 200 г.), так как это вызывает их порчу. В сомнительных случаях необходимо предварительно взвесить предмет на технических весах и только после этого приступить к взвешиванию на аналитических весах;
- взвешиваемый предмет берут щипцами или чистой бумагой и кладут на левую чашку весов, а разновески – на правую. Гирьки и взвешиваемый предмет кладут на середину чашек;
- при взвешивании гирьки следует брать только пинцетом и возвращать их в соответствующие гнезда в футляре;
- нельзя взвешивать на аналитических весах горячие (или слишком холодные) предметы. Взвешивать тело следует только тогда, когда оно примет температуру окружающего воздуха, иначе взвешивание будет неточным;
- взвешиваемое вещество нельзя помещать непосредственно на чашку весов. Порошки, соли металлов и т. п. взвешивают только в легкой стеклянной таре (стаканчики, бюксы) или на часовом стекле, если вещество негигроскопично и устойчиво на воздухе. Рассыпанные вещества сразу сметают мягкой щеткой;
- гигроскопичные вещества, а также жидкости, особенно выделяющие едкие, действующие на весы пары, следует взвешивать в герметически закрытых сосудах.
Весы лабораторные равноплечие модели ВЛР-200
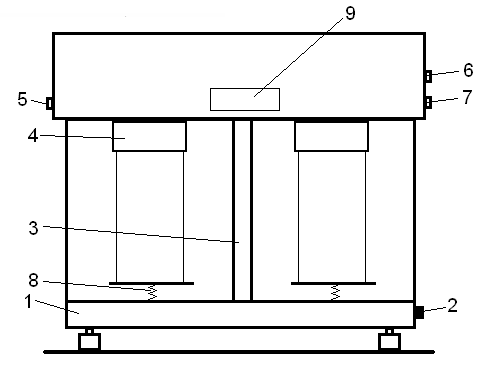
Весы состоят из следующих основных узлов: основания, коромысла со стрелкой, серег с подвесками, успокоителей колебания коромысла, гиревого механизма, арретира, оптического устройства, делительного устройства, выносного трансформатора (рис. 4).
Корпус состоит из основания (1), прямоугольной полой стойки (3), задней металлической стенки, переднего и боковых стекол. Воздушные успокоители колебаний коромысла (4) состоят из двух корпусов – верхнего и нижнего.
|
| Рис. 4. Схема аналитических весов модели ВЛР-200 |
При помощи гиревого механизма ручкой (6) производится наложение (или снятие) встроенных гирь (в сотнях миллиграммов). Включение весов производится поворотом любой из ручек арретира (2) в верхнее положение. При повороте ручек в нижнее положение происходит изолирование коромысла и серег, одновременно пружинные арретиры (8) касаются чашек.
Оптическое устройство предназначено для проецирования изображения шкалы на экран (9). Для снятия отсчета по шкале на экране имеется отметка в виде двух треугольников. Регулирование нулевого положения шкалы производится ручкой (5).
Делительное устройство позволяет снимать отсчет на весах с точностью до 0,05 мг, отчет снимается с диска в правом окне экрана. Диск делительного устройства разделен на 20 частей, которые обозначены оцифровкой от «0» до «95» через 5 единиц; полный оборот диска соответствует изменению отсчета по шкале на одно деление (1 мг). Установка отсчета производится ручкой (7).
На экране (9) снимаются отсчеты по лимбу гиревого механизма, по шкале и по диску делительного устройства. Если, например, на левом окне экрана установилась цифра 6 лимба гиревого механизма, а на центральном окне – отметка числа 25 шкалы и число 35 в окне делительного устройства, то суммарный отсчет на экране будет ранен 625,35 мг (или 0,62535 г).
Установка весов по уровню производится вращением регулировочных ножек в основании весов.
Питание весов осуществляется от сети переменного тока напряжением 220 В через выносной трансформатор Включение или выключение подсветки шкалы производится микровыключателем при включении или выключении весов ручками (2).
Порядок работы
Перед началом работы ручкой (7) установите на отметку «0» делительного устройства и ручкой (5) введите нулевую отметку шкалы в отсчетную отметку экрана.
В изолированном положении весов поместите взвешиваемый груз на левую чашку весов и уравновесьте его накладными гирями из разновесов и встроенными гирями, навешивая их ручкой (6) на правом плече коромысла. Поворотом ручки (2) введите весы в рабочее положение. Если после включения весов изображение шкалы не попадает на экран, то, дополнительно накладывая (или снимая) накладные гири и навешивая (или снимая) гиревым механизмом встроенные гири, выведите изображение шкалы на экран. Снимите отсчет, как указано выше.
Наложение или снятие накладных и встроенных гирь производите только в изолированном положении весов.
Введение весов в рабочее положение во избежание раскачивания подвесок производите плавным поворотом ручки (2), при этом дверцы витрин должны быть закрыты.
Взвешивание. Взятие навески
Взятие навески. Навеска – это часть образца твердого тела или жидкости, отбираемая для количественного анализа компонентов в анализируемом веществе. Существует несколько способов взвешивания твердых образцов и жидкостей.
Взвешивание твердых образцов в бюксах
Бюксы – это стаканчики с пришлифованной крышкой.
Твердый образец взвешивают в бюксе, определяя его массу по разности. Такой способ взвешивания рекомендуется для соединений, расплывающихся на воздухе, и при определении кристаллизационной воды в кристаллогидратах. Бюкс следует держать с помощью бумажной петли, т.к. влага с пальцев может оказать влияние на массу бюкса и послужить причиной ошибки.
При определении массы по разности сначала взвешивают бюкс с образцом и записывают результат в тетрадь. Затем, из бюкса с помощью чистого шпателя в градуированный стакан или мерную колбу переносят некоторое количество анализируемого образца, приблизительно равное требуемой навеске.
Чтобы оценить, насколько это количество соответствует навеске, бюкс с оставшимся веществом взвешивают с точностью до 50 мг. Если необходимо, отсыпают еще некоторое количество образца и вновь взвешивают бюкс. Когда из бюкса отсыпано достаточное количество анализируемого вещества, бюкс еще раз взвешивают с точностью до 0,0001 г и вновь записывают результат. Полученную навеску рассчитывают по разности начальной и конечной массы бюкса с веществом.
Взвешивание твердого образца на часовом стекле
Для взвешивания рекомендуют применять стекла диаметром 4-5 см. Точно взвешивают часовое стекло. Чистым шпателем помещают такое количество анализируемого вещества, которое соответствует требуемой навеске. Часовое стекло с образцом взвешивают с точностью до 0,0001 г и записывают результат. Образец аккуратно переносят в стакан или мерную колбу, счищая остатки вещества кисточкой.
Взвешивание вещества на кальке или бумаге, покрытой полиэтиленовой пленкой
Сначала взвешивают только бумагу, после этого на нее чистым шпателем насыпают образец и взвешивают бумагу вместе с образцом. По разности результатов взвешивания определяют величину навески. Этот метод пригоден для взвешивания веществ, не поглощающих влагу из воздуха.
Взвешивание твердого вещества в весовой пробирке
Весовая пробирка емкостью 2-3 мл должна быть небольшой массы и хорошо закрываться корковой или небольшой резиновой пробкой. Сначала взвешивают весовую пробирку с образцом с точностью до 0,0001 г. Затем отсыпают из пробирки в стакан некоторое количество вещества, приблизительно равное требуемой навеске, а весовую пробирку с остатками анализируемого вещества вновь точно взвешивают. Навеску рассчитывают по разности массы весовой пробирки до и после отсыпания. Такой метод называется методом отсыпания.
Взвешивание жидкостей
Большинство жидкостей можно взвешивать в небольших бюксах, снабженных медицинскими пипетками и притертыми стеклянными крышками. Аккуратно взвешивают бюкс с образцом и пипеткой и записывают результаты. С помощью пипетки часть жидкости отливают в мерную колбу или стакан. Бюкс закрывают крышкой, следя за тем, чтобы капли жидкости не попали на матовую поверхность бюкса. Когда масса образца жидкости, измеряемая с точностью до 50 мг, становится близкой величине требуемой навески, бюкс с пипеткой и анализируемое вещество взвешивают с точностью до 0,0001 г и результат вновь записывают в тетрадь. По разности результатов определяют величину взятой навески.
Эксикаторы
Нагретые или прокаленные вещества при охлаждении могут поглощать влагу из окружающего воздуха. Чтобы не допустить этого, охлаждение проводят в эксикаторах. Эксикатор – это толстостенный стеклянный сосуд, закрываемый крышкой. Перед взвешиванием образец должен остыть в эксикаторе не менее 30 мин.
Чтобы в эксикатор не попала влага, соприкасающиеся поверхности эксикатора и крышки смазывают тонким слоем вазелина. Открывая или закрывая эксикатор, крышку следует сдвигать в сторону (или надвигать сбоку), а не поднимать. Перенося эксикатор с места на место, крышку надо придерживать рукой, т.к. она может соскользнуть и упасть.
Каждый раз перед использованием эксикатор заполняют свежей порцией водопоглощающего реагента. Над поглотителем устанавливается фарфоровая вкладка с отверстиями для тиглей.
Оборудование и реактивы. Весы, разновесы, шпатели, контрольные образцы для взвешивания (15 шт.), дихромат калия.
Лабораторная работа № 3
ИЗМЕРЕНИЕ ОБЪЕМА И ПЛОТНОСТИ
Порции жидких и газообразных веществ часто отмеривают по объему. При этом надо учитывать, что объем тел зависит от внешних условий (давление, температура), и для определения массы, количества вещества потребуется данные о плотности при тех же условиях.
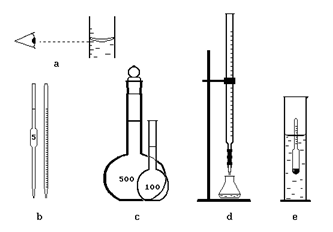
Для измерения объемов используется разнообразная мерная посуда (рис. 5): мерные цилиндры, мензурки, пипетки, бюретки, мерные колбы. Поскольку объем жидкости (и объем мерной посуды) зависит от температуры, на стенках посуды указана температура, при которой она отградуирована, ее необходимо придерживаться при точных измерениях.
Верхняя граница жидкости (мениск), по которой производится измерение, не является плоской. В большинстве случаев отсчет ведут по нижнему краю мениска. При этом глаз наблюдателя должен находиться в той же плоскости (рис 5а), иначе измерение будет неточным.
|
| Рис. 5. Мерная посуда для измерения объемов |
Измерение объема с помощью мерного цилиндра
Мерные цилиндры - цилиндрические стеклянные сосуды со шкалой, применяются для грубого измерения объема.
Рассмотрите выданный Вам цилиндр, определите, на какой объем и температуру он рассчитан, цену деления шкалы. Все характеристики занесите в тетрадь. Налейте в цилиндр произвольное количество воды и потренируйтесь в определении объема, проверяя друг друга.
Измерьте объем стакана или колбы. Для этого заполните сосуд доверху водой и, переливая ее в мерный цилиндр (если понадобится - несколько раз), определите ее объем. Полученные данные запишите в тетрадь и проверьте у преподавателя. Зарисуйте в тетради положение мениска жидкости и глаза наблюдателя при измерении объема.
Измерение объема с помощью мерной пипетки
Мерные пипетки - стеклянные трубки с оттянутым нижним концом, иногда имеют расширение в средней части (пипетка Мора, рис. 5b). В верхней части имеется метка, до которой набирается жидкость. Если в нижней части метки нет, значит, пипетка рассчитана на полное выливание жидкости, в противном случае ее выливают, пока мениск жидкости не коснется нижнего деления. Применяются и градуированные пипетки, позволяющие отмерить любой промежуточный объем жидкости.
Для набирания жидкости в пипетки используют резиновые груши или специальные приспособления типа шприца. Категорически запрещается засасывать жидкость в пипетки ртом, особенно при работе с концентрированными растворами кислот и щелочей, растворами ядовитых веществ!
Жидкость набирают выше верхнего деления, закрывают отверстие пипетки указательным пальцем, и, подняв ее так, чтобы деление было на уровне глаз, выпускают избыточную жидкость, чуть приоткрывая пипетку. Затем переносят пипетку в рабочую колбу и выпускают жидкость до нижнего деления или дают ей вытечь полностью. Нельзя вытряхивать или выдувать остающиеся в пипетке капли жидкости!
Рассмотрите пипетки на вашем рабочем столе. Запишите в тетрадь их характеристики (объем, рабочую температуру, цену деления для градуированных пипеток). Используя воду в качестве измеряемой жидкости, потренируйтесь в отмеривании ее объемов с помощью пипетки.
Измерение объема с помощью бюретки
Бюретки - стеклянные трубки с оттянутым нижним концом, снабженные краном или резиновой трубкой с шариком, которые позволяют постепенно выпускать жидкость (рис. 5d). На трубке нанесена шкала, с помощью которой измеряется объем вытекшей жидкости.
Рассмотрите бюретку на вашем рабочем столе. Запишите в тетрадь ее характеристики (полный объем, рабочую температуру, цену деления). Заполните бюретку водой, добейтесь заполнения стеклянного кончика. Доведите объем воды в бюретке до нулевого деления. Потренируйтесь в выливании жидкости по отдельным каплям и струей, измерении объема вытекшей воды.
Ареометр. Измерение плотности
Ареометр представляет собой стеклянный поплавок, в верхней части которого помещена шкала. В момент измерения ареометр должен свободно плавать в жидкости, при этом мениск должен находиться в границах шкалы (рис. 5е). Если ареометр тонет в жидкости или плавает слишком высоко, следует его заменить на более легкий или более тяжелый. Жидкость обычно наливают в мерный цилиндр или высокий стакан, ее температура должна соответствовать рабочей.
Рассмотрите выданные Вам ареометры, запишите пределы определения каждого, рабочую температуру и определите цену деления.
Ополосните мерный цилиндр выданным раствором, налейте в него примерно 100 мл раствора. Осторожно опускайте ареометры в раствор (начиная с самого легкого) и измерьте плотность по делению, которого касается нижний край мениска. При этом ареометр не должен касаться стенок цилиндра. Результат запишите и проверьте у преподавателя.
После измерения ареометр сполосните водой и протрите фильтровальной бумагой, раствор слейте обратно в бутыль.
Оборудование и реактивы. На каждый стол: лабораторный штатив, лапка с бюреткой, мерные пипетки, груши для наполнения пипеток, цилиндры, ареометры, растворы для измерения плотности, пронумерованные стаканы или колбы известного объема.
Лабораторная работа № 4
МЕТОДЫ РАЗДЕЛЕНИЯ И ОЧИСТКИ ВЕЩЕСТВ
В данной лабораторной работе каждая пара студентов выполняет общий опыт №1 и один из следующих опытов №№ 2-7 по указанию преподавателя.
В ходе занятия проводится "экскурсия" по всем рабочим местам и каждая пара рассказывает о проведенном ею индивидуальном опыте. В лабораторном отчете: для "своих" опытов дать подробное описание, а для остальных, с которыми познакомились в ходе "экскурсии" - название, рисунок прибора, суть метода.
Опыт 1. Очистка солей перекристаллизацией
Метод перекристаллизации предусматривает растворение вещества с последующим выделением его из раствора - кристаллизацией. При этом одни примеси, нерастворимые, отделяются при фильтровании раствора, другие, растворимые, большей частью остаются в растворе при кристаллизации. Кристаллизацию проводят, как правило, охлаждая горячий насыщенный раствор. Иногда прибегают к выпариванию большей части растворителя. Используется также "высаливание" - добавка некоторых веществ, способных уменьшать растворимость очищаемого соединения (так, растворимость хлорида натрия в воде резко уменьшается при насыщении раствора хлороводородом).
Метод применим для очистки не только солей, но и любых твердых веществ, растворимых в воде или других растворителях.
В данном опыте Вы познакомитесь также с такими методами разделения и очистки веществ, как фильтрование (обычное и с отсасыванием), и высушивание (в сушильном шкафу, в эксикаторе).
а) Перекристаллизация дихромата калия.
Рассчитайте количество дихромата калия (K2Cr2O7), необходимое для приготовления его водного раствора, насыщенного при 60oС, исходя из 50 мл воды, если известно, что массовая доля дихромата калия в насыщенном растворе при этой температуре составляет 31,2%.
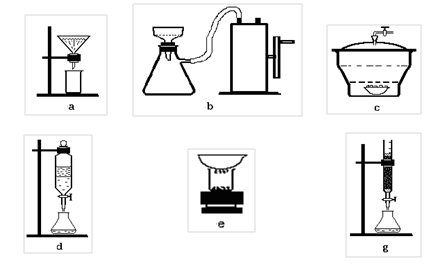
Взвесьте рассчитанное количество соли и высыпьте навеску в термостойкий стаканчик или колбу. Отмерьте цилиндром 50 мл воды и перелейте ее в стаканчик с веществом. Перемешивая стеклянной палочкой, нагревайте смесь на электроплитке до начала кипения, наблюдайте растворение соли. Одновременно приготовьте складчатый фильтр и воронку для горячего фильтрования (рис. 6а).
|
| Рис. 6. Оборудование для разделения и очистки веществ |
Для отделения нерастворимых примесей горячий раствор нужно профильтровать. Фильтрат соберите в чистый стаканчик на 100 мл. Охладите его сначала до комнатной температуры, а затем в кристаллизаторе со льдом. Кристаллизацию надо вести при перемешивании, чтобы образовались более однородные кристаллы. Выпавшие красно-оранжевые кристаллы отфильтруйте на воронке Бюхнера, используя колбу Бунзена и насос для более полного отсасывания жидкости (рис. 6b), и промойте 5 мл ледяной воды. Вещество перенесите шпателем на предварительно взвешенную фарфоровую чашку и сушите в сушильном шкафу в течение 30 минут при 100oС.
Исследуйте исходное вещество, маточный раствор и полученный препарат на содержание примеси K2SO4. Для этого:
1) Поместите в одну пробирку несколько кристаллов исходного вещества, в другую - полученного продукта, в третью 1-2 мл маточного раствора. Кристаллы в первых двух пробирках растворите в 2 мл воды.
2) Добавьте в каждую пробирку по 3-4 капли конц. HCl и перемешайте.
3) Добавьте по 1-2 капли раствора BaCl2.
Какая реакция должна протекать? Напишите ее молекулярное и ионное уравнение. В каких пробирках наблюдаются признаки протекания реакции? Сделайте вывод.
Чашку с кристаллами охладите в эксикаторе с безводным хлоридом кальция (рис. 6с), взвесьте и вновь поместите в сушильный шкаф на 10 минут. Снова охладите в эксикаторе и взвесьте. Если масса чашки не изменилась, высушивание можно считать полным, иначе его нужно продолжать до постоянной массы. Какова роль хлорида кальция в данном опыте?
Рассчитайте теоретический выход дихромата калия, считая, что количество воды (50 мл) в ходе опыта не изменилось, а массовая доля K2Cr2O7 при 0oС составляет 4,4%. Определите также практический выход в % по отношению к исходной навеске и к теоретически возможному. Напишите уравнения реакций, зарисуйте использованные приборы.
По этой методике, с использованием справочных данных по растворимости, можно организовать перекристаллизацию и других солей, имеющих ярко выраженную температурную зависимость растворимости. Исследование исходного и полученного препарата, а также маточного раствора проводится в отношении заявленных примесей. Условия высушивания препарата определяются в зависимости от его устойчивости, чаще всего – также по справочным данным.
Опыт 2. Очистка и высушивание газов
Основным способом очистки газов является пропускание их через слой жидкого или твердого вещества, способного реагировать с примесями, но не реагирующего с основным веществом. Для реакции газов с жидким веществом применяются промывные склянки. В склянках Дрекселя очищаемый газ подается по трубке в слой жидкого реагента, для улучшения контакта газа с жидкостью трубочка иногда заканчивается шариком с большим числом мелких отверстий или впаянной пористой стеклянной пластинкой. Недостатком склянок Дрекселя является то, что жидкость может быть засосана в реакционный сосуд, если давление в нем упадет (например, при прекращении нагревания). Этого недостатка лишены склянки Тищенко, разделенные перегородкой на две половины.
Промывные склянки заполняются жидкостью не более чем на 1/3, чтобы капли ее не попадали в отводные трубки.
Для очистки газов твердыми веществами обычно используют трубчатые реакторы. Твердое вещество должно быть в форме гранул или достаточно крупных кусочков, т.к. мелкий порошок оказывает слишком большое сопротивление потоку газа. Чтобы увеличить поверхность соприкосновения твердых веществ с газом и сделать слой адсорбента более рыхлым, его иногда смешивают с асбестом, стекловатой и др.
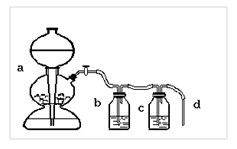
Познакомьтесь c устройством и работой аппарата Киппа, используемого для получения углекислого газа в лаборатории (рис 7а). Углекислый газ получается взаимодействием карбоната кальция (мрамор) с соляной кислотой (уравнение реакции).
Налейте в пробирку примерно 5 мл воды, добавьте по 1-2 капли растворов азотной кислоты и нитрата серебра. Пропустите через полученный раствор углекислый газ непосредственно из аппарата Киппа. Наличие какой примеси в газе обусловливает образование осадка?
|
| Рис. 7. Аппарат Киппа для получения и очистки оксида углерода (IV) |
Подсоедините установку для очистки углекислого газа, состоящую из промывных склянок (рис. 7, b и c), заполненных: b) раствором гидрокарбоната натрия, c) концентрированной серной кислотой. Испытайте газ, прошедший очистку, так, как это описано ранее. Наблюдается ли образование осадка? Сделайте вывод об эффективности очистки, объясните назначение каждой склянки, напишите уравнения реакций, зарисуйте прибор.
Опыт 3. Разделение, очистка и высушивание жидкостей.
Экстракция
Для разделения несмешивающихся жидкостей (например, водных растворов и нерастворимых в воде органических веществ) применяются делительные воронки. Подлежащую разделению смесь заливают в воронку и после расслаивания нижний и верхний слои сливают в разные колбы (рис. 6d).
Таким же образом проводится экстракция - извлечение вещества из раствора другой жидкостью, несмешивающейся с первой и лучше растворяющей извлекаемое вещество. Например, можно извлечь йод из водного раствора гексаном, в котором йод растворяется значительно лучше.
Этот же прием можно использовать для очистки органических жидкостей водными растворами различных реагентов. В этом случае к очищаемой жидкости в делительной воронке добавляют небольшое количество водного раствора реагента, воронку закрывают и, несколько раз переворачивая и встряхивая ее, перемешивают содержимое. Нужно избегать сильного взбалтывания, т.к. это может привести к образованию стойкой эмульсии. В процессе очистки в воронке может повыситься давление, поэтому необходимо придерживать пробку и время от времени, перевернув воронку, приоткрывать ее кран для выхода скопившихся газов. При такой очистке, как правило, одновременно протекает экстракция примесей и их химическая реакция с реагентом.
Для высушивания органических растворителей их обычно выдерживают длительное время над веществами, способными взаимодействовать с водой, но не реагирующими с данным растворителем. В качестве таких веществ используют безводные соли, способные давать кристаллогидраты, некоторые оксиды, металлический натрий, а также сорбирующие материалы, например силикагель.
Рассмотрите выданную Вам делительную воронку, проверьте, используя воду, надежность ее крана и пробки, при необходимости смажьте их. Выполните один из вариантов опыта по указанию преподавателя.
а) Экстракция йода из водного раствора.
Закрепите воронку в штативе и залейте туда примерно 100 мл йодной воды (раствор йода в воде). Добавьте в воронку около 20 мл гексана, обратите внимание на цвет и расположение слоев жидкости. Закройте воронку пробкой, выньте из штатива и, придерживая кран и пробку, хорошо перемешайте ее содержимое. Снова закрепите воронку в штативе и оставьте до расслаивания. Приготовьте две колбочки для слива.
Запишите цвет и расположение слоев жидкостей. Водный слой слейте в одну колбу, гексановый - в другую. Для более полного извлечения йода повторите экстракцию с новой порцией гексана.
В колбу с раствором йода в гексане добавьте немного безводного сульфата магния (для высушивания). Спустя некоторое время несколько капель этого раствора нанесите на часовое стекло и дайте высохнуть при комнатной температуре (ТЯГА!). Наблюдайте образование на стекле кристаллов йода.
б) Очистка гексана от йода.
Примерно 100 мл раствора йода в гексане залейте в делительную воронку, закрепленную в штативе. Добавьте туда же 20 мл 5%-ного раствора тиосульфата натрия, обратите внимание на цвет и расположение слоев жидкости.
Закройте воронку пробкой, выньте из штатива и, придерживая кран и пробку, хорошо перемешайте ее содержимое. Снова закрепите воронку в штативе и оставьте до расслаивания. Приготовьте две колбочки для слива.
Как изменилась окраска слоев жидкостей? (Тиосульфат натрия реагирует с йодом по схеме: J2 + Na2S2O3 -> NaJ + Na2S4O6)
Водный слой слейте в колбу, а к гексану добавьте 20 мл воды и промойте так же, как раствором тиосульфата натрия. После отделения воды, слейте очищенный гексан в колбу с хорошей пробкой и добавьте в нее несколько кусочков безводного сульфата магния (зачем?).
Напишите уравнения реакций, зарисуйте прибор.
Опыт 4. Перегонка жидкостей
Одним из древнейших способов очистки жидкостей от растворенных в ней веществ является перегонка - метод, основанный на разной летучести веществ. При нагревании раствора жидкость испаряется, отделяясь от нелетучих примесей, и конденсацией паров получаем чистое вещество. Для разделения смеси содержащей несколько летучих компонентов (смесь жидкостей с разными температурами кипения) их пары пропускают через ректификационные колонки (ректификационная перегонка, ректификация). Для перегонки высококипящих жидкостей применяется перегонка при пониженном давлении, перегонка в вакууме.
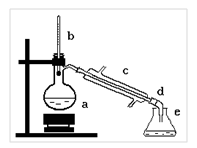
Рассмотрите прибор для простой перегонки (рис. 8). Он состоит из колбы Вюрца (а), пробки с термометром (b), холодильника Либиха (с), аллонжа (d) и приемника (e).
|
| Рис. 8. Прибор для простой перегонки |
В колбу Вюрца налейте примерно 100 мл воды, загрязненной хлоридом натрия, предварительно доказав наличие примеси реакцией с нитратом серебра. (Реакцию провести в пробирке, добавив к 1-2 мл воды 1-2 капли раствора нитрата серебра)
На дно колбы поместите "кипелки" - несколько кусочков фарфора, керамики, которые необходимы для равномерного кипения жидкости. Колбу закройте пробкой с термометром так, чтобы шарик термометра был опущен немного ниже уровня отводной трубки. В рубашку холодильника Либиха снизу вверх пустите не очень сильную струю воды. Заполнив холодильник, она должна непрерывно вытекать из него через верхнюю трубку. На конец холодильника наденьте аллонж и подставьте под него приемник.
Нагрейте раствор в колбе до кипения, наблюдайте конденсацию паров жидкости в холодильнике, запишите показания термометра в ходе перегонки. Каковы они должны быть теоретически?
Первую небольшую порцию дистиллята отбросьте (почему?), затем соберите 10-20 мл жидкости и проверьте наличие в ней хлорида натрия. Напишите уравнения реакций, зарисуйте прибор.
Опыт 5. Возгонка
Возгонка позволяет очистить легколетучее твердое вещество от нелетучих примесей. Если же вещество содержит летучие примеси, их связывают, используя различные реагенты. Возгонка позволяет также осуществлять очистку вещества транспортными реакциями, при которых происходит перенос вещества в виде летучих соединений из одной зоны реактора в другую при высоких температурах.
Так, технический йод может содержать в качестве примесей бром, влагу, нелетучие примеси. Для очистки от брома йод растирают, добавив немного KJ, а примесь воды удаляется оксидом кальция.
Немного загрязненного йода (на кончике шпателя) перенесите в небольшую фарфоровую ступку, добавьте несколько кристаллов KJ и немного оксида кальция. Разотрите полученную смесь (ТЯГА!) и перенесите ее в сухой термостойкий химический стаканчик, который накройте фарфоровой чашкой с холодной водой (рис. 6е). Осторожно нагрейте стаканчик на плитке. Что происходит? Кристаллы возогнанного йода соберите в бюкс, ступку и стаканчик промойте раствором щелочи или тиосульфата натрия. Напишите уравнения реакций, зарисуйте прибор.
Опыт 6. Центрифугирование и декантация
Простейшим способом очистки жидкости от нерастворимых примесей является декантация - отстаивание и последующее сливание жидкости с осадка. Разделение основано на различной плотности веществ и происходит под воздействием силы тяжести. Однако многие вещества образуют студенистые или рыхлые осадки, которые медленно оседают и легко взмучиваются при сливании жидкостей. Чтобы ускорить процесс разделения и получить более плотные осадки, прибегают к искусственному увеличению силы тяжести в центрифугах.
Рассмотрите центрифугу, схематично изображенную на рисунке (рис. 9), ознакомьтесь с назначением ее составных частей и органов управления, техникой безопасности при работе с ней. Включать центрифугу можно только с разрешения преподавателя!
|
| Рис. 9. Схематичное изображение центрифуги |
Одно из основных требований при работе с центрифугой - это необходимость ее равномерной загрузки, т.е. в противоположные гнезда центрифуги помещают пробирки одинаковой массы. Во время работы центрифуга должна быть закрыта защитным кожухом, который снимают только после полной остановки. При возникновении сильных вибраций (признак неравномерной загрузки!) прибор немедленно выключают и проверяют равномерность загрузки.
Получите в пробирке осадок гидроксида алюминия взаимодействием растворов хлорида алюминия и щелочи (избегать избытка щелочи - почему?) Осадок вместе с раствором перенесите в пробирку для центрифугирования. Для уравновешивания в другую такую же пробирку налейте равный объем воды. Проведите центрифугирование и отделите осадок от раствора декантацией.
Промойте осадок декантацией. Для этого к осадку добавьте несколько миллилитров дистиллированной воды, хорошо перемешайте стеклянной палочкой, затем снова отцентрифугируйте и слейте промывную жидкость в чистую пробирку.
Повторяйте промывание до отрицательной или очень слабой реакции промывной жидкости на хлорид-ион (проба с раствором нитрата серебра). Напишите уравнения реакций, зарисуйте прибор.
Опыт 7. Ионообменное разделение и очистка
Ионообменные методы очистки и разделения основаны на применении специальных веществ - ионитов (ионообменных смол). Иониты представляют собой высокомолекулярные органические или неорганические вещества, содержащие кислотные или основные функциональные группы, способные взаимодействовать с ионами в растворе. В зависимости от характера функциональных групп, различают катиониты и аниониты. Примером катионита может служить сульфокатионит, содержащий остатки серной кислоты:
R-SO3H + M+ -> RSO3M + H+
Анионитами являются вещества, содержащие аминогруппу:
R-NH2 + HOH -> R-NH3OH; R-NH3OH + An- -> R-NH3An + OH-
Обработка воды, содержащей растворенные соли, катионитом и анионитом или их смесью позволяет получить деионизированную воду. Адсорбированные катионы и анионы можно при необходимости выделить, промывая ионит кислотой или щелочью, таким образом, выделить соль в более концентрированном или очищенном виде. Подбирая условия сорбции и вымывания можно проводить разделение ионов (ионообменная хроматография).
Ионный обмен проводят, как правило, пропуская раствор через колонку, заполненную ионитом. В лаборатории в качестве колонки можно использовать стеклянную трубку с краном (укороченную бюретку).
Поместите в нижнюю часть колонки ватный тампон, затем закройте кран и закрепите колонку в штативе (рис. 6g). Суспензию катионита в дистиллированной воде залейте в колонку и дайте отстояться - в слое ионита не должно быть пузырей воздуха, это уменьшает эффективность колонки. Сверху поместите еще один ватный тампон, после чего осторожно откройте кран и слейте лишнюю воду, оставив над тампоном примерно 0.5 см жидкости.
Очистка раствора от ионов меди. Залейте в колонку 5 мл 0.1 М раствора сульфата меди (цвет?) и по каплям пропускайте его через колонку в чистую колбу. Как только над ионитом останется 1-2 мм жидкости, залейте в колонку 5 мл дистиллированной воды. Такое промывание повторите дважды, продолжая собирать вытекающую жидкость в ту же колбу.
Сравните цвет полученного и исходного растворов. Проведите качественную реакцию на ион меди, для чего к 1 мл раствора добавьте несколько капель конц. раствора аммиака (ТЯГА!). Качественными реакциями докажите, что раствор содержит ионы водорода и сульфат-ионы.
Выделение ионов меди, регенерация ионита. Залейте в колонку 5 мл 10%-ного раствора HCl и по каплям пропускайте через колонку, затем также промойте колонку двумя-тремя порциями воды. Отметьте цвет полученного раствора, проведите качественную реакцию на ион меди.
Колонку продолжайте промывать водой до нейтральной реакции, после чего выньте верхний тампон и, взбалтывая ионит с водой, перенесите его в колбу, где оставьте для следующего занятия.
Напишите уравнения реакций, зарисуйте прибор.
Дополнительная информация в материалах сайта КонТрен: Мастер-класс экспериментального тура: Обычное фильтрование. Фильтрование с отсасыванием.
Оборудование и реактивы. На каждый стол: 4 стакана или колбы 100-200 мл, 2 воронки, 2 фарфоровые чашки, мерный цилиндр, весы и разновесы, шпатели, электроплитка. Дихромат калия (загрязненный сульфатом калия и песком в соотношении 100:1:1), растворы соляной кислоты и хлорида бария, нитрата серебра.
На общем столе: прибор для фильтрования с отсасыванием, кристаллизатор со льдом, эксикатор с безводным хлоридом кальция.
Для опытов 2-7 (в одном экземпляре):
2. Аппарат Киппа (заряженный для получения СО2), две промывные склянки, соединительные трубки. Гидрокарбонат натрия (тв.), конц. серная кислота, раствор азотной кислоты.
3. Штатив, капельная воронка (100 мл) с пробкой, колба с пробкой для сбора гексана, гексан, йодная вода, р-р тиосульфата натрия, безводный сульфат магния.
4. Прибор для перегонки, кусочки фарфора, электроплитка, раствор хлорида натрия (400 мл, 1%-ный).
5. Маленькая ступка с пестиком, термостойкий стакан (50 мл), фарфоровая чашка, бюкс для йода. Йод (тв), йодид калия (тв), оксид кальция.
6. Центрифуга, пробирки для центрифугирования, растворы хлорида алюминия и гидроксида натрия (0.1 М).
7. Штатив, укороченная бюретка, вата, индикаторная бумага. Сульфокатионит (5 г, в колбе, залитый дист. водой).
Растворы: сульфата меди (0.1 М), соляной кислоты (10%-ный), аммиака.
Лабораторная работа № 5
ОПРЕДЕЛЕНИЕ ЭКВИВАЛЕНТНЫХ И МОЛЕКУЛЯРНЫХ МАСС
Экспериментальная часть
Опыт 1. Определение эквивалентной массы магния
Соберите прибор (рис. 10). Заполните прибор водой до нулевой отметки, присоедините двухколенную пробирку Ландольта – Оствальда (а) и проверьте прибор на герметичность. Для этого создайте разницу в уровнях воды в бюретке (b) и уравнительной воронке (с), опустив последнюю. Проследите в течение минуты: уровень воды в бюретке должен оставаться постоянным. Поднимите воронку в прежнее положение и отсоедините пробирку.
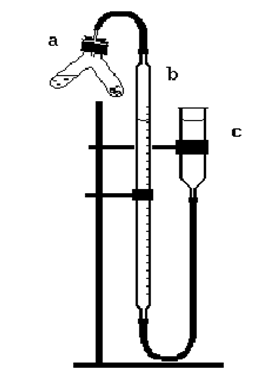
| Рис. 10. Прибор для определения эквивалентной массы магния |
Получите у преподавателя навеску металла и запишите ее массу в тетрадь. Навеску поместите в одно колено двухколенной пробирки, а в другое колено налейте несколько миллилитров раствора серной кислоты. Пробирку присоедините к прибору и снова проверьте его герметичность. Приведите давление в бюретке к атмосферному (для этого вода в бюретке и уравнительной воронке должна быть на одном уровне). Определите уровень воды в бюретке и запишите его в тетрадь.
Перелейте кислоту в то колено пробирки, где находится металл. Наблюдайте протекание реакции и вытеснение воды из бюретки выделяющимся водородом. Когда реакция закончится, дайте пробирке охладиться до комнатной температуры, снова приведите давление в бюретке к атмосферному и измерьте уровень воды в бюретке. Измерьте и запишите в тетрадь температуру в помещении.
Вычисления
Определите по справочным таблицам давление насыщенного водяного пара при данной температуре, используя закон Дальтона, найдите парциальное давление водорода. Рассчитайте объем вытесненного водорода и, используя уравнение Менделеева-Клапейрона, его массу.
Пользуясь законом эквивалентов, вычислите эквивалентную массу металла и сравните полученное значение с теоретическим. Вычислите относительную погрешность опыта в процентах.
Опыт 2. Определение молекулярной массы углекислого газа
Рассмотрите установку для получения и очистки углекислого газа (рис. 7). Сухую и чистую колбу емкостью 250 мл закройте кусочком полиэтиленовой пленки с резиновым колечком и взвесьте с точностью до 0,01 г. Запишите массу колбы с воздухом в тетрадь.
Наполните колбу углекислым газом из аппарата Киппа (а), заряженного кусками мрамора и соляной кислотой. Для этого ток газа надо отрегулировать так, чтобы можно было считать число пузырьков в промывных склянках b и c (первая склянка с водой для очистки углекислого газа от хлороводорода, вторая – с концентрированной серной кислотой для его осушки) и пропускать газ несколько минут.
После заполнения колбы углекислым газом осторожно, не наклоняя колбу и не закрывая кран аппарата Киппа, выньте трубку d из колбы. Закройте колбу той же полиэтиленовой пленкой и закройте кран аппарата Киппа. Взвесьте колбу с углекислым газом и запишите ее массу в тетрадь.
Повторите заполнение и взвешивание колбы еще раз, и, если масса возросла, повторяйте до тех пор, пока два последних взвешивания не дадут одинаковый результат.
После этого измерьте объем колбы. Для этого наполните колбу водой и перелейте воду в мерный цилиндр. Измерьте и запишите в тетрадь температуру в помещении.
Вычисления
Пользуясь уравнением Менделеева-Клапейрона, вычислите массу воздуха в объеме колбы. Затем найдите массу колбы без воздуха, вычитая из массы колбы с воздухом массу воздуха. После этого определите массу углекислого газа в объеме колбы, вычитая из массы колбы с углекислым газом массу пустой колбы.
Определите молекулярную массу углекислого газа двумя путями:
а) приведите объем углекислого газа в колбе к н.у., найдите плотность газа при н.у. и используйте молярный объем;
б) найдите, используя массы воздуха и углекислого газа в колбе, относительную плотность углекислого газа по воздуху, и примените второе следствие из закона Авогадро, учтя, что молярная масса воздуха равна 29 г/моль.
Сравните полученные результаты и теоретическое значение. Вычислите относительную погрешность опыта в процентах.
Оборудование и реактивы: На каждое рабочее место: установка для определения






