В газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям (v), которое подчиняется закону, теоретически полученному Максвеллом. Закон Максвелла представлен в виде некоторой функцией f (v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN (v), имеющих скорость, заключенную в этом интервале. Функция f (v) представляет собой отношение доли (относительного количества) молекул dN (v)/ N, скорости которых лежат в интервале от v до v + dv, в величине этого интервала dv.
 (1)
(1)
Применяя методы теории вероятности, Максвелл нашел функцию f (v), т.е. закон для распределения молекул идеального газа по скоростям:
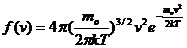 (2)
(2)
Здесь mo – масса одной молекулы.
Вид функции этой функции

Используя ее можно получить выражения для следующих скоростей молекул:
 — средняя квадратичная;
— средняя квадратичная;
 — средняя арифметическая;
— средняя арифметическая;
 — наиболее вероятная,
— наиболее вероятная,
где т о— масса одной молекулы.
Барометрическая формула. Распределение Больцмана
Барометри ческая формула имеет вид 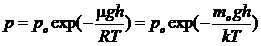 ,
,
где m — молярная масса газа, R — универсальная газовая постоянная, т o — масса одной молекулы, k — постоянная Больцмана, Т — термодинамическая температура.
Она показывает, как изменяется атмосферное давление в зависимости от высоты. Из нее, учитывая, что mogh = П — потенциальная энергия молекулы в поле тяготения, можно получить

Эта формула называется распреде лением Больцмана для молекулво внешнем потен циальном поле.
Средняя длина свободного пробега газовых молекул.
Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь l, который называется длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, то можно говорить о средней длине свободного пробега молекул < l >•
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d.
Средняя длина свободного пробега молекул газа
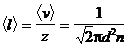 ,
,
где < v > — средняя арифметическая скорость молекул, z — среднее число столкновений молекулы в единицу времени, d — эффективный диаметр молекулы, n — число молекул в единице объема (концентрация молекул).






