Факторы, влияющие на активность ферментов
(скорость ферментативных реакции)
Лабильность, то есть способность ферментов изменять активность в зависимости от различных факторов - температуры. рН среды, активаторов, ингибиторов и т. д., обусловлена, прежде всего, белковой природой ферментов. Степень изменения активности от различных факторов можно оценить по скорости ферментативной реакции.
Мерой скорости ферментативной реакции служит количество субстрата, превращающегося в единицу времени, или количество образовавшегося продукта. При изучении влияния какого-либо фактора на скорость ферментативной реакции должен соблюдаться принцип единого различия, то есть все прочие факторы должны оставаться неизменными и по возможности иметь оптимальные значения.
Задание 1. Получение разведенного препарата амилазы слюны
1. Студент-доброволец из каждой группы, ополоснув рот водой 2-3 раза, собирает в пробирку с воронкой слюну определенного объема для каждой задачи.
2. Под контролем лаборанта отбирается определенное количество и разбавляется водой в зависимости от необходимого разведения: например если нужно получить разведение 1:9, отбирается точно 1 мл слюны из пробирки и переносится в центрифужную пробирку и доводится до объем до 10 мл.
3. При необходимости фильтровать раствор в стакан, отметив разведение слюны в 10 раз.
Задание 2. Влияние температуры на активность ферментов
Температура всегда влияет на скорость реакции. В пределах физиологических условий скорость реакции растёт с увеличением температуры, но выше определенной температуры начинается тепловая инактивация белковой молекулы. Эти явления и объясняют существование температурного оптимума ферментативных реакций. Не все ферменты одинаково меняют свою активность с изменением температуры. Для большинства ферментов, выделенных из организма теплокровных, оптимальная температура равна 37-40 °С. Повышение температуры выше оптимальной приводит к уменьшению, а затем прекращению действия фермента (50-80 °С), что связано с денатурацией белков. Низкие температуры понижают скорость ферментативных реакций, доводя до минимальной величины при 0 °С.
| Реактивы: | разбавленная слюна; |
| раствор йода в йодиде калия (1:10) 0.3 %-ный (Раствор Люголя); | |
| раствор крахмала 1 %-ный; |
Ход работы.
В штативе расположить двумя рядами 8 пробирок (по 4 пробирки в ряду). Во все пробирки одного ряда налить по 3 мл 0,2 %-ного раствора крахмала; во все пробирки другого ряда – по 1 мл разбавленной слюны. Первые пробирки из обоих рядов (одна с ферментом, другая с крахмалом) поместить в кипящую водяную баню, вторые – в термостат при 37-38 °С. третьи – в лёд или снег, четвёртые оставить при комнатной температуре. Через 10 минут содержимое каждой пары пробирок объединить вместе (прилить крахмал к ферменту), тщательно перемешать пробирки с содержимым и оставить в тех же температурных условиях при которых они находились. Этот момент считать началом опыта.
В это время взять 3 пробирки, внести в них по 0,5-1 мл воды и по 3 капли раствора йода. Это необходимо для наблюдения за ходом гидролиза крахмала амилазой по реакции с йодом.
По истечении 5 минут инкубации из пробирки, стоящей при комнатной температуре, отобрать 0,2-0,3 мл инкубируемой смеси и внести её в одну из пробирок с раствором йода. При появлении синего или фиолетового окрашивания, все пробирки оставить в тех же условиях еще на 5 минут. После истечения этого времени реакцию с йодом повторить. В случае появления краевых или жёлтых тонов окраски содержимого пробирки, стоящей при комнатной температуре, инкубацию прекратить и сразу же в каждую пробирку добавить по 3 капли раствора йода, содержимое перемешать и охладить/подогреть до комнатной температуры.
Глубину гидролиза крахмала определить по окраске с раствором йода, результат записать в таблицу.
| Растворы, условия опыта | Температура | |||
| 0 ºС (лед) | 20-25 ºС (контроль) | 37 ºС (термостат) | 100 ºС (кипящая баня) | |
| Слюна | 1 мл | 1 мл | 1 мл | 1 мл |
| Крахмал 0,2 % | 3 мл | 3 мл | 3 мл | 3 мл |
| Поместить | эксикатор со льдом | оставить в штативе на столе | в термостат | в кипящую баню |
| Экспозиция 10 минут | ||||
| Слить вместе и оставить в тех же условиях, в которых находились пробирки | ||||
| Раствор Люголя | 1-2 капли | 1-2 капли | 1-2 капли | 1-2 капли |
| Окраска с йодом | ||||
| Название обнаруженных на основании окраски с йодом продуктов * | ||||
Через 1 минуту инкубации отбирать из пробирки на столе по 0,3-0,5 мл и вливать в приготовленную заранее пробирку содержащую 1 каплю раствора Люголя. Смотреть через каждые 30 секунд. При появлении бурой окраски быстро раскапать йод во все опытные пробирки, предварительно охладив под струей воды пробирки из термостата и кипящей бани. Зафикисировать развитие окраски.
* При гидролизе крахмал распадается, давая последовательно декстрины, мальтозу и глюкозу. В начале гидролиза образуются амилодекстрины, дающие синее окрашивание с йодом, затем эритродекстрины, дающие с йодом красно-бурое окрашивание и, наконец, ахродектрины, не окрашивающиеся йодом. Продуктом гидролиза последних является мальтоза, которая распадается в дальнейшем на две молекулы глюкозы.
Таблица – Цветные реакции декстринов с йодом
| Декстрин (С6Н10О5) k | Степень полимеризации k | Окраска комплекса с йодом |
| Амилодекстрины | >30 | Синяя или фиолетовая |
| Эритродекстрины | 25–29 | Красная |
| Ахродекстрины | 21–24 | Желто-коричневая |
| Мальтодекстрины | <20 | Отсутствие реакции |
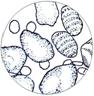 1
1  2
2  3
3
(1 – из картофеля, 2 – из кукурузы, 3 – из пшеницы)
Рисунок – Зерна крахмала из разных природных источников под микроскопом
| Углеводы | Mr | Степень полимеризации | Редуцирующая способность,% |
| Растворимый крахмал | 208000 | 1300 | 0,073 |
| Амилодекстрины | 10000 | 61 | 0,5 |
| Эритродекстрины | 6000 | 38 | 2,5 |
| Ахродекстрины | 3200 | 20 | 5,0 |
| Тетрасахариды | 661 | 4 | 25 |
| Трисахариды | 504 | 3 | 33 |
| Мальтоза | 342 | 2 | 60 |
| Глюкоза | 180 | 1 | 100 |
На основании полученных данных построить график скорости ферментативной реакции от температуры. При построении графика по оси ординат, начиная от нуля, обозначить цвета в следующей последовательности: синий, фиолетовый, красный (объединяя все его тона), желтый; по оси абсцисс - температуру, обозначив разрыв между 40 и 100 °С.
Сделать вывод о влиянии температуры на активность амилазы.
Влияние активаторов и ингибиторов на активность амилазы
| Растворы, условия опыта | Температура | |||
| 0 ºС (лед) | 20-25 ºС (контроль) | 37 ºС (термостат) | 100 ºС (кипящая баня) | |
| Слюна | 1 мл | 1 мл | 1 мл | 1 мл |
| Крахмал 0,2 % | 3 мл | 3 мл | 3 мл | 3 мл |
| Поместить | эксикатор со льдом | оставить в штативе на столе | в термостат | в кипящую баню |
| Экспозиция 10 минут | ||||
| Слить вместе и оставить в тех же условиях, в которых находились пробирки | ||||
| Раствор Люголя | 1-2 капли | 1-2 капли | 1-2 капли | 1-2 капли |
| Окраска с йодом | ||||
| Название обнаруженных на основании окраски с йодом продуктов * | ||||
| Растворы, условия опыта | Количество растворов | ||
| Опыт 1 | Опыт 2 | Контроль | |
| Слюна | 1 мл | 1 мл | 1 мл |
| Вода | - | - | 3 мл |
| 1% NaCl, капель | 2 | - | - |
| 1% CuSO4, капель | - | 2 | - |
| 1% Крахмал, капель | 5 | 5 | 5 |
| Экспозиция, 5 мин | |||
| р-р I2 в KI, капель | 1 | 1 | 1 |
| Результат окраски | |||
| Вывод | |||
Задание 3. Влияние рН среды на активность ферментов
на примере амилазы слюны
Большинство ферментов характерным образом изменяют свою активность в зависимости от рН. Оптимальной активности фермента соответствует определённая область рН, при которой достигается максимальная скорость реакции; уменьшение и увеличение рН приводит к снижению последней. Для различных реакций значения оптимума рН колеблются в широких пределах от сильно кислой среды до сильно щелочной.
Зависимость ферментативной активности от pН определяется значением рК ионизирующих групп белковой молекулы, особенно тех, которые находятся в активном центре или вблизи него, а также групп, ответственных за изменение состояния активного центра путём конформационных изменений белковой молекулы. Кроме того, рН может влиять на степень ионизации или пространственную организацию субстрата.
и раствор йода в йодиде калия (1:10) 0,3 %-ный (раствор Люголя);
слюна разбавленная 1:9 (фильтрованная);
раствор крахмала 1 %-ный.
растворы для приготовления смесей с заданными значениями рН
Приготовление буферных растворов с различными значениями рН среды
(берете готовые на лабораторном столе)
| № пробирки | 0,2 М растворы фосфата натрия, мл | Значение рН смеси | |
| Раствор 1. Двузамещенный | Раствор 2. Однозамещенный | ||
| 1 | 2,5 | 47,5 | 5,8 |
| 2 | 10 | 40 | 6,2 |
| 3 | 30 | 20 | 7,0 |
| 4 | 40 | 10 | 7,4 |
| 5 | 47,5 | 2,5 | 8,0 |
Буферные растворы готовятся лаборантом 1 раз на весь поток. После смешивания фактическое значение рН определить на рН-метре. Добавлением раствора № 1 или № 2 максимально приблизить к заданной рН.
Ход работы.
Перед началом работы определить активность амилазы слюны. Для чего в пробирке смешать 1 мл 1 % -ного раствора крахмала и 0,25 мл разбавленной 1:9 профильтрованной слюны. Смесь оставить при комнатной температуре. Наблюдение за ходом гидролиза крахмала проводить по реакции с раствором йода. Для чего через каждые 5 минут отбирать по 3-4 капли гидролизата и вносить его в пробирку с заранее налитым туда 0,5 мл воды и 3 каплями раствора йода. При появлении красно-бурой или красной окраски наблюдение прекратить. Желательно, чтобы гидролиз крахмала до эритродекстринов (красные тона окраски) происходил приблизительно за 10-15 минут. Если гидролиз идёт быстрее, то слюну нужно разбавить ещё в 2 раза и опыт повторить. Найденное разбавление слюны использовать для работы.
В каждую из 5 пронумерованных пробирок внести по 2 мл буферного раствора с определённым значением рН: 5,8; 6,2; 7,0; 7,4; 8,0 или близкими к каждому из этих значений. Пипетку после внесения каждого буферного раствора промывать! Во все пробирки добавить по 2 мл 1 %-ного раствора крахмала и по 0,5 мл слюны подобранного для определения pН разбавления. Содержимое перемешать и оставить при комнатной температуре. Наблюдения за ходим гидролиза крахмала вести по реакции с раствором йода согласно методике, описанной в предыдущем опыте. Отбор проб производить из пробирки № 3 (рН 7.0) через каждые 5 минут. При появлении красного или жёлтого окрашивания содержимого сразу же во все пробирки внести по 3 капли раствора йода. Содержимое перемешать, результат внести в таблицу.
Влияние рН среды на активность амилазы слюны
| Показатели
| Номера пробирок | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Показатели рН | 5,8 | 6,2 | 7,0 | 7,4 | 8,0 |
| Окраска с йодом | |||||
При оформлении работы записать значения рН. указанные на флаконах. По результатам работы построить график зависимости активности амилазы слюны от рН и сделать вывод. При построении графика по оси ординат, начиная от нуля, обозначить цвета в следующей последовательности: синий, фиолетовый, красный (объединяя все его тона), желтый; по оси абсцисс - рН.
Задание 4. Влияние активаторов и ингибиторов на активность ферментов с определением активности по Вольгемуту
Активность большинства ферментов в значительной степени зависит от природы и концентрации некоторых ионов и низкомолекулярных веществ (могут быть промежуточные или конечные метаболиты реакций), присутствующих в биологической жидкости. Одни из них - активаторы - повышают активность ферментов, другие – ингибиторы угнетают действие ферментов. Механизм их действия может быть аллостерическим или конкурентным.
Реактивы. Растворы: крахмала 1 %-ный,
хлорида натрия 1 %-ный,
сульфата меди (II) 1 %-ный,
йода в йодиде калия (1:10) 0,3% -ный (раствор Люголя).
Ход работы.
1 мл слюны смешать с 3 мл воды (разбавление 1:4), профильтровать через бумажный фильтр если необходимо и использовать для дальнейшей работы. В штативе расположить тремя рядами 18 пробирок по 6 пробирок в каждом ряду. Пробирки каждого ряда пронумеровать и во все внести по 1 мл воды. Затем в первую пробирку каждого ряда добавить по 1 мл фильтрата слюны, содержимое хорошо перемешать и 1 мл смеси из пробирки 1 перенести в пробирку 2. Содержимое тщательно перемешать и 1 мл смеси из пробирки 2 перенести в пробирку 3 и т. д. Из последней пробирки каждого ряда 1 мл смеси после тщательного перемешивания вылить. Таким образом, получается ряд разведений, в котором содержание слюны в каждой следующей пробирке в 2 раза меньше, чем в предыдущей.
После разбавления во все пробирки первого ряда прилить по 1 мл воды (контрольный ряд), в пробирки второго ряда — по 1 мл 1 %-ного раствора сульфата меди (II), в пробирки третьего ряда по 1 мл 1 %-ного раствора хлорида натрия. Затем во все пробирки прилить по 1 мл 1%-ного раствора крахмала. В следующем порядке: сначала в первые пробирки всех рядов, затем во вторые пробирки всех рядов и т. д. Содержимое пробирок тщательно перемешать и поместить н термостат при температуре 37-38 ºС на 20 минут. По окончании инкубации в пробирки каждого ряда добавить по 3 капли раствора йода в том же порядке, в каком приливался раствор крахмала.
Содержимое перемешать и отметить в каждом ряду номера пробирок, в которых реакция на крахмал отрицательная (пробирки с жёлтым окрашиванием). Результаты опыта занести в таблицу, обозначив жёлтые тона буквой «Ж», красные (красно-коричневые) - «К», фиолетовые - «Ф» и синие - «С».
По полученным результатам определить активатор и ингибитор. Разделив степень разведения контрольной пробы, в которой реакция с йодом отрицательная, на степень разведения проб, давших отрицательную реакцию с исследуемыми веществами, найти – во сколько раз активатор или ингибитор стимулирует или тормозит действие амилазы.
При высокой активности амилазы слюны количество пробирок в опыте увеличивается до 7-8 штук.
Выявление активаторов и ингибиторов амилазы и определение степени на действия
| Окраска проб | Номера пробирок и доля слюны в содержимом, мл | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Разведение слюны | 1:? | |||||
| воды (контрольная проба) | ||||||
| хлорида натрия | ||||||
| сульфата меди (II) | ||||||






