Характерные степени окисления азота, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.

Простое вещество
NH4NO2 > t > N2 + 2H2O
N2 + 6Li = 2Li3N
N2 + 3Ca > t > Ca3N2
N2 + O2 > t > 2NO
Соединения азота (-3)
N2 + ЗН2 > t, p, катализатор > 2NH3
Ca3N2 + 6H2O = ЗСа(OH)2 + 2NH3
2NH4Cl + Са(OH)2 > t > CaCl2 + 2NH3 + 2Н2O
NH3 + Н2O - NH3 • Н2O - NH4+ + OH?
NH3 + HCl = NH4Cl
4NH3 + CuSO4 = [Cu(NH3)4]SO4
2NH3 • H2O + AgCl = [Ag(NH3)2]Cl + 2H2O
4NH3 • H2O + Ag2O = 2[Ag(NH3)2]OH + 3H2O
4NH3 + 3O2 = 2N2 + 6H2O
4NH3 + 5O2 > Pt, t > 4NO + 6H2O
2NH3 + 3CuO > t > 3Cu + N2 + 3H2O
NH4Cl + NaOH = NaCl + NH3 + H2O
NH4Cl > t > NH3 + HCl
NH4NO2 > t > N2 + 2H2O
(NH4)2CO3 > t > 2NH3 + H2O + CO2
NH4NO3 > t > N2O + 2H2O
NH4NO2 > t > N2 + 2H2O
(NH4)2Cr2O7 > t > N2 + Cr2O3 + 4H2O
Оксидыазота
2N2O > t > 2N2 + O2
2HNO2 = NO2 + NO + H2O
2NO2 + Н2O(хол.) = HNO2 + HNO3
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
3NO2 + H2O(rop.) = 2HNO3 + NO
4NO2 + O2 + 2H2O = 4HNO3
N2O3 = NO + NO2
2N2O5 = 2NO2 + O2
N2O5 + H2O = 2HNO3
N2O5 + 2NaOH = 2NaNO3 + H2O
Соединения азота (+3)
Ba(NO2)2 + H2SO4(разб.) = BaSO4v + 2HNO2 (на холоду)
NO2 + NO + H2O = 2HNO2 (на холоду)
2HNO2 = NO2 + NO + H2O
2HNO2 + 2HI = I2 + 2NO + 2H2O
5NaNO2 + 3H2SO4 + 2KMnO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
2NaNO2 + 2H2SO4 + 2KI = I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
Соединения азота (+5)
N2 + 3H2 > t, p, катализатор > 2NH3
4NH3 + 5O2 > Pt, t > 4NO + 6H2O
2NO + O2 = 2NO2
4NO2 + O2 + 2H2O = 4HNO3
NaNO3 + H2SO4(конц.) = HNO3 + NaHSO4
4HNO3 > hv > 4NO2 + O2 + 2H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
4Ca + 10HNO3(конц.) = 4Ca(NO3)2 + N2O + 5H2O
4Са + 10HNO3(разб.) = 4Ca(NO3)2 + NH4NO3 + 3H2O
HNO3(конц.) пассивируетна холодуAl, Fe, Cr.
Fe + 6HNO3 (конц.) > t > Fe(NO3)3 + 3NO2 + 3H2O
Fe + 4HNO3 (разб.) = Fe(NO3)3 + NO + 2H2O
ЗР + 5HNO3(разб.) + 2Н2O = 3H3PO4 + 5NO
S + 6HNO3 (конц.) = H2SO4 + 6NO2 + 3H2O
2KNO3 > t > 2KNO2 + O2 (металлы до Mg в ряду напряжений)
2Cu(NO3)2 > t > 2CuO + 4NO2 + O2 (металлы от Mg до Cu)
2AgNO3 > t > 2Ag + 2NO2 + O2 (металлы после Cu в ряду напряжений)
4Fe(NO3)2 > t > 2Fe2O3 + 8NO2 + O2
Получение и свойства фосфора и его соединений
Простое вещество (Р4 – белый фосфор, Р – красный фосфор)
2Са3(PO4)2 + 10C + 6SiO2 > t >Р4 + 6CaSiO3 + 10CO
4Р + 5O2 > t > Р4О10
Р4 + 6Са > t > 2Са3Р2
Фосфин РН3
Zn3P2 + 6HCl = 2PH3^ + 3ZnCl2
Са3Р2 + 6Н2O = 2PH3^ + 3Ca(OH)2
2РН3 + 2O2 = Н3PO4
РН3 + HI= PH4I (на холоду)
Фосфористая кислота Н3PO3 (Н2РHO3 – двухосновная кислота)
Р4O6 + 6Н2O = 4Н3PO3
Н3PO3 + NaOH = NaH2PO3 + H2O (NaHPHO3 – кислая соль)
Н3PO3 + 2NaOH = Na2HPO3 + H2O (Na2PHO3 – средняя соль)
Фосфорные кислоты: метафосфорная НPO3 (Н n (PO3) n, где n = 3, 4), дифосфорная – Н4Р2O7, ортофосфорная – Н3PO4.
Р4 + 5O2 = Р4О10
Р4О10 > Н2O, 0 °C > НPO3 > Н2O, 20 °C > Н4Р2O7 > Н2O, 10 °C > Н3PO4
Н3PO4 > t > Н4Р2O7 > t > НPO3
Н3PO4 + NH3 = NH4H2PO4
Н3PO4 + NaOH = NaH2PO4 + H2O
Н3PO4 + 2NaOH = Na2HPO4 + 2H2O
Н3PO4 + 3NaOH = Na3PO4 + 3H2O
Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
Са3(PO4)2 + 2H2SO4 = Са(Н2PO4)2 + 2CaSO4
2Са3(PO4)2 + 10C + 6SiO2 > t >Р4 + 6CaSiO3 + 10CO
VIA-группа
VIA-группу образуют четыре неметалла: кислород, сера, селен, теллур, называемые халькогенами, и радиоактивный металл полоний. Атомы элементов VIA-группы имеют электронную формулу ns2np4. Для них характерны степени окисления -2, 0, +4, +6. У атома кислорода отсутствуют 2d -орбитали, поэтому его валентность равна двум. Наличие d -орбиталей у атомов других элементов позволяет им иметь валентности два, четыре или шесть.
Кислород и его соединения
Кислород – самый распространенный элемент земной коры. Кислород представляет собой газ без цвета, без вкуса, без запаха. Возможные степени окисления кислорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.

Получение и свойства кислорода
Кислород может быть получен при сжижении и разделении воздуха.
2КMnO4 > t > К2MnO4 + MnO2 + O2
2KClO3 > t > 2KCl + 3O2
(NaOH) + 2Н2O > электролиз раствора > 2Н2 + O2
O2 + 2F2 = OF2
2Са + O2 = 2СаО
S + O2 = SO2
2С2Н2 + 5O2 = 4CO2 + 2Н2O
4FeS2 + 11O2 > t > 2Fe2O3 + 8SO2
4NH3 + 3O2 = 6Н2O + 2N2
4NH3 + 5O2 > p, t, Pt > 4NO + 6Н2O
Получение и свойства озона O3
3O2 > hv > 2O3
O3 = O2 + О
KI + Н2O + O3 = I2 + 2KOH + O2
Свойства пероксида водорода
ВaO2 + H2SO4 = BaSO4v + Н2O2 (на холоду)
2Н2O2 > MnO2 > 2Н2O + O2
2KMnO4 + 3H2SO4 + 5Н2O2 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
2KI + H2SO4 + H2O2 = I2 + K2SO4 + 2Н2O
Н2O2 + O3 = 2O2 + Н2O
Сера и ее соединения
Характерные степени окисления серы, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.

Чистая сера – хрупкое кристаллическое вещество желтого цвета. Сера имеет несколько модификаций: ромбоэдрическую и призматическую, также пластическую (аморфную). Аллотропия серы обусловлена различной структурой кристаллов, построенных из восьмиатомных молекул S8. В расплаве серы существуют молекулы S8, S6, в парах серы – молекулы S6, S4, S2.
Получение и свойства серы
FeS2 > t >FeS + S
SO2 + 2H2S = 3S + 2H2O
S + O2 > t > SO2
Fe + S > t > FeS
Hg + S = HgS
S + 6HNO3(конц.) = H2SO4 + 6NO2 + 2H2O
Получение и свойства соединений серы (-2)
FeS + 2HCl = FeCl2 + H2S
H2S - H+ + HS? - 2H+ + S2-
2H2S + O2 (недостаток) = 2Sv + 2H2O
2H2S + 3O2 (избыток) > t > 2SO2 + 2H2O
2H2S + SO2 = 3Sv + 2H2O
H2S + I2 = Sv+ 2HI
5H2S + 3H2SO4 + 2KMnO4 = 5Sv + 2MnSO4 + K2SO4 + 8H2O
3H2S + 4H2SO4 + K2Cr2O7 = 3Sv + Cr2(SO4)3 + K2SO4 + 7H2O
2NaOH + H2S = Na2S + 2H2O
Na2S + 2H2O - NaHS + NaOH
Al2S3 + 6H2O = 2Al(OH)3v + 3H2S^
3Na2S + Cr2(SO4)3 + 6H2O = 2Cr(OH)3^ + 3H2S^+ 3Na2SO4
Получение и свойства соединений серы (+4)
S + О2 > t > SO2
4FeS2 + 11O2 > t > 2Fe2O3 + 8SO2
SO2 + Н2O - H2SO3 - Н+ + HSO3? - 2Н+ + SO32-
Na2SO3 + 2HCl = 2NaCl + H2O + SO2^
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Na2SO3 + H2O
H2SO3 + 2H2S = 3Sv + 3H2O
2SO2 + O2 > p, t, Pt > 2SO3
H2SO3 + Cl2 + H2O = H2SO4 + 2HCl
5SO2 + 2H2O + 2KMnO4 = 2H2SO4 + 2MnSO4 + K2SO4
Получение и свойства соединений серы (+6)
4FeS2 + 11O2 > t > 2Fe2O3 + 8SO2
2SO2 + O2 > p, t, V2O5 > 2SO3
H2O + SO3 = H2SO4
H2SO4 + SO3 = H2SO4 • SO3 = H2S2O7 (олеум)
H2S2O7 + H2O = 2H2SO4
Fe + H2SO4 (разб.) = FeSO4 + H2
Cu + H2SO4 (разб.)?
H2SO4(конц.) + H2O = H2SO4 • H2O + Q
Концентрированная серная кислота пассивируетна холодуAl, Fe, Cr.
2Fe + 6H2SO4 (конц.) > t >Fe2(SO4)3 + 3SO2 + 6Н2O
Cu + 2H2SO4 (конц.) > t > CuSO4 + SO2 + 2Н2O
3Zn + 4H2SO4 (конц.) = 3ZnSO4 + S + 4H2O
4Ca + 5H2SO4 (конц.) = 4CaSO4 + H2S + 4H2O
2H2SO4 (конц.) + S > t > 3SO2 + H2O
2H2SO4 (конц.) + С> t > 2SO2 + CO2 + 2H2O
VIIA-группa
Атомы галогенов, образующих VIIA-группу, имеют электронную конфигурацию ns2np5. Все галогены являются активными неметаллами, окислителями. Их активность уменьшается в ряду F >Cl>Br> I >At. Характерные степени окисления галогенов: -1, 0, +1, +3, +5, +7. Однако у фтора, наиболее активного неметалла, есть лишь степени окисления -1 и 0. F2 и Cl2 – газы, Br2 – жидкость, I2 – твердое вещество. С увеличением радиуса атомов галогенов растет объем их атомов и молекул, а также их поляризуемость. Это приводит к увеличению сил межмолекулярного взаимодействия (сил Ван дер Ваальса) и повышению температур плавления и кипения простых веществ.
HF, HCl, HBr, HI при растворении в воде образуют кислоты (HF – слабую, HCl, HBr и HI – сильные). В HF имеются сильные водородные связи. В ряду HCl – HBr – HI сила кислот несколько увеличивается в связи с увеличением поляризуемости молекул, пропорциональной их объему.
Электронная формула атома водорода 1s1. С галогенами его объединяет способность принимать один электрон и образовывать стабильную электронную оболочку 1s2. Поэтому часто водород располагают вместе с галогенами в VIIA-группе.
Водород и его соединения
Водород – наиболее распространенный элемент во Вселенной. Водород – легкий газ без цвета, без запаха. Возможные степени окисления водорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.

CH4 + 2Н2O > t, катализатор > 4Н2 + CO2
Zn + 2HCl = ZnCl2 + Н2
(NaOH) + 2Н2O > электролиз раствора > 2Н2 + O2
Н2 + 2Na > t > 2NaH
Н2 + Са> t > СаН2
2Н2 + O2 = 2Н2O
Н2 + Cl2 > hv > 2HCl
ЗН2 + N2 > t, p, катализатор > 2NH3
NaH + Н2O = NaOH + Н2
СаН2 + 2HCl = CaCl2 + 2Н2
Вода
Молекулы воды связаны водородными связями: n H2O = (Н2O) n, поэтому вода жидкая в отличии от ее газообразных аналогов H2S, H2Se и Н2Те.
Кислород в молекуле воды находится в состоянии sp3 -гибридизации, две связи О—Н и две неподеленные пары кислорода располагаются тетраэдрически, угол между связями О—Н равен 104,5°, поэтому молекула воды полярная. Вода является хорошим растворителем для веществ с ионными или полярными связями.
2Na + 2Н2O = 2NaOH + Н2
Fe + 4Н2O > t > Fe3O4 + 4Н2
Ag + Н2O?
Н2O + СаО = Са(OH)2
Н2O + Al2O3?
N2O3 + Н2O = 2HNO2
2CuSO4 + 2Н2O - (CuOH)2SO4 + H2SO4
H2SO4(конц.) + H2O = H2SO4 • H2O
CuSO4 + 5H2O = CuSO4 • 5H2O
Фтор и его соединения
Фтор является наиболее активным неметаллом, сильным окислителем.
F2 + Н2 = 2HF
2F2 + 2Н2O = 4HF + O2
F2 + 2NaCl = 2NaF + Cl2
4HF + SiO2 = SiF4^ + 2Н2O
Хлор и его соединения
Хлор – тяжелый газ желто-зеленого цвета, с резким запахом.
2NaCl + 2Н2O > электролиз раствора > Н2 + Cl2 + 2NaOH
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8Н2O
MnO2 + 4HCl = Cl2 + MnCl2 + 2Н2O
Cl2 + Н2 > hv > 2HCl
CH4 + Cl2 > hv > CH3Cl + HCl
С2Н4 + Cl2 = С2Н4Cl2
Cl2 + 2KBr = 2KCl + Br2
Cl2 + Н2O = HCl + HClO (реакция диспропорционирования)
HClO = HCl + О (атомарный кислород – окислитель)
Cl2 + 2KOH = KCl + KClO +Н2O
2Cl2 + 2Са(OH)2 = CaCl2 + Са(ClO)2 + 2Н2O
Смесь CaCl2 и Са(ClO)2 – хлорная, или белильная, известь.
ЗCl2 + 6KOH > 100 °C > 5KCl + KClO3 + ЗН2O
KClO3 – хлорат калия, или бертолетова соль.
4KClO3 > 400 °C > KCl + ЗKClO4
2KClO3 > v >2KCl + 3O2
Сила кислот растет в ряду:
HClO > HClO2 > HClO3 > HClO4.
2HCl + Fe = FeCl2 + H2^
2HCl + CuO = CuCl2 + H2O
3HCl + Al(OH)3 = AlCl3 + 3H2O
HCl + AgNO3 = AgClv + HNO3
HCl + NH3 = NH4Cl
Бром, иод и их соединения
Бром – темно-бурая жидкость с резким запахом, а иод – кристаллическое вещество темного цвета. Изменение фазового состояния галогенов обусловлено увеличением межмолекулярного – дисперсионного взаимодействия, связанного с увеличением размеров и поляризуемости молекул галогенов в ряду хлор > бром >иод.
2NaBr + Cl2 = 2NaCl + Br2
2NaI + Cl2 = 2NaCl + I2
2Al + ЗBr2 = 2AlBr3
2Al + 3I2 = 2AlI3
Br2 + Н2 - 2HBr
I2 + Н2 ^ 2Ш
AgNO3 + NaBr = AgBrv + NaNO3
AgNO3 + NaI = AgIv+ NaNO3
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
10KI + 8H2SO4 + 2KMnO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
D-Элементы
В атомах d-элементов (переходных элементов) заполняется электронами d-под-уровень предвнешнего уровня. На внешнем уровне атомы d -элеметов имеют, как правило, два s-электрона. Близость строения валентных уровней атомов переходных элементов определяет их общие свойства. Все они являются металлами, имеют высокую прочность, твердость, высокую электро– и теплопроводность. Многие из них электроположительны и растворяются в минеральных кислотах, однако среди них есть металлы, не взаимодействующие обычным способом с кислотами. Большинство переходных металлов имеют переменную валентность. Максимальная валентность, как и максимальная степень окисления, как правило, равно номеру группы, в которой находится данный элемент.
Хром и его соединения
Хром представляет собой ковкий тягучий металл серо-стального цвета. Электронная формула атома хрома 1s22s22p63s23p63d54s1.
Характерные степени окисления хрома, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
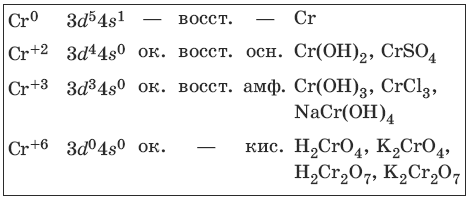
Получение и свойства хрома
FeO • Cr2O3 + 4CO > t >Fe + 2Cr + 4CO2 (Fe + 2Cr) – феррохром
Сr2O3 + 2Al > t > 2Сr + Al2O3 – метод алюминотермии
Хром пассивируетсяна холоду концентрированными азотной и серной кислотами.
Сr + 2HCl = СrCl2 + Н2
СrCl2 + 2NaOH = Cr(OH)2v + 2NaCl
Свойства соединений хрома (+2) и хрома (+3)
Гидроксид хрома(II) сразу окисляется кислородом воздуха.
4Сr(OH)2 + O2 + 2Н2O = 4Сr(OH)3
СrCl3 + 3NaOH = Cr(OH)3v + 3NaCl
Cr(OH)3v + 3Na(OH) = Na3[Cr(OH)6]
Cr2O3 + 2NaOH > t > 2NaCrO2 + H2O
Cr(OH)3v + 3HCl = CrCl3 + 3H2O
2Cr(OH)3 > t > Cr2O3 + 3H2O
2CrCl3 + 3Cl2 + 16KOH = 2K2CrO4 + 12KCl + 8H2O
2Na3Cr(OH)6 + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8H2O
Свойства соединений хрома (+6)
CrO3 + Н2O = H2CrO4
2CrO3 + H2O = H2Cr2O7
Желтый раствор хромата калия устойчив в щелочной среде, оранжевый раствор дихромата калия – в кислой среде.
К2Сr2O7 + 2KOH = 2К2СrO4 + Н2O
2K2CrO4 + H2SO4 = K2SO4 + K2Cr2O7 + Н2O
(NH4)2Cr2O7 > t > Cr2O3 + N2 + 4Н2O
Дихромат калия – окислитель в кислой среде.
К2Сr2O7 + 4H2SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O
K2Cr2O7 + 4H2SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4H2O
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
K2Cr2O7 + 7H2SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
Марганец и его соединения
Марганец – серебристо-белый твердый и хрупкий металл. Характерные степени окисления марганца, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.

Получение и свойства марганца
FeO • Mn2O3 + 4CO > t > Fe + 2Mn + 4CO2 (Fe + 2Mn) – ферромарганец
Mn2O3 + 2Al > t > 2Mn + Al2O3 – метод алюминотермии
Mn + 2HCl = MnCl2 + Н2
Mn + 2H2SO4 (конц.) = MnSO4 + SO2 + 2Н2O
ЗMn + 8HNO3 (разб.) = 3Mn(NO3)2 + 2NO + 4Н2O
Свойства соединений марганца (+2)
MnSO4 + 2NaOH = Mn(OH)2v + Na2SO4
Mn(OH)2v + 2NaOH?
Mn(OH)2v + H2SO4 = MnSO4 + 2H2O
2Mn(OH)2v + O2 = MnO2v + 2H2O
Mn(OH)2v + 2NaOH + Br2 = MnO2v + 2NaBr + 2H2O
Mn(OH)2v > t > MnO + H2O^
2Mn(NO3)2 + 16HNO3 + 5NaBiO3 = 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7H2O
3MnCl2 + 2KClO3 + 12NaOH > сплавление > 3Na2MnO4 + 2KCl + 6NaCl + 6H2O
Свойства соединений марганца (+4)
MnO2 – устойчивый амфотерный оксид, сильный окислитель.
MnO2 + 4HCl = MnCl2 + Cl2 + 2Н2O
3MnO2 + KClO3 + 6KOH > сплавление > 3K2MnO4 + KCl + 3H2O^
Свойства соединений марганца (+6)
Соединения устойчивы лишь в сильнощелочной среде.
К2MnO4 + 8HCl = MnCl2 + 2Cl2 + 2KCl + 4Н2O
Свойства соединений марганца (+7)
Сильные окислители в кислой среде.
2KMnO4 + 3H2SO4 + 5Na2SO3 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + H2O + 3Na2SO3 = 2MnO2 + 3Na2SO4 + 2KOH
2KMnO4 + 2KOH + Na2SO3 = 2K2MnO4 + Na2SO4 + H2O
2KMnO4 + 8H2SO4 + 10FeSO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
2KMnO4 + 8H2SO4 + 10KI = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
2KMnO4 + 3H2SO4 + 5NaNO2 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
2KMnO4 > t > K2MnO4 + MnO2 + O2^
Железо и его соединения
Железо является вторым после алюминия металлом по распространенности в природе. Характерные степени окисления железа, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
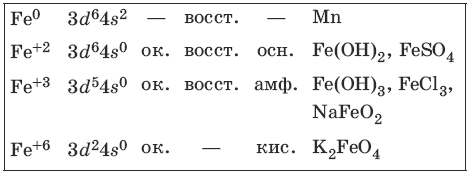
Соединения железа (+8) малохарактерны.
Получение и свойства железа
3Fe2O3 + CO > t > 2Fe3O4 + CO2
Fe3O4 + CO > t > 3FeO + CO2
FeO + CO > t > Fe + CO2
3Fe3O4 + 8Al > t > 9Fe + 4Al2O3
Fe + I2 > t > FeI2
2Fe + ЗCl2 > t > 2FeCl3
4Fe + 3O2 + 2Н2O = 4FeO(OH)v (коррозия на воздухе)
Fe + 2HCl = FeCl2 + Н2
Fe + H2SO4 (разб.) = FeSO4 + H2
Fe + 4HNO3 (разб.) = Fe(NO3)3 + NO + 2H2O
Концентрированные серная и азотная кислоты пассивируют железо на холоду. При нагревании реакция идет.
2Fe + 6H2SO4(конц.) > t > Fe2(SO4)3 + 3SO2 + 6Н2O
Fe + 6НNO3(конц.) > t > Fe(NO3)3 + 3NO2 + 3H2O
Свойства соединений железа (+2)
FeO + Н2O?
FeO + H2SO4 = FeSO4 + H2O
FeSO4 + 2NaOH = Fe(OH)2v + Na2SO4
Гидроксид железа(II) сразу окисляется кислородом воздуха.
4Fe(OH)2v + 2Н2O + O2 = 4Fe(OH)3v
Fe(OH)2v + H2SO4 = FeSO4 + 2Н2O
Fe(OH)2v + 2NaOH *
FeSO4 + 6KCN = K4[Fe(CN)6] + K2SO4
FeSO4 + K3[Fe(CN)6] = KFe[Fe(CN)6]v + K2SO4
Свойства соединений железа (+3)
FeCl3 + 3NaOH = Fe(OH)3v + 3NaCl
Fe(OH)3v + 3HCl = FeCl3 + 3H2O
Fe(OH)3v + NaOH? не идет в разбавленном растворе
Fe(OH)3v + NaOH > сплавление > NaFeO2 + 2H2O
FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]v + 3KCl
FeCl3 + 3KCNS = Fe(SCN)3 + 3KCl
Свойства соединений железа (+6)
Феррат калия – окислитель.
Fe2O3 + 3KNO3 + 4KOH > сплавление > 2K2FeO4 + 3KNO2 + 2H2O
4K2FeO4 + 10H2SO4(разб.) = 2Fe2(SO4)3 + 3O2^ + 4K2SO4 + 10H2O
Медь и ее соединения
Медь – мягкий красный металл, хорошо проводит теплоту и электрический ток.
Получение и свойства меди
2CuS + 3O2 > t > 2CuO + 2SO2
CuO + CO > t > Cu + CO2
Cu + 2HCl + Н2O2 = CuCl2 + 2Н2O
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2Н2O
Cu + 4НЖ)3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
4Cu + O2(недостаток) > 200 °C > 2Cu2O
2Cu + O2(избыток) > 500 °C > 2CuO
2Cu + H2O + CO2 + O2 = (CuOH)2CO3v (малахит)
Свойства соединений меди(I)
2Cu2O + O2 > 500 °C > 4CuO
Cu2O + CO > t > 2Cu + CO2
Cu2O + 4(NH3 •Н2O) (конц.) = 2[Cu(NH3)2]OH + 3H2O
Свойства соединений меди(II)
CuO + 2HCl = CuCl2 + Н2O
CuSO4 + 2NaOH = Cu(OH)2v + Na2SO4
Cu(OH)2v > t > CuOv + Н2O
Cu(OH)2v + H2SO4 = CuSO4 + 2H2O
Cu(OH)2v + NaOH? не идет в растворе
Cu(OH)2v + 2NaOH (конц.) > t > Na2[Cu(OH)4]
CuSO4 + 4(NH3 • H2O) = [Cu(NH3)4]SO4 + 4Н2O
[Cu(NH3)4]SO4 + Na2S = CuSv + Na2SO4 + 4NH3
2CuSO4 + 2H2O - (CuOH)2SO4 + H2SO4
2CuSO4 + 4KI = 2CuIv + I2 + 2K2SO4
2Cu(NO3)2 > t > 2CuO + 4NO2 + O2
Серебро и его соединения
3Ag + 4HNO3 (разб.) = 3AgNO3 + NO^ + 2H2O
2AgNO3 + 2NaOH = Ag2Ov + H2O + 2NaNO3
AgNO3 + HCl = AgClv + HNO3
AgClv + 2(NH3 • H2O) = [Ag(NH3)2]Cl + 2H2O
[Ag(NH3)2]Cl + 2HNO3 = AgClv + 2NH4NO3
Ag2O + 4(NH3 •Н2O) (конц.) = 2[Ag(NH3)2]OH + 3H2O
2[Ag(NH3)2]OH + CH3CHO + 2H2O = 2Agv + CH3COONH4 + 3(NH3 • H2O)
Цинк и его соединения
Получение и свойства цинка
2ZnS + 3O2 > t > 2SO2 + 2ZnO
ZnO + CO > t > Zn + CO2
Zn + 2HCl = ZnCl2 + H2^
Zn + H2SO4 (разб.) = ZnSO4 + H2^
4Zn + 5H2SO4 (конц.) = 4ZnSO4 + H2S^ + 4H2O
Zn + 4НHNO3(конц.) = Zn(NO3)2 + 2NO2^ + 2H2O
4Zn + 10HNO3(оч. разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2^
Свойства соединений цинка
ZnSO4 + 2NaOH = Zn(OH)2v + Na2SO4
Zn(OH)2v + H2SO4 = ZnSO4 + 2H2O
Zn(OH)2v + 2NaOH = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2HCl = Zn(OH)2v + 2NaCl + 2H2O
Na2[Zn(OH)4] + 4HCl = ZnCl2 + 2NaCl + 4H2O
Zn(OH)2v + 6NH4OH = [Zn(NH3)6](OH)2 + 6H2O
2ZnSO4 + 2H2O - (ZnOH)2SO4 + H2SO4






