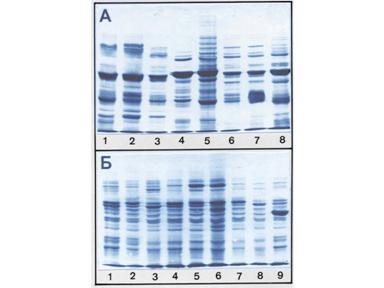
В крови пять основных фракций белков
Плазма крови человека в норме содержит более 100 видов белков. Примерно 90% всего белка крови составляют альбумины, иммуноглобулины, липопротеины, фибриноген, трансферрин; другие белки присутствуют в плазме в небольших количествах.
Синтез белков плазмы крови осуществляют:
· печень – полностью синтезирует фибриноген и альбумины крови, большую часть α- и β-глобулинов,
· клетки ретикулоэндотелиальной системы (РЭС) костного мозга и лимфатических узлов – часть β-глобулинов и γ-глобулины (иммуноглобулины).
Существует довольно много различных методов разделения белков в зависимости от их некоторых качеств. Наиболее распространенным методом фракционирования белков крови является электрофорез..
Электрофорез белков
Ацетатцеллюлозная пленка, гель, специальная бумага (носитель) помещается на рамку, при этом противоположные края носителя свисают в кюветы с буферным раствором. На линию старта наносится сыворотка крови. Метод заключается в движении заряженых молекул белка по поверхности носителя под влиянием электрического поля. Молекулы с наибольшим отрицательным зарядом и наименьшим размером, т.е. альбумины, двигаются быстрее остальных. Наиболее крупные и нейтральные (γ-глобулины) оказываются последними.
На ход электрофореза влияет подвижность разделяемых веществ, находящаяся в зависимости от ряда факторов: заряд белков, величина электрического поля, состав растворителя (буферной смеси), тип носителя (бумага, пленка, гель).

Общий вид электрофореза
Количество выделяемых фракций определяется условиями проведения электрофореза. При электрофорезе на бумаге и пленках ацетата целлюлозы в клинико-диагностических лабораториях выделяют 5 фракций (альбумины, α 1 -, α 2 -, β- и γ-глобулины), в то время как в полиакриламидном геле – до 20 и более фракций. При использовании более совершенных методов (радиальная иммунодиффузия, иммуноэлектрофорез и других) в составе глобулиновых фракций выявляются многочисленные индивидуальные белки.
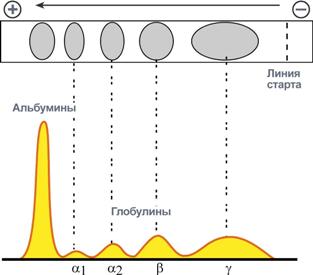
Электрофореграмма (вверху) и графический результат ее обработки (внизу)
На вид протеинограммы оказывают влияние только те белки, концентрация которых достаточно высока.
Нормальные величины белковых фракций плазмы крови
| Общий белок | взрослые | 65-85 г/л |
| дети 1-3 года | 55-85 г/л | |
| Белковые фракции | ||
| Альбумины | 50-70 % | 30-50 г/л |
| α1-Глобулины | 3-6 % | 1-3 г/л |
| α2-Глобулины | 9-15 % | 6-10 г/л |
| β-Глобулины | 8-18 % | 7-11 г/л |
| γ-Глобулины | 15-25 % | 8-16 г/л |
Нормальные величины фракций белков в ликворе и моче можно посмотреть здесь.
Особенности содержания белков в крови у детей
У новорожденных содержание общего белка в сыворотке крови значительно ниже, чем у взрослых, и становится минимальным к концу первого месяца жизни (до 48 г/л). Ко второму-третьему годам жизни общий белок повышается до уровня взрослых.
В течение первых месяцев жизни концентрация глобулиновых фракций низка, что приводит к относительной гиперальбуминемии до 66-76%. В периоде между 2-м и 12-м месяцами концентрация α2-глобулинов временно превышает взрослый уровень.
Количество фибриногена при рождении гораздо ниже, чем у взрослых (около 2,0 г/л), но к концу первого месяца достигает обычной нормы (4,0 г/л).
Типы протеинограмм
В клинической практике для сыворотки выделяют 10 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям.
Тип протеинограммы