В молекуле существует система электронных энергетических уровней. Для химических и оптических свойств молекулы наиболее важны два уровня.
1. ВЗМО –верхняя (по энергии), заполненная молекулярная орбиталь.
2. НСМО – нижняя свободная молекулярная орбиталь.
Значение энергии ВЗМО определяет потенциал ионизации молекулы, а следовательно, способность отдавать электроны – донорные свойства. Потенциалом ионизации называется энергия, которую необходимо затратить, чтобы оторвать электрон от молекулы. Чем выше энергия ВЗМО, тем ниже потенциал ионизации и тем лучший она донор электронов. Например, высоким значением ВЗМО обладает витамин Е, который поэтому легко отдает электрон в реакциях со свободными радикалами, что и обуславливает его антиоксидантные свойства.
Энергия НСМО определяет акцепторные свойства молекулы. Чем ниже энергия НСМО, тем охотнее данная молекула присоединяет электрон.
Схема электронных молекулярных уровней и
Переноса электрона между двумя различными молекулами

На каждом заполненном энергетическом уровне может находиться по два электрона с противоположными спинами. Окислительно-восстановительная реакция между донором и акцептором будет происходить, если энергия ВЗМО донора выше энергии НСМО акцептора.
Схема электронных переходов в биомолекулах

Если молекуле сообщить энергию (например, в виде кванта света), то произойдет переход одного электрона с заполненного уровня на один из незаполненных уровней, и молекула оказывается в электронно-возбужденном состоянии  эти уровни называются синглетными, при переходе между ними спин электрона не меняется. Время жизни молекулы в синглетном состоянии 10-8 – 10-9 секунд. С определенной вероятностью могут реализоваться следующие пути превращения энергии:
эти уровни называются синглетными, при переходе между ними спин электрона не меняется. Время жизни молекулы в синглетном состоянии 10-8 – 10-9 секунд. С определенной вероятностью могут реализоваться следующие пути превращения энергии:
1. 
 В тепло
В тепло
2. 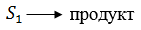 Испускание кванта флуоресценции
Испускание кванта флуоресценции
3. Фотохимическая реакция
4. Передача энергии возбуждения другой молекуле
5.  Обращение спина электрона и переход молекулы в триплетное возбужденное состояние:
Обращение спина электрона и переход молекулы в триплетное возбужденное состояние:
В этом состоянии молекула может находиться 10-4-10 секунд.
Существует несколько путей растраты энергии из триплетного состояния молекулы:
1. 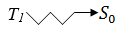 Безизлучательный переход в
Безизлучательный переход в  с обращением спина:
с обращением спина:
2.  Испускание кванта фосфоресценции:
Испускание кванта фосфоресценции:
3. Фотохимическая реакция
4. Передача энергии возбуждения другой молекуле.
Люминесценция биосистем
Люминесценцией называются все виды излучения света, кроме излучения света нагретыми телами. По длительности послесвечения (10-8 сек до суток) люминесценцию подразделяют на флуоресценцию (прекращается одновременно с прекращением возбуждения) и фосфоресценцию (имеет длительное послесвечение). По способу возбуждения люминесценцию подразделяют на следующие виды.
· Катодолюминесценция – это свечение тел, вызванное бомбардировкой вещества электронами или другими заряженными частицами.
· Электролюминесценция – вызывается пропусканием через вещество электрического тока или действием электрического поля. Например, свечение газового разряда в трубках для рекламных надписей.
· Хемилюменисценция – свечение, вызываемое химическими реакциями.
· Фотохемилюминесценция – свечение тел под действием облучения их видимым, ультрафиолетовым светом, рентгеновским или 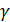 -излучением.
-излучением.
Вещества, дающие сильную люминесценцию, называются люминофорами.
Регистрация люминесценции используется для изучения структуры и функций биосистем различной сложности: от мембран до целых органов и организмов.






