В насыщенном растворе малорастворимого вещества между твердой фазой и раствором устанавливается динамическое равновесие, которое можно представить уравнением:
CaCO3(т.)  Ca2+ + CO32-
Ca2+ + CO32-
Для этого уравнения, используя закон действия масс, запишем выражение константы равновесия
К = 
где [Ca2+], [CO32-] - равновесные концентрации ионов в растворе;
[CaCO3] - концентрация вещества в осадке (в твердой фазе), она постоянна.
Умножив К на постоянную величину [CaCO3], получим константу, называемую произведением растворимости, Ksp:.
К×[CaCO3] = Ksp = [Ca2+]× [CO32-]
Произведение растворимости – это произведение концентраций ионов малорастворимого вещества в его насыщенном растворе в степенях их стехиометрических коэффициентов. Числовые значения произведения растворимости малорастворимых веществ представлены в специальных справочных таблицах.
В присутствии одноименных ионов равновесие смещается в сторону образования осадка (эффект одноименного иона). В присутствии сильных электролитов, не содержащих общих ионов, подвижность ионов в растворе уменьшается и равновесие смещается в сторону большего растворения осадка (солевой эффект).
При смешивании растворов, содержащих ионы, дающие нерастворимую соль, начинается выпадение осадка. В первые моменты времени концентрация ионов в растворе велика и осадок выпадает. Постепенно концентрация ионов уменьшается и в растворе устанавливается равновесие.
Условие образования осадка: произведение концентраций ионов в растворе должно быть больше, чем величина произведения растворимости данного соединения. Например,
[Ca2+] [CO32-] > Ksp (CaCO3).
Условие растворения осадка: произведение концентраций ионов в растворе (Pi) меньше, чем величина произведения растворимости данного соединения ([Ca2+] [CO32-] < Ksp(CaCO3)).
Связь между произведением растворимости и растворимостью
малорастворимого вещества
Рассмотрим в общем виде схему растворения малорастворимого вещества типа KxAy:
KxAy  x ky+ + y Ax-
x ky+ + y Ax-
Выражение произведения растворимости для этого уравнения имеет вид:
Ksp = [Ky+]x [Ax-]y
Обозначим молярную растворимость вещества через “S”. Тогда раствор будет содержать катионов [Ky+]=xS (моль/л), анионов - [Ax-]=yS (моль/л). Подставим эти обозначения в выражение произведения растворимости:
Ksp = [xS]x [yS]y,
отсюда находим растворимость S:

Примеры решения задач
Пример 29. Выведите формулу зависимости произведения растворимости Ksp от растворимости S для Ag2S.
Решение. Ag2S  2 Ag + + S2 -
2 Ag + + S2 -
Согласно уравнению диссоциации соли,
[Ag +] = 2 S (моль/л), [S2 -] = S (моль/л).
Ksp = (2 S) 2 (S) = 4 S 3, или

Пример 30. Вычислите растворимость AgCl в присутствии 0.01 M раствора HCl.
Решение. AgCl  Ag+ + Cl-
Ag+ + Cl-
s s (s+0.01 моль/л» 0.01 моль/л)
KSp (AgCl) = [Ag+]×[Cl-] = s × 0.01 = 1,6×10-10, s = 1,6×10-8 моль/л
Пример 31. Выпадет ли осадок PbCl2 при смешивании равных объемов 0.01M раствора Pb(NO3)2 и 0.02M раствора of HCl?
Решение. Pb(NO3)2 + 2HCl ® PbCl2 + 2HNO3
Pb 2+ + 2Cl - ® PbCl2
При смешивании равных объемов рстворов концентрации реагирующих веществ уменьшаются в 2 раза. Концентрации ионов в растворе составляют:
[Pb2+] = C(Pb(NO3)2) = 0.01 / 2 = 0.005 моль/л
[Cl-] = C(HCl) = 0.02 / 2 = 0.01 моль/л
Произведение концентраций ионов в растворе:
Pi = [Pb2+]×[Cl-]2 = 0.005 ´ (0.01)2 = 5×10-7
Из таблицы находим, что KSp(PbCl2) = 1.6×10-5.
Так как Pi < Ksp, то осадок PbCl2 не образуется.
ГИДРОЛИЗ СОЛЕЙ
Если растворенная в воде соль содержит ионы-остатки слабых кислот или слабых оснований, то происходит процесс гидролиза соли - обменной реакции ионов соли с молекулами воды, приводящей к образованию молекул и ионов новых слабых электролитов.
Основные правила написания реакций гидролиза:
1. Гидролизу подвергаются анионы слабых кислот и катионы слабых оснований, входящих в состав соли.
2. Гидролиз - процесс ступенчатый. На каждой ступени один гидролизующийся ион реагирует с одной молекулой воды.
3. В обычных условиях гидролиз протекает только по первой ступени. Гидролиз усиливается при нагревании и разбавлении растворов солей.
4. Гидролиз - процесс, как правило, обратимый, его равновесие можно смещать. Добавление одноименных ионов (Н+ или ОН  ), выделяющихся в процессе гидролиза, смещает равновесие в сторону уменьшения гидролиза. Добавление противоположных ионов, связывающих выделяющиеся ионы Н+ и ОН
), выделяющихся в процессе гидролиза, смещает равновесие в сторону уменьшения гидролиза. Добавление противоположных ионов, связывающих выделяющиеся ионы Н+ и ОН  в молекулы воды, смещает равновесие в сторону усиления гидролиза.
в молекулы воды, смещает равновесие в сторону усиления гидролиза.
Типы реакций гидролиза.
1. Соль образована ионами сильного основания и сильной кислоты (например, NaCl, KNO3 и др.).
NaCl + H2O  гидролиз не идет (NaOH - сильное основание, HCl - сильная кислота).
гидролиз не идет (NaOH - сильное основание, HCl - сильная кислота).
2. Соль образована ионами сильного основания и слабой кислоты (например, Na2CO3, KSCN и др.).
Na2CO3 + Н2О  гидролиз по аниону (NaOH - сильное основание, H2CO3 - cлабая кислота).
гидролиз по аниону (NaOH - сильное основание, H2CO3 - cлабая кислота).
CO32  + HOH
+ HOH  HCO3
HCO3  + OH
+ OH  (среда щелочная, рН>7).
(среда щелочная, рН>7).
Na2CO3+ HOH  NaHCO3 + NaOH (1 ступень гидролиза).
NaHCO3 + NaOH (1 ступень гидролиза).
Добавление к раствору щелочей (NaOH), содержащих одноименные ионы (OH  ), вызывает ослабление гидролиза (смещение равновесия влево по принципу Ле Шателье). Добавление к раствору кислот усиливает гидролиз за счет реакции Н++OH
), вызывает ослабление гидролиза (смещение равновесия влево по принципу Ле Шателье). Добавление к раствору кислот усиливает гидролиз за счет реакции Н++OH 
 Н2О, в результате которой концентрация ионов OH
Н2О, в результате которой концентрация ионов OH  в растворе уменьшается, и равновесие гидролиза смещается вправо. Гидролиз усиливается и начинает идти по второй ступени:
в растворе уменьшается, и равновесие гидролиза смещается вправо. Гидролиз усиливается и начинает идти по второй ступени:
НCO3  + HOH
+ HOH  H2CO3 + OH
H2CO3 + OH 
NaНCO3 + HOH  H2CO3 + NaOH (2 ступень гидролиза).
H2CO3 + NaOH (2 ступень гидролиза).
3. Соль образована ионами слабого основания и сильной кислоты (например, AlCl3, FeSO4 и др.).
AlCl3 + H2O  гидролиз по катиону (Al(OH)3 - слабое основание, НCl - cильная кислота).
гидролиз по катиону (Al(OH)3 - слабое основание, НCl - cильная кислота).
Al3+ + HOH  AlOH2+ + H+ (среда кислая, рН<7)
AlOH2+ + H+ (среда кислая, рН<7)
AlCl3 + HOH  AlOHCl2 + HCl (1 ступень гидролиза).
AlOHCl2 + HCl (1 ступень гидролиза).
4. Соль образована ионами слабого основания и слабой кислоты:
а) соль растворима в воде (например, (NH4)2CO3, NH4NO2 и др.).
(NH4)2CO3 + H2O  гидролиз идет сразу по катиону и аниону:
гидролиз идет сразу по катиону и аниону:
2NH4+ + CO32  + HOH
+ HOH  NH4OH + HCO3
NH4OH + HCO3  + NH4+ (рН
+ NH4+ (рН  7)
7)
(NH4)2CO3 + HOH  NH4OH + NH4HCO3
NH4OH + NH4HCO3
б) соль нерастворима в воде (например, FeS, ZnSiO3 и др.).
FeS + H2O  нерастворимые соли гидролизу не подвергаются.
нерастворимые соли гидролизу не подвергаются.
в) соль разлагается водой (в таблице растворимости стоит прочерк, например, Fe2S3, Al2(CO3)3 и др.). Гидролиз таких солей идет необратимо и до конца: Fe2S3+6H2O  2Fe(OH)3
2Fe(OH)3  +3H2S
+3H2S 
Количественно гидролиз описывается величинами константы гидролиза (Kh) и степени гидролиза (h).
NaCN + H2O  NaOH + HCN
NaOH + HCN 
CN- + H2O  OH- + HCN; pH > 7
OH- + HCN; pH > 7
Константу гидролиза можно выразить через концентрации ионов в растворе с учетом того, что концентрация воды практически не изменяется, или по правилу вычисления константы равновесия обратимой реакции:
K  =
= 
NH4Cl + H2O  NH4OH + HCl
NH4OH + HCl
NH4+ + H2O  H+ + NH4OH; pH < 7
H+ + NH4OH; pH < 7
Kh = 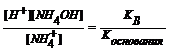
NH4CH3COO + H2O  NH4OH + CH3COOH
NH4OH + CH3COOH
NH4+ + CH3COO  + H2O
+ H2O  NH4OH + CH3COOH
NH4OH + CH3COOH
Kh = 
Степень гидролиза “ h ” определяет ту часть соли, которая подверглась гидролизу при данных условиях:  .
.
Степень гидролиза связана с константой гидролиза:
Kh =  .
.
В том случае, когда h << 1, Kh = h 2 C.
Пример. Вычисление рН 0,1 М раствора фосфата калия.
Будем считать, что гидролиз протекает в основном по первой ступени:
PO43  + HOH
+ HOH  HPO42
HPO42  + OH
+ OH 
Кг =  =
=  = 7,69 10
= 7,69 10  3
3
h =  =
=  =
=  = 2,77 10
= 2,77 10  1
1
[OH  ] = hC = 2,77 10
] = hC = 2,77 10  1 * 0,1 = 2,77 10
1 * 0,1 = 2,77 10  2;
2;
[H+] = 10  14 / [OH
14 / [OH  ] = 10
] = 10  14 / 2,77 10
14 / 2,77 10  2 = 3,61 10
2 = 3,61 10  13;
13;
рН= -lg[H+] = 12,44.
Смещение равновесия реакции гидролиза
Если в раствор гидролизующейся соли ввести реактив, связывающий образующиеся при гидролизе ионы Н+ или ОН  , то в соответствии с принципом Ле Шателье равновесие смещается в сторону усиления гидролиза; в результате гидролиз может протекать полностью - до образования конечных продуктов. Например, добавление к раствору карбоната натрия небольшого количества сильной кислоты приведет к усилению гидролиза за счет связывания образующихся в процессе гидролиза ионов ОН
, то в соответствии с принципом Ле Шателье равновесие смещается в сторону усиления гидролиза; в результате гидролиз может протекать полностью - до образования конечных продуктов. Например, добавление к раствору карбоната натрия небольшого количества сильной кислоты приведет к усилению гидролиза за счет связывания образующихся в процессе гидролиза ионов ОН  :
:
Na2CO3 + H2O  NaHCO3 + NaOH
NaHCO3 + NaOH
CO32  + HOH
+ HOH  HCO3
HCO3  + OH
+ OH 
OH  + H+
+ H+  H2O
H2O
В результате становится возможной и вторая ступень гидролиза карбоната натрия:
NaHCO3 + H2O  H2CO3 + NaOH
H2CO3 + NaOH
HCO3  + HOH
+ HOH  H2CO3 + OH
H2CO3 + OH  .
.
Добавляя к системе избыток одного из образующихся при реакции веществ (кислоты или щелочи), можно подавить гидролиз (сместить равновесие гидролиза в обратную сторону). Так, в случае карбоната натрия растворы щелочей ослабляют или даже полностью прекращают гидролиз соли.
Подкисление или подщелачивание растворов солей часто используют на практике для стабилизации их разбавленных растворов.
Равновесие реакции гидролиза может смещаться в сторону его усиления, если продуктом одной из ступеней гидролиза будет малорастворимое соединение:
Bi(NO3)3 + HOH  BiOH(NO3)2 + HNO3
BiOH(NO3)2 + HNO3
Bi3+ + HOH  BiOH2+ + H+
BiOH2+ + H+
При разбавлении раствора равновесие реакции смещается вправо за счет образования осадка нитрата оксовисмута:
BiOH(NO3)2 + HOH  Bi(OH) 2NO3 + HNO3
Bi(OH) 2NO3 + HNO3

BiONO3  + H2O
+ H2O
BiOH2+ + HOH + NO3 
 BiONO3 + H+
BiONO3 + H+
Аналогично протекает гидролиз хлорида сурьмы (III).
Гидролиз соли можно усилить также нагревая или разбавляя ее раствор.
Взаимный гидролиз
Ионы Н+ (или ОН  ) можно связать в молекулы воды, вводя в раствор не только щелочь (или кислоту), но и другую соль, гидролиз которой приводит к накоплению в растворе ионов ОН
) можно связать в молекулы воды, вводя в раствор не только щелочь (или кислоту), но и другую соль, гидролиз которой приводит к накоплению в растворе ионов ОН  (или Н+); ионы Н+ и ОН
(или Н+); ионы Н+ и ОН  будут нейтрализовать друг друга, что вызовет взаимное усиление гидролиза обеих солей и в результате - образование конечных продуктов гидролиза (взаимный гидролиз). Например, при смешивании растворов Na2CO3 и AlCl3 , в которых соответственно имеется избыток ионов ОН
будут нейтрализовать друг друга, что вызовет взаимное усиление гидролиза обеих солей и в результате - образование конечных продуктов гидролиза (взаимный гидролиз). Например, при смешивании растворов Na2CO3 и AlCl3 , в которых соответственно имеется избыток ионов ОН  и Н+ соответственно, взаимное усиление гидролиза приводит к выделению СО2 и образованию осадка Al(OH)3:
и Н+ соответственно, взаимное усиление гидролиза приводит к выделению СО2 и образованию осадка Al(OH)3:
2AlCl3 + 3Na2CO3 + 3H2O  2Al(OH)3
2Al(OH)3  + 3CO2
+ 3CO2  + 6NaCl
+ 6NaCl
2Al3+ + 3CO32  + 3H2O
+ 3H2O  2Al(OH)3
2Al(OH)3  + 3CO2
+ 3CO2 
В осадок в подобных случаях выпадает наименее растворимый из возможных продуктов гидролиза. Так, растворимость карбоната гидроксомеди (CuOH)2CO3 меньше, чем растворимость гидроксида меди Cu(OH)2 . Поэтому при сливании растворов CuSO4 и Na2CO3 конечным продуктом гидролиза является именно (CuOH)2CO3:
2CuSO4 + 2Na2CO3 + H2O  (CuOH)2CO3
(CuOH)2CO3  + CO2
+ CO2  + 2Na2SO4
+ 2Na2SO4
2Cu2+ + 2CO32  + H2O
+ H2O  (CuOH)2CO3
(CuOH)2CO3  + CO2
+ CO2 
Взаимный гидролиз - необратимый процесс.
Примеры решения задач
Пример 32. Запишите уравнения реакций гидролиза следующих солей и определите реакцию среды (нейтральная, кислая, щелочная): a)FeCl2; б)Na2CO3; в) KCl; г) Fe2S3.
Решение.
а) Запишем уравнение диссоциации соли и определим силу кислоты и основания, образующих данную соль:
FeCl2  Fe2+ + 2Cl-
Fe2+ + 2Cl-
Соль образована слабым основанием Fe(OH)2 и сильной кислотой HCl. В гидролизе участвует ион слабого основания, гидролиз идет по катиону:
Fe2+ + HOH  FeOH+ + H+ (кислая среда рН < 7),
FeOH+ + H+ (кислая среда рН < 7),
Так как ионы Cl- не принимают участия в гидролизе, то они присутствуют в неизменной форме в левой и правой частях уравнения:
Fe2+ + 2Cl- + HOH  FeOH+ + H+ + 2Cl-
FeOH+ + H+ + 2Cl-
Для того, чтобы записать уравнение реакции гидролиза в молекулярной форме, объединим ионы в молекулы в соответствии с их зарядами:
FeCl2 + HOH  FeOHCl + HCl –уравнение реакции гидролиза в молекулярной форме.
FeOHCl + HCl –уравнение реакции гидролиза в молекулярной форме.
б) Na2CO3  2Na+ + CO32-
2Na+ + CO32-
Cоль образована сильным основанием NaOH и слабой кислотой Н2СО3. В гидролизе участвует ион слабой кислоты, гидролиз идет по аниону:
СО32- + НОН  НСО3- + ОН- (щелочная среда рН > 7),
НСО3- + ОН- (щелочная среда рН > 7),
Так как ионы Na+ не принимают участия в гидролизе, то они присутствуют в неизменной форме в левой и правой частях уравнения:
2Na+ + CO32- + HOH  HCO3- + OH- + 2Na+
HCO3- + OH- + 2Na+
Для того, чтобы записать уравнение гидролиза в молекулярной форме, объединим ионы в молекулы в соответствии с из зарядами:
Na2CO3 + HOH  NaHCO3 + NaOH
NaHCO3 + NaOH
в) KCl – эта соль гидролизу не подвергается, т.к. образована сильным основанием – КОН и сильной кислотой HCl. Среда нейтральная, рН = 7.
г) Fe2S3
В таблице растворимости для соли Fe2S3 стоит прочерк, это значит, что гидролиз соли идет необратимо и до конца, до образования соответствующих основания и кислоты:
Fe2S3 + 6H2O = 2Fe(OH)3¯ + 3H2S
Пример 33. Рассчитайте константу гидролиза в растворе хлорида аммония.
Решение.
NH4Cl + H2O  NH4OH + HCl
NH4OH + HCl
NH4+ + H2O  H+ + NH4OH; pH <7
H+ + NH4OH; pH <7

Коллоидные растворы
Коллоидные системы – это ультрамикрогетерогенные системы, состоящие из двух фаз: дисперсионной среды и дисперсной фазы. Дисперсная фаза коллоидных растворов состоит из молекулярных агрегатов размером 10 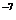 - 10
- 10  cм.
cм.
Классификация коллоидных систем
1. Агрегатное состояние дисперсионной фазы и дисперсной среды.
| Дисперсная фаза Дисперси- онная среда | Газ | Жидкость | Твердая |
| Газ | - | Аэрозоли (облака, туман) | Аэрозоли (дым, пыль) |
| Жидкость | Эмульсии (пена) | Эмульсии (молоко, нефть) | Золи, Суспензии (природные воды) |
| Твердая | Твердые эмульсии (капиллярные системы, активированный уголь) | Гели (почва, жемчуг, сыр) | Литозоли (природные минералы, сплавы) |
2. Взаимодействие дисперсной фазы и дисперсионной среды (тип классификации используется только для жидких дисперсионных сред). Коллоидные системы делятся на лиофобные и лиофильные.
В лиофобных коллоидных системах дисперсная фаза слабо взаимодействует с дисперсионной средой. Такие системы не могут быть получены самопроизвольно, частицы дисперсной фазы всегда представляют собой агрегаты молекул (необратимые коллоиды).
В лиофильных коллоидных системах (обратимые коллоиды) дисперсная фаза растворима в дисперсионной среде. Ее частицами являются отдельные молекулы больших размеров (макромолекулы).
Свойства лиофобных коллоидных растворов
1. Гетерогенные системы (имеются поверхности раздела фаз).
2. Коллигативные свойства коллоидных растворов практически не отличаются от соответствующих свойств дисперсионной фазы.
3. Не делятся механическими методами (отстаивание, фильтрование).
4. Плохо проходят через мембраны и полупроницаемые пленки.
5. При прохождении света через коллоидные растворы наблюдается конус Тиндаля (дифракция света на коллоидных частицах).
6. Так как дифракция коротковолнового излучения происходит в большей степени, чем дифракция длинноволнового излучения, то бесцветные коллоидные растворы в отраженном свете имеют голубой цвет, а в проходящем – красный.
7. Коллоидные частицы заряжены и могут перемещаться под действием электрического поля (электрофорез).
Строение коллоидной мицеллы и электрические свойства коллоидных систем
Коллоидные частицы имеют малые размеры и могут существовать во взвешенном состоянии неограниченное время. Это определяет кинетическую устойчивость коллоидных систем. С другой стороны, большая поверхность раздела коллоидной частицы определяет избыточное поверхностное натяжение и тенденцию к «слипанию» коллоидных частиц, которая уменьшает энергетическую нестабильность коллоидных систем.
Стабилизация коллоидных систем происходит за счет адсорбции молекул дисперсионной среды или ионов электролита, находящегося в растворе. На границе коллоидной частицы формируется двойной электрический слой, коллоидные частицы приобретают одинаковый заряд, что препятствует их «слипанию».
Ионы, которые формируют заряд коллоидной частицы, называются потенциалобразующими ионами. К ним притягиваются ионы с противоположным зарядом – противоионы, которые располагаются в адсорбционном и диффузионном слоях мицеллы.
Между адсорбционным и диффузионным слоями происходит ионный обмен. Коллоидная частица заряжена, а мицелла электронейтральна.
Пример. Строение мицеллы коллоидной частицы иодида серебра.
Реакция образования иодида серебра может быть представлена в виде:
KI (избыток) + AgNO3  AgI
AgI  + KNO3
+ KNO3
Строение мицеллы: {m[AgI] nI  (n-x)K+}
(n-x)K+}  xK+
xK+
где “m” – число молекул иодида серебра в ядре; “n” – число анионов в первом адсорбционном слое коллоидной частицы; n + x = m; обычно m >> n.
Если в избытке находится нитрат серебра, то на поверхности ядра коллоидной частицы в первую очередь группируются ионы серебра, достраивая кристаллическую решетку твердой фазы, а в качестве противоионов выступают нитрат-анионы.
На поверхности ядра мицеллы возникает электрический межфазный потенциал (j - потенциал), который уменьшается при увеличении расстояния от поверхности ядра за счет адсорбции противоионов.
      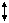              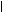        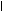     
 _ А _
j _ А _
j  _ _ _ _
 _ _
x +
d B r
(толщина адсорбционного слоя) _ _
x +
d B r
(толщина адсорбционного слоя)
| Если поместить коллоидную частицу в электрическое поле, то противоионы диффузного слоя отрываются от коллоидной частицы и перемещаются в сторону соответствующего электрода, а коллоидная частица – в противоположную сторону. В ее составе остается часть диффузионного слоя (линия АВ показывает границу поверхности скольжения). |
Потенциал коллоидной частицы на поверхности скольжения называется электрокинетическим потенциалом или x (зета)- потенциалом.
x -потенциал является мерой устойчивости коллоидных систем: если ½x½< 30 mV, происходит коагуляция (разрушение) коллоидных частиц.
Введение индифферентных сильных электролитов в коллоидные растворы приводит к уменьшению величины x-потенциала в связи с увеличением концентрации противоионов и сжатием диффузного слоя. В том случае, когда концентрация индифферентного электролита достаточно велика, возможно достижение изоэлектрического состояния (x=0).
При введении сильного электролита, содержащего одноименные ионы, происходит дополнительная адсорбция потенциалобразующих ионов на поверхности коллоидной частицы, что приводит к увеличению x-потенциала. После достижения максимально возможной адсорбции электролит, содержащий одноименные ионы, начинает действовать так же, как и индифферентный электролит, то есть x-потенциал уменьшается и после достижения критической величины наступает коагуляция коллоидных частиц.
Коагулирующая способность электролитов характеризуется величиной порога коагуляции – минимальной концентрацией электролита, которая вызывает коагуляцию коллоидного раствора. Порог коагуляции уменьшается с увеличением заряда коагулирующего иона (иона, знак заряда которого аналогичен знаку заряда противоиона коллоидных частиц). Для моно-, ди- и трехзарядных ионов отношение их порогов коагуляции составляет 1:11:72.
В некоторых случаях процесс коагуляции является обратимым. Процесс обратной трансформации коагулята в коллоидный раствор называется пептизация или дезагрегация.
Устойчивость лиофобных золей увеличивается при добавлении небольших количеств растворов высокомолекулярных соединений (например, растворов желатины, таннина и др.). Защитное действие растворов высокомолекулярных соединений связано с образованием адсорбированного защитного слоя на поверхности коллоидной частицы. Характеристикой защитного действия является защитное число – минимальное количество (мг) твердого вещества, которое предотвращает коагуляцию 10 мл коллоидного раствора при добавлении сильного электролита в количестве, определяемом порогом коагуляции.
Условиями образования коллоидных растворов являются нерастворимость дисперсной фазы в дисперсионной среде и присутствие стабилизатора.
Свойства лиофильных коллоидных растворов
(растворов высокомолекулярных соединений, ВМС)
1. Гомогенные системы.
2. Образуются самопроизвольно и термодинамически устойчивы.
3. Коллигативные свойства определяются концентрацией ВМС.
4. Коллоидные частицы могут иметь заряд (ионные ВМС) или быть незаряженными.
5. Порог коагуляции электролитов-коагуляторов значительно превышает порог коагуляции для лиофобных коллоидных систем. Механизм действия коагуляторов связан с процессами десольватации ВМС (высаливание). В результате высаливания обычно возникают образования, похожие на коагуляты: волокна, хлопья, творожистые осадки. В некоторых случаях образуются капли второй жидкой фазы – структурированной жидкости, приближающейся по свойствам к студню. Это явление носит название коацервации и характерно для многих белков. Концентрация ВМС в коацерватных каплях увеличивается, а в остальном растворе – уменьшается по сравнению с исходной.
6. Концентрированные растворы ВМС характеризуются значительной вязкостью.
Методы приготовления коллоидных растворов
1. Дисперсионные методы (измельчение крупных агрегатов молекул до размеров коллоидных частиц):
а) механическая дисперсия (перемолка с помощью механических приспособлений – шаровых мельниц, гриндеров и др);
б) электрическая дисперсия (измельчение с помощью электрического тока), используется для получения золей металлов и других токопроводящих материалов;
в) метод пептизации (свежеприготовленный осадок промывают раствором электролита-стабилизатора. Пример. пептизация гексацианоферрата (II) калия раствором щавелевой кислоты, стабилизатор – оксалат-ион:
K4[Fe(CN)6] + FeCl3  KFe[Fe(CN)6]
KFe[Fe(CN)6]  + 3KCl
+ 3KCl
H2C2O4  2H+ + C2O42-
2H+ + C2O42-
{m[KFe[Fe(CN)6]] n C2O42- (n-x)H+}  xH+.
xH+.
2. КОНДЕНСАЦИОННЫЕ МЕТОДЫ (образование агрегатов из отдельных молекул – образование коллоидных растворов в процессе химических реакций):
а) реакции ионного обмена
3H2S (избыток) + As2O3  As2S3
As2S3  + 3H2O
+ 3H2O
{m[As2S3] nS2- (n-2x)H+}  2xH+
2xH+
б) окислительно-восстановительные реакции
восстановление:
2HAuCl4 + 5K2CO3  2KAuO2 + 5CO2 + 8HCl + H2O
2KAuO2 + 5CO2 + 8HCl + H2O
KAuO2 + HCHO  Au
Au  + HCOOK + H2O
+ HCOOK + H2O
{m[Au] nAuO2- (n-x)K+}  xK+
xK+
окисление: 2H2S + O2  S
S  + 2H2O
+ 2H2O
Побочная реакция: 2H2S + 7O2  2H2O + H2S5O6
2H2O + H2S5O6
(полисерная кислота – стабилизатор коллоидной серы)
{m[S] nS5O62- (n-2x)H+}  2xH+
2xH+
в) реакции гидролиза
Кипячение разбавленных растворов FeCl3 приводит к полному гидролизу и образованию золя Fe(OH)3^
1 cтупень: FeCl3 + H2O  FeOHCl2 + HCl
FeOHCl2 + HCl
2 cтупень: FeOHCl2 + H2O  Fe(OH)2Cl + HCl
Fe(OH)2Cl + HCl
Fe(OH)2Cl  FeOCl + H2O
FeOCl + H2O
3 cтупень: Fe(OH)2Cl + H2O  Fe(OH)3
Fe(OH)3  + HCl
+ HCl
Стабилизаторами коллоидного раствора Fe(OH)3 могут служить FeCl3, FeOCl, HCl:
{m[Fe(OH)3] nFe3+ (n-3x)Cl-} X + 3xCl-
{m[Fe(OH)3] nFeO+ (n-x)Cl-} X + xCl-
{m[Fe(OH)3] nH+ (n-x)Cl-} X + xCl-
комплексные соединения
Комплексными соединениями называются соединения, которые образованы из отдельных, способных к самостоятельному существованию сравнительно простых химических частиц (катионов, анионов, молекул). Примерами комплексных соединений могут служить Na3[Co(NO2)6]; [Cu(NH3)4]SO4; K4[Fe(CN)6].
Простейшим комплексным соединением является катион аммония: NH3 + H+ = NH4+
Строение комплексных соединений
Один из атомов комплексного соединения, обычно положительно заряженный катион металла, занимает центральное место в комплексе (центральный ион или ион-комплексообразователь). Нейтральные молекулы или ионы с противоположным зарядом (лиганды) образуют с центральным ионом химические связи по донорно-акцепторному механизму. Центральный ион и лиганды образуют внутреннюю сферу комплексного соединения (комплексный ион), который обычно записывают в квадратных скобках. Химическая связь во внутренней сфере комплексных соединений образуется по донорно-акцепторному механизму с участием пустых орбиталей катиона металла и неподеленных пар электронов атомов лигандов.
Противоположно заряженные ионы, электростатически связанные с комплексным ионом и нейтрализующие его заряд, носят название внешней сферы комплекса. Внешняя и внутренняя сферы комплекса связаны между собой ионной связью.
Общее число химических связей, которые образует с лигандами ион-комплексообразователь, называется координационным числом центрального иона. Координационное число зависит от заряда иона-комплексообразователя (для однозарядных ионов к.ч. = 1, для двухзарядных – 4 или 6, для трехзарядных – 6 и выше), и размера иона (чем больше ион-комплексообразователь, тем выше к.ч., для ионов лантанидов и актинидов к.ч. может доходить до 12).
Число химических связей, образованных одним лигандом с центральным атомом, называется дентатностью лиганда. Выделяют моно-, би- и полидентатные лиганды. Дентатность определяется числом неподеленных пар электронов в молекуле лиганда и их взаимным направлением. Например, молекула аммиака имеет одну пару электронов у атома азота :NH3, поэтому аммиак – монодентатный лиганд. Молекула воды имеет 2 пары электронов, а хлорид-ион – четыре. Однако в связи с тем, что валентные орбитали кислорода и хлора находятся в состоянии sp 3 -гибридизации и расположены под углом 109°28’, то они не могут образовать связь с одним центральным ионом, поэтому такие лиганды монодентатны. Исключение – полиядерные комплексы, например, Na2[CuCl6]:

Например, для соединения K3[Fe(CN)6]:
1. Внешнюю сферу составляют ионы 3К+.
2. Внутреннюю сферу (комплексный ион) составляют ионы [Fe(CN)6]3–.
3. Центральный ион (комплексообразователь) – Fe3+.
4. Координационное число комплексообразователя равно 6.
5. Лиганды – CN– анионы, их дентатность равна 1 (монодентатные).
Номенклатура комплексных соединений
Название комплексных соединений аналогично названию простых солей и состоит из названия аниона и названия катиона. В комплексном ионе сначала называют анионные частицы (с окончанием «о»), затем нейтральные и, наконец, ион-комплексообразователь. Число лигандов обозначают с помощью гречиских числительных. Если комплексный ион несет отрицательный заряд, то ион-комплексообразователь называют в латинской транскрипции с окончанием «ат», а если комплексный ион заряжен положительно или не имеет заряда, то центральный ион называют в русской транскрипции:
[Cu(NH3)4]Cl2 – хлорид тетрааминмеди (II);
K2[Cu(ОН)4] – тетрагидроксокупрат (II) калия;
Н[HgCl2] – дихлоромеркурат (I) водорода;
[Cr(NH3)3Cl3] – трихлоротриаминхром (III).
Классификация комплексных соединений






