Принцип наименьшей энергии. Электроны в невозбуждённом атоме распределяются по энергетическим уровням так, чтобы их суммарная энергия была минимальна. Максимальное число электронов на подуровне е l =2(2 l +1); уровне е n = 2n2
Правило Клечковского. Заполнение энергетических подуровней происходит от подуровней с более низкого энергетического уровня в порядке: 1s<2s<2р<3s<3р<4s<3d<4p<5s<4d<5p<6s<4f≈5d<6p<7s<5f ≈6d<6р
Квантовые числа. Главное n – определяет энергию (номер) уровня; орбитальное l «эль»– определяет энергию и форму атомной орбитали подуровня; магнитное ml – характеризует число атомных орбиталей в подуровне; спиновое ms – характеризует направление собственного момента количества движения электрона; ms ±=1/ 2. n = 1(К), 2(L), 3(M), 4(N), 5(O), 6(P), 7(Q)…∞
l = 0(s), 1(p), 2(d), 3(f), 4(q)…(n-1); ml = - l,…,-1,0,+1,…+ l.


| Принцип Паули. В атоме не может быть двух электронов с одинаковым набором значений всех четырёх квантовых чисел. Правило Гунда. Заполнение электронами подуровня осуществляется таким образом, чтобы спиновое число было максимальным. |
2.4. Периодический закон Д.И. Менделеева Свойства элементов и их соединений находятся в периодической зависимости от заряда атомных ядер элементов. 2.5. Атомы с различным числом протонов и нейтронов, но с одинаковой их суммой называются изобарами. Атомы с одинаковым числом нейтронов – изотонами (n1=n2), с одинаковым числом протонов – изотопами (p1=p2). В ряду атомов 4020Са, 4220Са, 4018Аr, 4029К изотопы - 4020Са (20 р, 20 n), 4220Са (20 р, 22 n). изотоны - 4220Са (20 р, 22 n), 4018Аr (18 р, 22 n), изобары - 4020Са (20 р, 20 n), 4018Аr (18 р, 22 n), 4029К (19 р, 21 n).
4.2. Сродство к электрону Еср - энергия, выделяющаяся при присоеди-нении электрона атомом с образованием аниона. Количественная мера неметаличности атома. Энергия ионизации атомов Еион - энергия, необходимая для отрыва электрона от атома с образованием катиона. Наименьшая у щелочных металлов. А + е- = А- + Еср; А + Еион = А+ + е-
Причина образования хим. связи – при сближении атомов между их внешними валентными электронами спротивоположными спинами происходит притяжение с уменьшением энергии системы, следовательно образование хим. связи сопровождается выделением, а разрыв - поглощением энергии. Энергия связи – энергия, выделяющаяся в процессе образования связи (Есв, кДж/моль) и длина связи – расстояние между центами ядер соединяемых атомов, (rсв, пм) характеризуют её прочность.
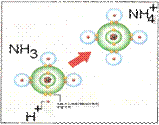
Ковалентная (или объединённая) химическая связь- образующаяся за счет объединения одной или нескольких электронных пар, примерно одинаково сильно взаимодействующих с ядрами обоих соединяемых атомов. Есв 100-1000 кДж/моль. Образуется между атомами элементов электоотрицательности которых одинаковы (неполярная) или различаются не слишком сильно (полярная): Н2, F2, НF, СН4, СО2, Н 2О, NН3. Насыщаемость. Валентные электроны, участвующие в образовании ковалентной связи не могут участвовать в образовании дополнительных связей. Направленность связи или пространственная конфигурация объясняется с учётом гибридизации, т.е. смешения различного типа атомных орбиталей с возникновением того же числа гибридных орбиталей одинаковых по форме и энергии: тип молекулы АВ2 _(где А- центральный атом) sp1 тип гибридизации, угол связи 180◦, пространственная конфигурация линейная; тип молекулы АВ3 - sp2 гибридизация - угол связи 120◦, треугольная; тип молекулы АВ4 - sp3 гибридизация - 109◦, тетраэдрическая; тип молекулы АВ5 - sp3d гибридизация – тригональная бипирамида; тип молекулы АВ6 sp3 d2 – форма октаэдрическая. Кратность ковалентной связи характеризуется числом общих электронных пар между соединяемыми атомами: одна пара – простая (ординарная) связь (всегда σ), Две пары – двойная (σ и π), три – тройная (σ и две π).
Ковалентная связь (рисунки):

| 
| 
| 
|
| ординарная | Двойная | тройная | донорно-акцепторная |
| Ионная связь – сильное взаимодействие общей электронной пары с ядром только одного из соединяемых атомов, что приводит к образованию электростатически притягивающихся разноимённо заряженных ионов.Электрическое поле иона имеет сферическую симметрию, катион взаимодействует со всеми анионами, находящимися поблизости, т.е. ионная связь не обладает направленностью и насыщаемостью. Металлическая связь – между атомами металлов (в узлах решётки атомы и катионы металла между которыми перемещаются обобществленные электроны или «электронный газ»). Характерна для твёрдых и расплавленных металлов, для газообразных – ковалентная. 4.3.. Межмолекулярное взаимодействие (Межмолекулярные взаимодействия): ион-ионное – между противоположно заряженными ионами, Есв=140-460 кДж/моль, увеличивается с ростом зарядов ионов и уменьшением их радиуса; ион-дипольное – между ионом и полярной молекулой (или полярной группой с постоянным дипольным моментом μ), Есв=40-140 кДж/моль, увеличивается с ростом зарядов и уменьшением их радиуса; диполь-дипольное (ориентационное) – между полярными молекулами, обладающими постоянным дипольным моментом, Есв=2-4 кДж/моль. индукционное – между неполярной молекулой и ионом или молекулой с постоянным ионом, Есв=1-2 кДж/моль; дисперсионное - между неполярными молекулами, движение электронов в молекуле и колебания ядер вызывают появление в молекуле мгновенного диполя, под действием которого в соседней молекуле индуцируется также мгновенный диполь, Есв<2 кДж/моль. Ван дер Ваальсовы силы (ван-дер-ваальсово взаимодействие) – диполь-дипольные, индукционные и дисперсионные взаимодействия. Водородная связь – между атомом водорода и электроотрицательными атомами F, О, N (чаще всего другой молекулы), Есв=10-40 кДж/моль. Гидрофильно-гидрофобное взаимодействие - ион-дипольное или диполь-дипольное взаимодействие, когда один из типов молекул имеет сродство к воде, второй – не имеет. | 
|
4.4. Агрегатное состояние - проявление взаимодействия между частицами вещества. В твердом состоянии расстояния между частицами вещества сопоставимы с размерами самих частиц, что обеспечивает их сильное взаимодействие и ограниченное движение (колебание, вращение). В зависимости от степени упорядоченности частиц твёрдые вещества могут быть кристаллическими (строгая повторяемость элементарной ячейки, ближний и дальний порядок) и аморфными (бесформенными, стеклообразными, переохлаждёнными жидкостями). Многие кристаллы обладают анизотропностью – неодинаковость некоторых свойств вещества по разным направлениям. Аморфные вещества изотропны – т.е. одинаковы по свойствам во всех направлениях.
Жидкое состояние – как в твёрдом состоянии частицы из-за достаточно сильного взаимодействия удерживаются вместе в определённом объеме, но для их взаимного расположения характерен только ближний порядок в небольших постоянно меняющихся ассоциатах или кластерах (время их жизни 10-5 - 10-10 с), свободный объем, доступный для поступательного движения частиц около 3%, поэтому жидкости практически несжимаемы. Жидко-кристаллическое состояние характеризуется текучестью жидкостей и анизотропностью кристалла, возможно для молекул со стержненобазной или дискообразной формой с сильными межмолекулярными взаимодействиями. Парообразное, газообразное и плазменное – сильно разряженные состояния, с доступным для поступательного движения частиц объёмом более 99,8%.
Газ - однородная система, пар – неоднородная, смесь из отдельных молекул и их неустойчивых ассоциатов. Плазма - состояние вещества при сверхвысоких температурах: тысячи градусов Цельсия – холодная плазма; сотни тысяч – горячая плазма.






