ТЕМА 1. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
Значение темы для фармации определяется тем, что многие лекарственные формы (порошки, таблетки, суспензии, эмульсии и др.) являются дисперсными системами с развитой поверхностью. Их удельная поверхность может достигать многих десятков и даже сотен квадратных метров на грамм дисперсной фазы.
Поверхностные явления в таких системах в значительной степени определяют их свойства и поведение при изготовлении и хранении. Они играют существенную роль и при высвобождении фармакологически активных веществ из лекарственных форм, их всасывании и транспорте через биологические мембраны внутри организма.
Кроме того, методы, связанные с измерением поверхностного натяжения, используются для изучения ряда физико-химических свойств различных веществ, в том числе площади, занимаемой молекулой при адсорбции на поверхности, длины молекулы, поверхностной активности и адсорбируемости веществ и др. Сталагмометрический метод может быть использован для определения концентрации поверхностно-активных веществ в растворе.
Изучение основ учения об адсорбции необходимо будущему провизору, так как различные процессы фармакокинетики и фармакодинамики лекарственных веществ обязательно включают в себя стадию адсорбции. Адсорбция используется и в терапевтических целях, например, для извлечения из желудочно-кишечного тракта ядовитых веществ, попавших в организм, а также для очистки лекарственных веществ на различных стадиях их получения. Такой универсальный метод исследования и анализа, как хроматография, имеет в своей основе адсорбцию веществ на различных поверхностях раздела. Ионообменная адсорбция служит для избирательного выделения ионов из сложных смесей, для умягчения и обессоливания воды. На ней также основан принцип действия ионоселективных электродов, в том числе стеклянных электродов, применяемых для потенциометрического определения рН.
Изучив данную тему и выполнив лабораторные работы, относящиеся к ней, студент должен знать:
- строение поверхностного слоя и его отличительные особенности;
- строение молекул поверхностно-активных веществ (ПАВ), влияние ПАВ на поверхностное натяжение растворов;
- основы теории адсорбции на поверхностях раздела «жидкость – газ», «жидкость – жидкость», «твердое тело – газ», «твердое тело - жидкость»;
- уравнения Шишковского, Гиббса, Ленгмюра, Фрейндлиха и их применение;
- расчетные формулы используемых экспериментальных методов;
- значение адсорбции для хроматографии;
- устройство и принцип действия приборов для измерения поверхностного натяжения.
Студент должен уметь:
- проводить измерения с помощью сталагмометра Траубе и прибора Ребиндера;
- рассчитывать поверхностное натяжение, поверхностную активность, величину адсорбции и поверхностного избытка ПАВ, размеры их молекул;
- определять концентрацию растворов ПАВ.
Студент должен приобрести или закрепить навыки:
- приготовления, разбавления и отмеривания растворов;
- расчета концентрации веществ в растворах;
- фильтрования;
- титрования;
- табулирования величин, построения и анализа графиков;
- пользования справочной литературой.
Молекулы поверхностного слоя жидкостей имеют часть неиспользованных сил сцепления, которые представляют собой избыточную энергию. Эта избыточная энергия молекул поверхностного слоя называется свободной поверхностной энергией (G). Она определяется величиной поверхностного натяжения (σ) и суммарной поверхностью раздела фаз (S) и рассчитывается по уравнению:
G = σ.S
- Поверхностное натяжение определяется как энергия переноса молекул из объема фаз на поверхность или как работа образования единицы поверхности раздела:
σ = G/S (Н/м, Дж/м2)
- Поверхностное натяжение воды на границе с воздухом равно σ20ºС = 72,75×10-3 Н/м
- Если в такую двухфазную систему (вода-воздух или вода-жидкость) ввести третье вещество с другим значением поверхностного натяжения, то оно после растворения изменит поверхностное натяжение на границе раздела.
- Вещества, понижающие поверхностное натяжение называются поверхностно-активными (ПАВ). К ним относится большинство органических веществ с меньшим поверхностным натяжением, чем у воды: кислоты, мыла, спирты, фенолы, амины, пектины, полисахариды/ смачиватели и др.
- Вещества повышающие поверхностное натяжение (неорганические электролиты – соли, щелочи) называются поверхностно-инактивными (ПИАВ). Некоторые ПАВ способны к мицеллообразованию – образованию агрегатов дифильных молекул разной формы в зависимости от концентрации. Концентрация, при которой происходит мицеллообразование, называется критической концентрацией мицеллообразования (ККМ).
- Зависимость поверхностного натяжения растворов ПАВ от концентрации выражается изотермой поверхностного натяжения, которая может быть описана с помощью уравнения Шишковского:
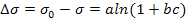 ,
,
где a, b константы.
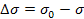
понижение поверхностного натяжения раствора ПАВ с концентрацией С по сравнению с поверхностным натяжением растворителя (σ0).
- Уменьшение поверхностного натяжения может происходить в результате самопроизвольного концентрирования в поверхностном слое веществ – процесса адсорбции (Г, моль/см2, Кмоль/м2).
- Адсорбция на поверхности раздела фаз жидкость-газ или жидкость-жидкость определяется по формуле Гиббса:
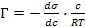 ,
,
где (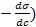 – поверхностная активность, характеризующая способность вещества понижать σ и переходить из объема на поверхность.
– поверхностная активность, характеризующая способность вещества понижать σ и переходить из объема на поверхность.
- Адсорбция на поверхности раздела «твердое тело – газ» (А) возможная как физическая так и хемосорбция. Величину А рассчитывают по разнице концентраций адсорбированного вещества в растворе до и после адсорбции (∆С = С0 - С). Адсорбцию выражают числом молей адсорбированного вещества на единицу массы адсорбента (моль/г, кмоль/кг). Тогда величина экспериментальной адсорбции: 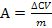 , где V – объем раствора, m – масса адсорбента.
, где V – объем раствора, m – масса адсорбента.
- Величина адсорбции зависит от природы адсорбента, концентрации адсорбента, температуры и др. Поэтому, в расчетах ее величины используют уравнение Ленгмюра:
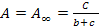 или
или 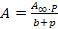 ,
,
где А∞ – предельная мономолекулярная адсорбция; c, p – равновесные концентрация и давление; b – константа адсорбционного равновесия.
и уравнение Фрейндлиха:
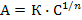 или
или 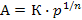 ,
,
где К и 1/n – константы; С, p – равновесные концентрация или давление.
ВОПРОСЫ ТЕОРЕТИЧЕСКОГО МИНИМУМА ДЛЯ САМОПОДГОТОВКИ:
1. Гетерогенность и дисперсность как основные признаки объектов коллоидной химии. Размеры частиц, степень дисперсности, удельная поверхность системы и их взаимосвязь.
2. Поверхностные явления и их значение в фармации. Свободная поверхностная энергия и поверхностное натяжение.
3. Пути уменьшения свободной поверхностной энергии дисперсных систем.
4. Поверхностно-активные вещества (ПАВ) и их классификация.
5. Характеристики ПАВ - гидрофильно-липофильный баланс (ГЛБ) и поверхностная активность. Правило Дюкло - Траубе.
6. Изотерма поверхностного натяжения. Уравнение Шишковского.
7. Мицеллообразование в растворах ПАВ. Критическая концентрация мицеллообразования (ККМ и ККМ). Солюбилизация, её применение в фармации. Липосомы.
8. Адсорбция (общие понятия). Адсорбция ПАВ на поверхностях раздела «жидкость – газ» и «жидкость – жидкость». Уравнение Гиббса.
9. Адсорбция на поверхности раздела «твёрдое тело – газ». Изотерма адсорбции. Экспериментальное определение величины адсорбции.
10. Теория мономолекулярной адсорбции Ленгмюра. Вывод уравнения Ленгмюра. Физический смысл коэффициентов этого уравнения.
11. Расчет коэффициентов уравнения Ленгмюра. Применимость уравнения.
12. Уравнение Фрейндлиха. Расчет его коэффициентов. Применимость уравнения.
13. Адсорбция на поверхности раздела «твёрдое тело – жидкость». Правило уравнивания полярностей Ребиндера.
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
Задача 1. Найти поверхностное натяжение анилина, если сталагмометрическим методом при 20ºС получены следующие данные: число капель анилина – 42, число капель воды – 18. Плотность анилина 1400 кг / м3.
РЕШЕНИЕ. Используем для расчета формулу
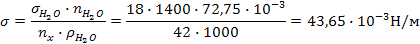
(Поверхностное натяжение воды и её плотность, соответственно равные 72,75 × 10-3 Н/м и 1000 кг/м, берутся из справочника).
Задача 2. Определить поверхностный избыток Г¥ (кмоль/м2) при 10ºС для водного раствора, содержащего в 1 литре 50 мг пеларгоновой кислоты С8Н17СООН. Поверхностные натяжения исследуемого раствора и воды соответственно равны 57,00×10-3 и 74,22×10-3 Н/м.
РЕШЕНИЕ. Используем уравнение Гиббса:
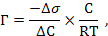
где С – молярная концентрация пеларгоновой кислоты (С = g / М = 0,05 / 158 = 0,000316 моль/л; 158 – молярная масса),
Ds – изменение поверхностного натяжения раствора по сравнению с водой [Ds = (57,00 - 74,22) × 10-3 = -17,22 × 10-3 Н/м],
DС – разность концентраций (в данном случае С = 0,000316 - 0),
R – универсальная газовая постоянная, Т – температура в К.
Подставляем данные:
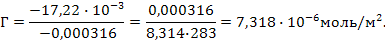
Задача 3. Рассчитать длину l молекулы масляной кислоты на поверхности раздела «водный раствор – воздух», если площадь S, занимаемая одной её молекулой в поверхностном слое, равна 30 × 10-20 м2. Плотность масляной кислоты – 978 кг/м3.
РЕШЕНИЕ. Длину молекулы можно рассчитать по формуле
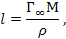
где М - молярная масса кислоты, Г – предельный поверхностный избыток её в адсорбционном слое, r – плотность.
Учитывая, что
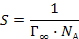
находим значение
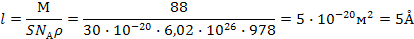
Задача 4. При изучении адсорбции этанола на активированном угле при 18оС были получены данные:
р × 10-2, Па 5,33 9,87 17,33 23,06 45,53
x/m 103, м3 / кг 14,9 19,1 24,2 27,3 36,8
Определить графическим способом константы уравнений Фрейндлиха и Ленгмюра и рассчитать с их помощью величину адсорбции при р = 3000 Па, а также количество этанола, адсорбирующегося на 5 кг угля.
РЕШЕНИЕ. Для нахождения констант уравнения Фрейндлиха x/m = kр1/n строится график зависимости lg x/m = f(lg р). Находим необходимые величины:
lg x/m -1,183 -1,720 -1,62 -1,51 -1,43
lg р 2,60 2,87 3,114 3,24 3,53
|
и строим по ним график. Он отсекает от оси ординат отрезок 0К, равный lg k = = -3,65. Отсюда k = 10-3,65 = 2,34×10-4. По тангенсу угла наклона находим второй коэффициент:
1/n = tg a МL / KL = 0,67м3.
Отсюда:
А = x/m = kр1/n = 2,34×10-4×30000,67 = 33,49×10-3 м3/кг, и значит, на 5 кг угля адсорбируется 5×33,49×10-3 = 0,167 м3 этанола.
Для нахождения констант уравнения Ленгмюра строится график зависимости 1 / А = f (1 / р).
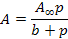
Находим необходимые величины:
1 / р 0,00188 0,001013 0,000577 0,000434 0,000220
1 / А 67,1 52,36 41,32 36,63 27,17
|
|
| K |
| D |
| B |
| 1 / p |
| 0 |
| 1 /А |
0D = 1 / A¥ = 26; 0B = 2 / A = 52;
0K = 1 / b = 0,0010.
Отсюда:
А¥ = 1 / 26 = 0,0385 и
b = 1 / 0,0010 = 990.
Значит,
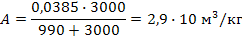
и на 5 кг угля адсорбируется 5×2,9×10-3 = 0,145 м3 этанола.
Задача 5. Используя константы уравнения Шишковского (a = 12,6×10-3 и b = 21,5), рассчитайте поверхностное натяжение водного раствора масляной кислоты с концентрацией 0,104 моль/л при 273K. Поверхностное натяжение воды при этой температуре σ0 = 75,62×10-3 Н/м.
РЕШЕНИЕ. С помощью уравнения Шишковского:
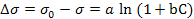
рассчитаем поверхностное натяжение раствора σ:
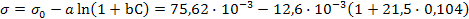
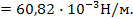
РАБОТА 1.1
СТАЛАГМОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ВОДНЫХ РАСТВОРОВ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ (ПАВ) И РАСЧЕТ РАЗМЕРОВ ИХ МОЛЕКУЛ
Цель работы: Изучение зависимости поверхностного натяжения растворов ПАВ от концентрации; расчет размеров молекул ПАВ.
Целевые задачи: Овладение сталагмометрическим методом; графическая интерпретация экспериментальных данных; выяснение прикладных возможностей метода.
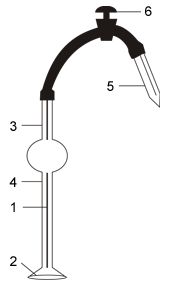
УСТРОЙСТВО И ПРИНЦИП ДЕЙСТВИЯ СТАЛАГМОМЕТРА ТРАУБЕ
|
Рис. 1.1 |
При медленном вытекании жидкости из капилляра 1 (рис. 1.1) на его нижнем конце образуется капля. Для увеличения размера капли служит шероховатое расширение 2 стенок капилляра. На растущую каплю действует сила тяжести, стремящаяся оторвать её от конца капилляра, и сила поверхностного натяжения, стремящаяся сжать каплю и вернуть её в капилляр. В тот момент, когда эти две силы станут равными друг другу, происходит отрыв капли.
Таким образом, чем больше поверхностное натяжение жидкости, тем крупнее при прочих равных условиях будет капля в момент отрыва и тем меньше капель будет содержаться в объёме, заключенном между метками 3 и 4.
Измерения с помощью сталагмометра сводятся к следующему:
1. Исследуемая жидкость набирается в сталагмометр резиновой грушей, надеваемой на стеклянный патрубок 5, так, чтобы её уровень был выше метки 3.
2. Резиновая груша убирается и жидкости предоставляется возможность самопроизвольно вытекать из сталагмометра в подставленный сосуд.
ВНИМАНИЕ! Жидкость должна не литься струей, а капать со скоростью, позволяющей считать капли. Для регулировки скорости вытекания служит зажим.
3. Подсчитывается число капель, оторвавшихся от сталагмометра за время прохождения уровня жидкости от метки 3 до метки 4. Для получения статистически достоверного результата следует провести измерения для каждой исследуемой жидкости несколько раз и взять среднее арифметическое.
4. Расчет поверхностного натяжения производится с помощью уравнения:
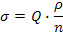
где ρ – плотность жидкости, n – число капель, Q – константа сталагмометра (она может быть рассчитана при подсчете числа капель эталонной жидкости, например, воды).
При исследовании разбавленных водных растворов, плотность которых мало отличается от плотности воды при данной температуре, расчет поверхностного натяжения можно производить по уравнению:
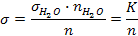
где σH2O – справочное значение поверхностного натяжения воды при температуре опыта, nН2О и n – соответственно число капель воды и исследуемого раствора, К = sН2О × nН2О – константа, рассчитываемая непосредственно в ходе опыта.
ОСНАЩЕНИЕ РАБОЧЕГО МЕСТА
Сталагмометр Траубе Термометр
Склянки для приготовления растворов Карандаш по стеклу
Пипетка или мерная пробирка Дистиллированная вода
Растворы ПАВ
ПРОВЕДЕНИЕ ОПЫТА
1. Проверить оснащение рабочего места.
2. Приготовить серию растворов ПАВ, указанного преподавателем, методом разбавления вдвое. Для этого в склянку с наибольшим номером (например, 6) поместить 10 мл исходного раствора, а в остальные склянки - по 10 мл дистиллированной воды. Затем в склянку с ближайшим меньшим номером (в данном случае 5) добавить 10 мл исходного раствора и тщательно перемешать. Отобрать из этой склянки 10 мл получившегося разбавленного вдвое раствора и перенести в склянку со следующим меньшим номером и т.д. Из склянки с номером 1, где получится раствор с наименьшей концентрацией, при необходимости можно отбросить избыточные 10 мл.
ПРИМЕЧАНИЕ. Объёмы растворов и количество разведений указываются преподавателем.
3. Измерить и записать температуру, при которой проводится опыт.
4. Тщательно промыть сталагмометр, заполнить его дистиллированной водой и отрегулировать скорость её истечения.
5. В соответствии с описанием прибора измерить число капель воды (не менее 3 раз).
6. Измерить число капель каждого из приготовленных растворов ПАВ (также не менее 3 раз), начиная с раствора с наименьшей концентрацией.
7. Показать экспериментальные данные преподавателю. Если они верны, среднее арифметическое из числа капель воды и каждого раствора занести в таблицу экспериментальных данных.
| Исследуемое ПАВ: | Температура ___ºС | ||||||||
| №№ | С, % | С, кмоль/м3 | ΔС, кмоль/м3 | n | σ×103, Н/м | Δσ×103, Н/м | G×109, кмоль/м2 | 1/С | 1/G×10__9 |
| Н2О | - | - | - | - | - | - | - | ||
| 1 | |||||||||
| 2 | |||||||||
| … | |||||||||
8. Привести в порядок рабочее место и сдать его дежурному.
9. Заполнить все графы таблицы.
sН2О при температуре опыта берется из справочника;
s растворов рассчитывается, как показано в описании метода;
поверхностный избыток Г рассчитывается по уравнению Гиббса:
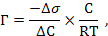
где Ds – изменение поверхностного натяжения раствора по сравнению с водой (Ds = s - sН2О),
DС – изменение концентрации раствора ПАВ по сравнению с ближайшим в сторону уменьшения раствором данного ряда. (Если растворы готовились методом разбавления вдвое, то DС = С / 2),
Рис. 1.2 |
Т– температура, выраженная в К,
R– универсальная газовая постоянная.
10. Построить по экспериментальным данным изотерму поверхностного натяжения (рис. 1.2). Из точки А, соответствующей s Н2О, провести касательную АВ к изотерме, как показано на рисунке. Рассчитать поверхностную активность исследуемого ПАВ как тангенс угла наклона прямой АВ к оси абсцисс:
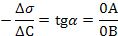
(Длины отрезков ОА и ОВ берутся в масштабных единицах).
11. Построить график зависимости 1 / Г = f (1 / C) (рис. 1.3) и экстраполировать его до пересечения с осью ординат. Отрезок, отсекаемый от неё при этом, равен обратной величине предельного поверхностного избытка 1 / Г¥.
|
1 / Г
1 / Г¥
0 1 / С Рис. 1.3 |
12. Рассчитать предельный поверхностный избыток ПАВ Г¥.
13. Рассчитать площадь S, приходящуюся на одну молекулу ПАВ в адсорбционном слое, толщину адсорбционного слоя, принимаемую равной длине молекулы 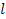 , и объём V, занимаемый молекулой ПАВ в адсорбционном слое:
, и объём V, занимаемый молекулой ПАВ в адсорбционном слое:
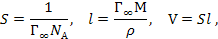
где NА – число Авогадро, М – молярная масса исследуемого ПАВ, r – его плотность.
14.Результаты вычислений занести в итоговую таблицу.
| Исследуемое ПАВ | –Δσ / ΔС, Н×м2 / кмоль | G∞, кмоль / м2 | l, | S, | V, | |||
| м | А | м2 | А2 | м3 | А3 | |||
15. Сформулировать выводы.
РАБОТА 1.2
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ЭТИЛОВОГО СПИРТА СТАЛАГМОМЕТРИЧЕСКИМ МЕТОДОМ
Цель работы: Определение концентрации ПАВ (на примере этилового спирта) в водном растворе.
Целевые задачи: Овладение сталагмометрическим методом; графическая интерпретация экспериментальных данных; выяснение прикладных возможностей метода.
Принцип сталагмометрического метода – см. работу 1.1.
ОСНАЩЕНИЕ РАБОЧЕГО МЕСТА
Сталагмометр Траубе Термометр
Склянки для приготовления растворов Карандаш по стеклу
Пипетка или мерная пробирка Дистиллированная вода
Растворы ПАВ
ПРОВЕДЕНИЕ ОПЫТА
1. Проверить оснащение рабочего места.
2. Приготовить серию растворов этилового спирта методом разбавления вдвое (см. п. 2 работы 1.1)
3. Измерить и записать температуру, при которой проводится опыт.
4. Тщательно промыть сталагмометр, заполнить его дистиллированной водой и отрегулировать скорость её истечения.
5. В соответствии с описанием прибора измерить число капель воды (не менее 3 раз).
6. Измерить число капель каждого из приготовленных растворов (также не менее 3 раз), начиная с раствора с наименьшей концентрацией.
7. Получить у преподавателя контрольный раствор спирта с неизвестной концентрацией и измерить число капель для него (также не менее 3 раз).
8. Показать экспериментальные данные преподавателю. Если они верны, среднее арифметическое из числа капель воды и каждого раствора занести в таблицу экспериментальных данных.
| Температура опыта ___ºС | |||
| №№ | С, % | lg C | σ×103, Н/м |
| Н2О | - | - | |
| 1 | |||
| 2 | |||
| … | |||
| Контроль | |||
|
Рис. 1.4 |
9.
| lg C |
| σ |
10. Заполнить все графы таблицы.
11. Построить график зависимости s = f (lg C) (см. рис. 1.4).
12. Методом интерполяции определить концентрацию спирта в контрольном растворе:
С = 10Х
13. Проверить результат у преподавателя.
14. Сформулировать выводы.
РАБОТА 1.3
ОПРЕДЕЛЕНИЕ КРИТИЧЕСКОЙ КОНЦЕНТРАЦИИ МИЦЕЛЛООБРАЗОВАНИЯ (ККМ) ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ С ИСПОЛЬЗОВАНИЕМ МЕТОДА НАИБОЛЬШЕГО ДАВЛЕНИЯ ПУЗЫРЬКОВ ВОЗДУХА (ПО РЕБИНДЕРУ)
Цель работы: Изучение зависимости поверхностного натяжения мицеллообразующих ПАВ (МПАВ) от их концентрации; определение на её основе ККМ.
Целевые задачи: Овладение методом наибольшего давления пузырьков воздуха; графическая интерпретация экспериментальных данных; оценка интервалов концентраций, в которых МПАВ существуют в виде истинных и мицеллярных растворов.
УСТРОЙСТВО И ПРИНЦИП ДЕЙСТВИЯ ПРИБОРА РЕБИНДЕРА
При медленном вытекании воды из аспиратора 1 (рис. 1.5) в системе трубок 2 и в измерительном сосуде 3 над исследуемой жидкостью 4 создается понижение давления воздуха (разрежение). При этом
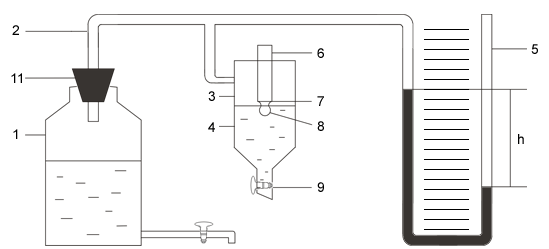
Рис.1.5
уровень манометрической жидкости в колене манометра 5, соединенном с системой трубок, поднимается, а в другом колене опускается. Под влиянием разрежения воздух из атмосферы стремится проникнуть внутрь прибора через стеклянную трубку 6. Её оттянутый кончик (капилляр 7) погружен в исследуемую жидкость и поэтому при постепенном уменьшении давления в приборе на выходе из капилляра формируется пузырек воздуха 8.
На этот пузырек действуют две силы - разность давлений воздуха внутри и вне прибора, увеличивающая его, и сила поверхностного натяжения, стремящаяся уменьшить пузырек и вернуть его в капилляр. В тот момент, когда эти две силы сравниваются друг с другом, пузырек отрывается от капилляра и проскакивает внутрь прибора, увеличивая тем самым давление внутри системы трубок. Это фиксируется с помощью манометра, уровни жидкости в котором при этом возвращаются в исходное положение.
Чем больше поверхностное натяжение исследуемой жидкости, тем большее разрежение требуется создать для проскакивания пузырька и тем больше будет разность уровней манометрической жидкости h.
ВНИМАНИЕ! Для достижения максимальной точности измерений необходимо, чтобы глубина погружения капилляра в жидкость была не более 1 мм, а скорость вытекания воды из аспиратора была подобрана так, чтобы частота проскакивания пузырьков не превышала 2 - 3 в минуту.
Измерения с помощью прибора Ребиндера сводятся к следующему:
1. Исследуемая жидкость заливается в сосуд 3, который плотно закрывается пробкой с вставленной трубкой 6. Зажимом или краном 9 устанавливается требуемый уровень жидкости.
2. В аспиратор 1 заливается водопроводная вода. Зажимом или краном 10 подбирается требуемая скорость вытекания воды.
3. Измеряется максимальная разница уровней манометрической жидкости («перепад давлений») h, наблюдаемое перед самым моментом проскакивания пузырька.
ВНИМАНИЕ! Для нормальной работы прибора необходимо соблюдение таких условий:
- пространство внутри прибора должно быть герметичным.
- внутри трубок не должно быть капель, перекрывающих просвет. Попавшую в трубки воду (или исследуемую жидкость) можно удалить осторожным встряхиванием их при открытой пробке 11, но ни в коем случае не выдуванием.
4. Расчёт поверхностного натяжения s производится по уравнению:
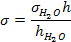
где sН2О – справочное значение поверхностного натяжения воды при температуре опыта;
h и hН2О – перепад давлений соответственно для исследуемой жидкости и воды.
ОСНАЩЕНИЕ РАБОЧЕГО МЕСТА
Прибор Ребиндера Термометр
Склянки на 50 мл Карандаш по стеклу
Бюретка Растворы МПАВ
Пипетка или мерная пробирка Дистиллированная вода
ПРОВЕДЕНИЕ ОПЫТА
1. Проверить оснащение рабочего места.
2. Измерить и записать температуру, при которой проводится опыт.
3. Приготовить по указанию преподавателя серию растворов МПАВ.
4. Подготовить к работе прибор Ребиндера:
- тщательно (не менее 3 раз) промыть дистиллированной водой измерительный сосуд и капилляр;
- заполнить аспиратор водопроводной водой;
- залить в измерительный сосуд дистиллированную воду;
- собрать прибор, убедиться в его герметичности и в отсутствии воды в системе трубок;
- установить необходимый уровень погружения капилляра;
- осторожно ослабляя зажим аспиратора, добиться требуемой скорости проскакивания пузырьков воздуха из капилляра в измерительный сосуд.
5. В соответствии с описанием метода измерить не менее 3 раз разность уровней манометрической жидкости (перепад давлений) для воды.
6. Измерить (также не менее 3 раз в каждом случае) перепад давлений для всех приготовленных растворов МПАВ, начиная с раствора с наименьшей концентрацией.
Рис. 1.6 |
7. Показать полученные данные преподавателю. Если они верны, среднее арифметическое для каждой жидкости занести в таблицу экспериментальных данных.
| Исследуемое МПАВ | Температура ___ºС | |||
| №№ | С, моль/л | lg C | h, мм | σ×103, Н/м |
| Н2О | - | - | ||
| 1 | ||||
| 2 | ||||
| … | ||||
| lg ККМ = | ККМ = __________ моль/л | |||
8. Привести в порядок рабочее место и сдать его дежурному.
9. Заполнить все колонки таблицы.
10. Построить график зависимости s = f (lg C) (см. рис. 1.6). По его излому в точке К определить lg ККМ, которому соответствует точка Х на оси абсцисс, и затем рассчитать критическую концентрацию мицеллообразования:
ККМ = 10Х
Результаты расчетов занести в таблицу.
11. Сформулировать выводы.
РАБОТА 1.4
ИЗУЧЕНИЕ АДСОРБЦИИ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ
НА ТВЁРДЫХ АДСОРБЕНТАХ
Цель работы: Экспериментальное определение величины адсорбции ПАВ на твёрдом адсорбенте титриметрическим методом.
Целевые задачи: Расчёт коэффициентов уравнений Фрейндлиха и Ленгмюра; расчёт теоретического значения адсорбции при различных равновесных концентрациях; расчёт отклонения этих значений от экспериментальных; выяснение применимости каждого из уравнений к описанию адсорбции в данных условиях.
ОСНАЩЕНИЕ РАБОЧЕГО МЕСТА
Склянки с пробками или крышками Бумажные фильтры
Колбы для титрования Растворы органических кислот
Бюретка на 25 мл Раствор NaOH 0,1М
Пипетка на 1 мл Твёрдые адсорбенты (Al2O3,
Воронки активированный уголь и др.)
Узкогорлые склянки Спиртовый раствор
Термометр фенолфталеина
ПРОВЕДЕНИЕ ОПЫТА
1. Проверить оснащение рабочего места.
2. Отмерить в склянки с пробками (крышками) по 10 мл указанных преподавателем растворов ПАВ - органических кислот.
3. Поместить в каждую из этих склянок по 0,5 г растертого в порошок твердого адсорбента. Закрыть склянки, перемешать их содержимое и оставить на 15 мин., время от времени перемешивая встряхиванием.
4. Измерить и записать температуру, при которой проводится опыт.
5. Титрованием определить исходные концентрации С ПАВ в растворах. Объём проб для титрования – 1 мл, титрант – 0,1М раствор NaOH, индикатор – фенолфталеин. Каждый раствор титруется не менее 3 раз. Концентрация кислоты в растворе рассчитывается по закону эквивалентов:
С1 V1 = С2 V2
6. Показать результаты преподавателю. Если они верны, среднее арифметическое для каждого раствора занести в таблицу экспериментальных данных.
| ПАВ | Адсорбент | Температура ___ºС | ||||||
| №№ | С0, моль/л | С, моль/л | ΔС, моль/л | Аэксп, моль/кг | lg C | lg Аэксп | 1 / C | 1 / Аэксп |
| 1 | ||||||||
| 2 | ||||||||
| … | ||||||||
7. Отфильтровать растворы, находившиеся в контакте с адсорбентом.
ВНИМАНИЕ! Воронки и склянки для фильтрования должны быть сухими. Если они перед началом опыта ополаскивались водой, для сведения ошибки определения к минимуму следует удалить воду из склянок стеканием или встряхиванием. Растворы должны быть отфильтрованы полностью.
8. Титрованием определить концентрацию ПАВ в растворах, подвергавшихся адсорбции (равновесную концентрацию С). Титрование проводится аналогично п. 5.
9. Показать результаты преподавателю. Если они верны, среднее арифметическое для каждого раствора занести в таблицу экспериментальных данных.
10. Привести в порядок рабочее место и сдать его дежурному.
11. Заполнить все графы таблицы.
Для расчета экспериментальной величины адсорбции Аэксп используется уравнение:
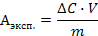
где DС = С0 - С – изменение концентрации ПАВ в растворе в результате адсорбции, V – объём раствора, находившийся в контакте с адсорбентом, m – масса адсорбента (выраженная в кг).
12. Рассчитать константы уравнения Фрейндлиха Аф = k C 1/n, где Аф - теоретическое значение величины адсорбции, рассчитываемое для равновесной концентрации С с помощью констант k и 1/n.
Для нахождения констант уравнение преобразуется с помощью логарифмирования в уравнение прямой, не проходящей через начало координат:
lg Aф = lg k + 1 / n lg C.
|
Рис. 1.7 |
| E |
| M |
| lg С |
| 0 |
| lgAэ |
| K |
| L |
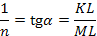
(отрезки KL и ML измеряются в масштабных единицах).
Построить график зависимости lgАэксп = f(lgC) и экстраполировать его до пересечения с осью ординат. Определив константы, рассчитать величину адсорбции по уравнению Фрейндлиха и занести данные в таблицу.
13. Рассчитать с помощью уравнения Фрейндлиха для каждой равновесной концентрации теоретические значения величины адсорбции Аф и занести их в таблицу расчетных данных.
Рассчитать отношения Аэксп / Аф для каждой равновесной концентрации С и их среднее арифметическое.
14. Рассчитать константы уравнения Ленгмюра
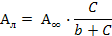
где Ал – теоретическое значение величины адсорбции, рассчитываемое для равновесной концентрации С с помощью констант b и А¥.
Для расчета констант уравнение Ленгмюра преобразуется в уравнение прямой, не проходящей через начало координат:
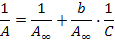
Рис. 1.8 |
При этом отрезок OF, отсекаемый графиком от оси ординат, равен 1 / А¥. Поскольку коэффициент b численно равен концентрации, при которой адсорбция составляет половину предельной, его можно определить с помощью дополнительного построения. На оси ординат откладывается отрезок 0D, равный удвоенному отрезку 0F и соответствующий 2/А¥. Методом интерполяции находится отрезок 0Е, равный 1 / b.
Построить график зависимости
1 / А = f (1 / С) и экстраполировать его до пересечения с осью ординат. Определив константы, рассчитать величину адсорбции по уравнению Ленгмюра и занести данные в таблицу.
15. С помощью уравнения Ленгмюра рассчитать для каждой равновесной концентрации теоретические значения величины адсорбции Ал.
16. Рассчитать отношения Аэксп / Ал для каждой равновесной концентрации и их среднее арифметическое.
|
| Уравнение Фрейндлиха | Уравнение Ленгмюра | ||||
| №№ | С, моль/л | Аэксп, моль/кг | Аф, моль/кг | Аэксп / Аф | Ал, моль/кг | Аэксп / Ал |
| 1 | ||||||
| 2 | ||||||
| 3 | ||||||
| 4 | ||||||
| Аэксп / Аф средн. | Аэксп / Ал средн. | |||||
18. Сверить данные у преподавателя.
19. Сформулировать выводы.
ТЕМА 2. ПОЛУЧЕНИЕ, УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ. СТРОЕНИЕ МИЦЕЛЛЫ ЛИОФОБНЫХ ЗОЛЕЙ
Значение темы для фармации определяется тем, что многие лекарственные формы являются коллоидными растворами (золями). Такие биологические объекты, как кровь, цитоплазма с органеллами клеток и т.п., представляют собой дисперсные системы, по своим свойствам близкие к коллоидным. В связи с этим знание основных условий получения и стабилизации коллоидных систем необходимо для технологии лекарств, а также для изучения биохимических процессов, протекающих с участием дисперсных систем организма.
.Вместе с тем нежелательные коллоидные растворы могут возникать самопроизвольно в случаях неправильной дозировки реактивов при изготовлении жидких лекарственных форм. Для предотвращения этого также необходимо иметь представление об условиях образования золей.
Коагуляция - разрушение коллоидных систем в результате слипания их частиц при потере агрегативной устойчивости. Чаще всего встречается и поэтому имеет наибольшее практическое значение коагуляция под действием электролитов. Коагуляция может быть желательной (например, при очистке воды от тонкодисперсных примесей) или нежелательной (например, в случае нарушения устойчивости коллоидных лекарственных форм, агглютинации эритроцитов при неверной дозировке инъекционных растворов и т.п.).
В ряде случаев, например, при отмывании осадков на фильтре, возможен обратный коагуляции процесс - пептизация.
Знание закономерностей коагуляции и пептизации необходимо для квалифицированного приготовления жидких лекарственных форм - дисперсных систем, а также для проведения анализа лекарств гравиметрическим методом.
Изучив данную тему и выполнив лабораторные работы, относящиеся к ней, студент должен знать:
- главные условия, необходимые для получения коллоидных растворов;
- особенности адсорбции электролитов на твердых поверхностях
- правило Панета - Фаянса;
- механизм возникновения двойного электрического слоя (ДЭС) на твёрдых поверхностях, в том числе на коллоидных частицах;
- строение ДЭС;
- строение мицеллы лиофобных золей;
- основные закономерности электролитной коагуляции;
- правило Шульце - Гарди;
- общие принципы стабилизации дисперсных систем вообще и коллоидных растворов в частности.
Студент должен уметь:
- получать коллоидные растворы методами пептизации, замены растворителя, различными типами химических реакций;
- находить признаки образования коллоидных растворов (например, опалесценцию), а также их коагуляции;
- экспериментально определять порог коагуляции и коагулирующую способность электролитов;
- применять правила Панета - Фаянса и Шульце - Гарди к исследуемым золям;
- составлять формулы мицелл золей.
Студент должен получить или закрепить навыки:
- отмеривания растворов с использованием различной мерной посуды (бюретки, пипетки, мерные пробирки, капельницы и др.);
- декантации, фильтрования;
- табулирования данных;
- расчетов с использованием микрокалькуляторов.
Дисперсные системы – это гетерогенные системы, состоящие из двух и более фаз. Одна фаза непрерывная – дисперсионная среда (ДС), другая прерывистая – дисперсная фаза (ДФ).
- Получить их можно диспергированием (дроблением) грубодисперсной системы или конденсированием (укрупнением) более мелких частиц. При этом необходимо соблюдать условия получения:
- нерастворимость ДФ в ДС;
- малая концентрация частиц ДФ;
- наличие стабилизатора.
- Для очистки от примесей коллоидного раствора применяют: диализ, электродиализ, ультрафильтрацию. Во всех методах используются полупроницаемые мембраны, пропускающие только частицы примесей.
- Частицы дисперсной системы имеют сложное строение. Твердая основа частицы вместе с двойным электрическим слоем из ионов адсорбированного на ее поверхности электролита образует мицеллу.
- Записать взаимное расположение составляющих мицеллы можно формулой мицеллы.
- Неизменность во времени степени дисперсности и равномерного распределения частиц дисперсной фазы в среде называют устойчивостью.
- Нарушение устойчивости связано с коагуляцией. Внешне она проявляется в виде помутнения, изменения цвета, выпадения осадка.
- Различают скрытую (не видимую невооруженным глазом) и явную коагуляцию коллоидного раствора, (хорошо заметные изменения). Одной из причин коагуляции может быть введение электролитов. Наименьшая концентрация электролита, вызывающая явную коагуляцию коллоидного раствора, называется порогом коагуляции 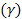 .
.
- Экспериментально он может быть вычислен по формуле:
- 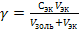 , где
, где
- Сэк, Vэк – концентрация и объем электролита;
- Vзоль – объем коллоидного раствора.
- Влияние электролитов на коагуляцию описывается правилом Шульце-Гарди: «коагулирующим действием обладают те ионы электролита-коагулятора (эк), знак заряда которых противоположен заряду гранулы мицеллы, а коагулирующее действие возрастает с увеличением заряда иона-коагулятора».
- Защитить коллоидный раствор от коагуляции можно при введении в золь высокомолекулярных веществ (ВМВ), образующих на поверхности частиц адсорбционный слой из молекул ВМВ, придающий сорбционно-сольватный фактор устойчивости. Такое явление получило название коллоидной защиты.
ВОПРОСЫ ТЕОРЕТИЧЕСКОГО МИНИМУМА ДЛЯ САМОПОДГОТОВКИ:
1. Гетерогенность и дисперсность как основные признаки объектов коллоидной химии. Размеры частиц, степень дисперсности, удельная поверхность системы и их взаимосвязь.
2. Образование двойного электрического слоя (ДЭС) на межфазных поверхностях. Теории строения ДЭС (Гельмгольца-Перрена, Гуи-Чепмена, Штерна-Фрумкина). Электротермодинамический (j-) и электрокинетический (z-) потенциалы.
3. Влияние введения электролитов и разбавления на j- и z- потенциалы. Изоэлектрическое состояние ДЭС.
4. Строение мицеллы лиофобных золей. Формула мицеллы.
5. Дисперсные системы и их классификация. Общие принципы получения коллоидных растворов.
6. Конденсационные методы получения коллоидных растворов (метод химической реакции, метод замены растворителя).
7. Диспергационные методы получения. Коллоидная мельница. Шаровая мельница.
8. Комбинированные методы получения (пептизация, электрические методы).
9. Методы очистки коллоидных растворов (диализ, электродиализ, ультрафильтрация, ультрацентрифугирование).
10. Устойчивость дисперсных систем (агрегативная и седиментационная). Факторы устойчивости. Коагуляция.
11. Электролитная коагуляция. Теории коагуляции (ДЛФО, адсорбционная и др.).
12. Виды коагуляции (скрытая, явная, медленная, быстрая) и их связь с величиной z-потенциала.
13. Порог коагуляции и его экспериментальное определение. Коагулирующая способность электролитов. Правило Шульце - Гарди. Лиотропные ряды коагуляции.
14. Особые явления, наблюдаемые при электролитной коагуляции: аддитивность, антагонизм и синергизм ионов при действии смеси электролитов, перезарядка золей («неправильные ряды коагуляции»), «привыкание» золей, взаимная коагуляция коллоидов.
15. Защитное действие высокомолекулярных веществ. «Золотое число».
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
Задача 1. Для получения золя хлорида серебра смешали 15 мл 0,025М раствора КСl с 85 мл 0,005М раствора AgNO3. Написать формулу мицеллы образовавшегося золя.
РЕШЕНИЕ. Сначала надо определить, какой из электролитов взят в избытке.
Количество KCl: 15×0,025 = 0,375 ммоль; количество AgNO3: 85 × 0,005 = 0,425 ммоль. Таким образом, в смеси имеется избыток AgNO3, который и будет служить стабилизатором коллоидного раствора. Твёрдой основой (агрегатом) частиц золя AgCl будут преимущественно адсорбироваться ионы Ag+ (потенциалопределяющие ионы). Ионы NO3- при этом станут противоионами. Формула мицеллы полученного золя будет выглядеть так:
{ [m AgCl] nAg+ (n - x)NO3 - } х + xNO3 -
Задача 2. В три колбы налито по 100 мл золя Fe(OH)3. Чтобы вызвать явную коагуляцию золя, потребовалось добавить в первую колбу 10,5 мл 1М KCl, во вторую – 62,5 мл 0,01 н. Na2SO4, в третью – 37,0 мл 0,01 н. Na3PO4. Рассчитать пороги коагуляции и коагулирующую способность каждого электролита. Определить знак заряда частиц золя.
РЕШЕНИЕ. Порог коагуляции рассчитывается по уравнению
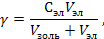
где Сэл – концентрация электролита-коагулятора, Vэл и Vзоль – объемы растворов электролита-коагулятора и коллоидного раствора соответственно.
Подставляем данные:
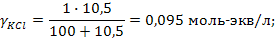
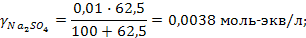
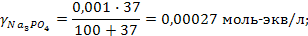
Коагулирующая способность электролита Р – это величина, обратная порогу коагуляции:
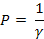
Отсюда:
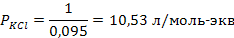
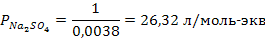
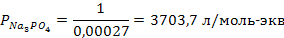
Поскольку все электролиты-коагуляторы содержат катионы с одинаковым зарядом, а их пороги резко отличаются друг от друга, можно заключить, что в данном случае коагулирующим действием обладают анионы. В соответствии с правилом Шульце-Гарди частицы золя должны быть заряжены положительно.
РАБОТА 2.1
ПОЛУЧЕНИЕ ЛИОФОБНЫХ КОЛЛОИДНЫХ РАСТВОРОВ
Цель работы: Изучение различных методов получения лиофобных коллоидных растворов (золей).
Целевые задачи: Ознакомление с главными условиями получения золей; овладение методами пептизации, замены растворителя, химической реакции; нахождение главных признаков образования коллоидных растворов; закрепление навыков работы с растворами.
ОСНАЩЕНИЕ РАБОЧЕГО МЕСТА
Штатив с пробирками Электроплитка с закрытой спиралью
Пипетки на 1, 5 и 10 мл Растворы реактивов и бюретки для
Стакан или коническая колба их отмеривания
на 200 мл Диэтиловый эфир
Кристаллизатор Дистиллированная вода
Воронка Бумажные фильтры
Мерный цилиндр на 50 мл
ВНИМАНИЕ! Коллоидные растворы очень чувствительны даже к незначительным количествам примесей. Поэтому необходимо тщательно следить за чистотой используемой в опытах посуды. Недопустимо пипеткой, соприкасавшейся с каким-либо раствором, отбирать другие растворы, так как при этом они приходят в негодность, а внутри пипетки может образоваться трудноудаляемый осадок. Реактивы, используемые на данном занятии, при взаимодействии друг с другом образуют труднорастворимые яркоокрашенные осадки. Поэтому следует соблюдать аккуратность в работе во избежание загрязнения одежды, лабораторного оборудования и др.
ПРОВЕДЕНИЕ ОПЫТОВ
I. МЕТОД ПЕПТИЗАЦИИ
Пептизацией называется переход осадков в коллоидный раствор. Пептизация может происходить в результате промывания осадка (с удалением избытка электролита-коагулятора) или под действием специально вводимых веществ - пептизаторов. Пептизаторами могут быть поверхностно-активные вещества или низкомолекулярные электролиты. Пептизатор адсорбируется частицами осадка, что ведет к образованию двойного электрического слоя, а также сольватной оболочки на их поверхности - главных факторов агрегативной устойчивости. Пептизации подвергаются, как правило, свежеприготовленные и рыхлые осадки; при этом обычно не наблюдается стехиометрических соотношений между количествами пептизатора и осадка, перешедшего в раствор.
ЗОЛЬ ГИДРОКСИДА ЖЕЛЕЗА (III)
1. В стакан или коническую колбу отмерить 25 мл дистиллированной воды и 0,5 мл 10%-ного раствора FeCl3.
2. К полученному раствору добавлять по каплям 5%-ный раствор аммиака до тех пор, пока количество образующегося осадка не перестанет увеличиваться. При этом происходит реакция:
FeCl3 + 3 NH3  H2O = Fe(OH)3 + 3NH4Cl.
H2O = Fe(OH)3 + 3NH4Cl.
3. Дать осадку осесть и декантировать его, т. е. осторожно слить раствор над осадком в кристаллизатор, следя за тем, чтобы осадок оставался в стакане (колбе).
4. Добавить к осадку приблизительно 30 мл дистиллированной воды, взболтать, дать отстояться и снова декантировать. Повторить декантацию ещё два раза.
5. К отмытому осадку добавить 25 мл дистиллированной воды, взболтать и не давая гидроксиду железа осесть, перенести пипеткой по 2 мл образовавшейся суспензии в 5 чистых пробирок.
6. Добавить в каждую пробирку указанные в таблице объёмы дистиллированной воды и пептизатора (10%-ного раствора FeCl3).
| № № пробирок | 1 | 2 | 3 | 4 | 5 |
| Объём суспензии Fe(OH)3, мл | 2 | 2 | 2 | 2 | 2 |
| Объём воды, мл | 5 | 4,8 | 4,6 | 4.4 | 4,2 |
| Объём 10%-ного FeCl3, мл | - | 0,2 | 0,4 | 0,6 | 0,8 |
| Степень пептизации |
Энергично перемешать содержимое всех пробирок и поставить их в штатив на 1 час.
7. По истечении часа сравнить объём осадка в пробирках с пептизатором с объёмом его в контрольной пробирке (№ 1). Отметить в нижней строке таблицы степень пептизации, используя символы: «-» – отсутствие пептизации, «+, ++, +++» – частичная пептизация, «++++» - полная пептизация.
Схема процесса, идущего при пептизации:
m Fe(OH)3 + nFeCl3 { [mFe(OH)3 ] nFe3+ 3(n - x)Cl - }3x+ 3xCl -
ЗОЛЬ БЕРЛИНСКОЙ ЛАЗУРИ
1. Отмерить в пробирку 5 мл 2%-ного раствора FeCl3 и добавить 1 мл насыщенного раствора K4[Fe(CN)6]. При этом образуется творожистый осадок берлинской лазури:
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 ¯ + 12KCl
2. Отфильтровать полученный осадок и промывать его на фильтре дистиллированной водой до тех пор, пока промывные воды не станут бесцветными.
3. Перенести воронку с осадком берлинской лазури на фильтре в чистую пробирку. Обработать осадок 0,1н. раствором щавелевой кислоты. В результате пептизации образуется интенсивно окрашенный синий золь берлинской лазури, частицы которого свободно проходят сквозь фильтр:
m Fe4[Fe(CN)6]3¯ + n H2C2O4 ® { [m Fe4[Fe(CN)6]3 nC2O42 - 2(n-x)H+ }2х - 2xH+
II. КОНДЕНСАЦИОННЫЕ МЕТОДЫ
Конденсацией применительно к получению коллоидных растворов называется возникновение в пересыщенном растворе зародышей (центров кристаллизации) и рост их с образованием мельчайших кристалликов - коллоидных частиц. Пересыщение может быть создано различными способами – химической реакцией, приводящей к образованию нерастворимого соединения, заменой лучшего растворителя худшим, охлаждением раствора и др.
МЕТОД ЗАМЕНЫ РАСТВОРИТЕЛЯ
В этом случае пересыщение достигается при смешивании достаточно концентрированного раствора какого-либо вещества с намного большим объемом жидкости, являющейся для этого вещества плохим растворителем. Необходим