Опыт 3. Влияние среды на протекание окислительно-восстановительной реакции
Налейте в две пробирки 3–4 капли раствора дихромата калия K2Cr2O7 и
добавьте в одну из пробирок 3–4 капли раствора серной кислоты H2SO4, в другую 3–4 капли раствора гидроксида калия КОН. Обратите внимание на изменение окраски раствора во второй пробирке вследствие протекания реакции K2Cr2O7 + 2КОН = 2К2CrO4 + H2O
Добавьте в обе пробирки раствор нитрита калия KNO2 до изменения ок-
раски. Укажите цвет полученных растворов и напишите уравнения реакций
K2Cr2O7 + KNO2 + H2SO4 → KNO3 + …
K2CrO4 + KNO2 + H2O → K [Cr(OH)4] + KNO3 +КОН
Опыт 4. Изучение окислительно-восстановительной двойственности пероксида водорода
В две пробирки налейте по 2 мл раствора пероксида водорода (Н2О2) и столько же разбавленной серной кислоты.
В первую добавьте 1 − 2 мл раствора иодида калия (КI) и 1 − 2 капли раствора крахмала. О чем свидетельствует изменение окраски крахмала?
Во вторую пробирку прибавляйте по каплям раствор перманганата калия. Что наблюдается? Чем это можно объяснить?
Какую роль играет пероксид водорода в каждой реакции? Почему это возможно? Составьте электронные уравнения процессов окисления и восстановления, расставьте коэффициенты методом электронного баланса:
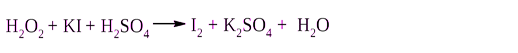

Вариант 2
Опыт 1. Зависимость окислительно-восстановительных свойств со-
единений азота от его степени окисления
а) Несколько кристаллов нитрата калия КNO3 растворите в 5 каплях
воды, добавьте 3–4 капли раствора щелочи КOH и 2–3 микрошпателя порош-
ка цинка. Нагрейте раствор до кипения (под тягой!). Осторожно по запаху
определите, какой газ выделяется при реакции. Напишите уравнение реакции
tо
Zn + KNO3 + КOH + H2O → K2 [Zn(OH)4] +…
б) К 3–4 каплям бромной воды Br2⋅aq прилейте по каплям раствор нит-
рита калия KNO2 до обесцвечивания. Объясните, что происходит. Напишите
уравнение реакции
Br2 + KNO2 + H2O → KNO3 + …
Сделайте вывод о свойствах соединений азота.
Опыт 2. Типы окислительно-восстановительных реакций
а) В пробирку налейте 1 мл раствора дихромата калия K2Сr2O7, подкис-
ленного 2–3 каплями серной кислоты, добавьте 2–3 капли соли олова SnCl2
до изменения оранжевой окраски на зеленую. Составьте уравнение реакции
окисления хлорида олова дихроматом калия в кислой среде до сульфата оло-
ва (+4), учитывая, что зеленый цвет имеют растворы солей хрома (+3)
SnCl2 + K2Сr2O7 +H2SO4 → Sn(SO4)2 + …
б) Несколько кристаллов дихромата аммония (NH4)2Cr2O7 поместите в
фарфоровый тигель и нагрейте до начала реакции разложения. Обратите внимание на характер образующихся продуктов реакции и составьте уравнение реакции
ЛАБ РАБ tо
(NH4)2Cr2O7 → N2 + …
в) В пробирку налейте 2–3 мл 30 %-го пероксида водорода Н2О2 и вне-
сите микрошпатель порошка диоксида марганца MnО2. Какой газ выделяется
(проба с тлеющей лучиной)? Напишите уравнение реакции разложения Н2О2,
учитывая, что MnО2 выполняет роль катализатора.
Опыт 3. Влияние среды на протекание окислительно-восстановительных реакций. В три пробирки внесите по 3–4 капли раствора перманганата калия
KMnO4. Затем в одну пробирку добавьте 2 капли раствора серной кислоты
H2SO4, в другую – 2 капли дистиллированной воды, в третью – 2–3 капли
раствора гидроксида калия. Во все три пробирки прибавьте несколько кри-
сталлов сульфита натрия Na2SO3.
Отметьте изменение первоначальной окраски раствора в каждой про-
бирке и составьте уравнения протекающих реакций:
KMnO4 + Na2SO3 + H2SO4 →
KMnO4 + Na2SO3 + Н2О →
KMnO4 + Na2SO3 + КОН →__






