Вопросы и примеры задач для подготовки к К/Р №1
Количественный анализ
Гравиметрический анализ
1. Гравиметрический анализ. Основы метода.
2. Образование осадков. Свойства осадков.
3. Факторы, влияющие на растворимость осадков.
4. Схема образования осадков. Кинетический и термодинамический подходы.
5. Коллоидообразование в растворах.
6. Условия аналитического осаждения.
7. Осаждение из первоначально гомогенного раствора (метод возникающих реагентов).
8. Старение осадков. Его виды и применение в гравиметрии.
9. Загрязнение осадков. Общая характеристика.
10. Загрязнение осадков вследствие адсорбции. Виды адсорбции.
11. Загрязнение осадков вследствие образования твердых растворов (сокристаллизация).
12. Загрязнение осадков вследствие захвата ионов.
13. Процессы, протекающие при прокаливании осадков. Выбор температуры прокаливания.
14. Важнейшие органические и неорганические осадители, их характеристика.
15. Требования к осаждаемой и гравиметрической формам.
16. Основные источники систематических ошибок в гравиметрии.
Примеры решения задач
Гравиметрический анализ
Пример 1. Вычислить фактор пересчета для определения калия, если после осаждения его в виде K2PtCl6 гравиметрической формой является Pt.
Решение. Из цепочки превращений
2K®K2PtCl6®Pt
следует, что 2 молям K соответствует 1 моль Pt. Фактор пересчета равен:
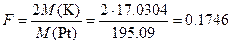 .
.
Пример 2. Рассчитать массу силикатной породы, содержащей около 5% CaO, которая необходима для получения 0.3 г CaSO4.
Решение. Фактор пересчета
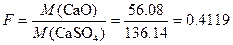 .
.
Масса m (CaO) в силикатной породе
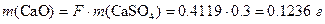
Отсюда для массы силикатной породы имеем
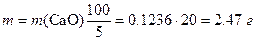
Пример 3. Какой объем 2%-го раствора AgNO3 потребуется для осаждения хлорида из навески CaCl2×6H2O массой 0.4382 г?
Решение. Находим массу, необходимую для осаждения хлорид-ионов
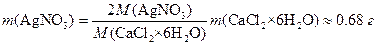
Объем раствора будет равен
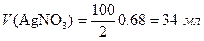 .
.
Пример 4. Из навески каменного угля массой 2.6248 г после соответствующей обработки получили 0.3248 г BaSO4. Вычислить массовую долю (%) серы в каменном угле. Пересчитать массовую долю (%) на сухое вещество, если содержание влаги в образце 2.58 %.
Решение. Фактор пересчета
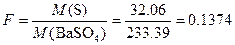 .
.
Масса серы в образце равна:
m (S)= F × m (BaSO4)=0.04462 г.
Содержание серы в образце
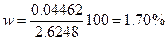 .
.
В пересчете на сухое вещество
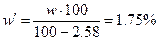 .
.
Пример 5. При определении оксидов щелочных металлов из образца силикатной породы массой 1.2505 г выделили смесь NaCl и KCl массой 0.1500 г. После обработки этой смеси серной кислотой получили сульфаты Na2SO4 и K2SO4 массой 0.1800 г. Вычислить массовую долю (%) Na2O и K2O в силикатной породе.
Решение. Факторы пересчета Na2O и K2O в хлориды и сульфаты будут следующими:
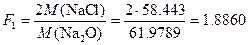 ,
, 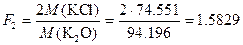
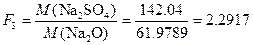 ,
, 
Массы хлоридов и сульфатов будут соответственно равны:
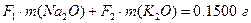 ,
,
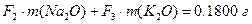 .
.
Решая полученную систему уравнений и деля найденные массы оксидов на массу образца, получаем: w (Na2O)=4.28%, w (K2O)=2.48%.
Пример 6. Вычислить потери (г и %) за счет растворимости осадка СаС2О4×H2O, если к 20 мл 0,1 М CaCl2 добавили: а) эквивалентное количество 0,1 М (NН4)2С2О4; б) полуторный избыток 0,1 М (NН4)2С2О4
Решение. а) Масса осадка СаС2О4×Н2О (М=146,12), образующегося при осаждении, равна
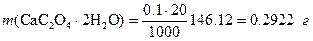 .
.
Объем раствора после добавления эквивалентного количества осадителя 20+20=40 мл; ПР (CaC2O4)=2.3×10–9. Отсюда 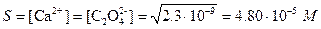 . Потеря оксалата кальция за счет растворимости составит
. Потеря оксалата кальция за счет растворимости составит
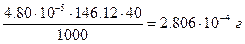
или
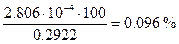
б) При использовании полуторного избытка осадителя масса осадка остается практически неизменной - 0,2922 г СаС2О4×Н2О. Объем раствора после осаждения равен 20+20×1,5=50 мл. При добавлении полуторного количества осадителя избыток его составляет 10 мл 0.1 М. Концентрация ионов С2О42– в полученном растворе будет составлять 0.1×10/50= 0.02 М. Поскольку в растворе находится избыток С2О42– растворимость СаС2О4 будет определяться концентрацией ионов кальция и
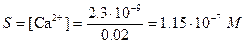 или
или 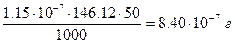 , что составляет 2.9×10–4 %.
, что составляет 2.9×10–4 %.
Пример 7. Сколько процентов составят потери за счет растворимости при промывании 0,2 г осадка Мg(ОН)2 250 мл воды? Какова должна быть концентрация аммиака в промывной жидкости, чтобы потери промывании осадка таким же объемом составляли не более 0,1%?
Решение. На основании ПР=[Mg2+][OH-]2=6,0×10-19 определяем концентрацию Мg2+ и равную ей концентрацию Мg(ОН)2 в насыщенном растворе. Согласно уравнению реакции
Mg(OH)2ÛMg2++2OH-
Растворимость осадка в отсутствие избытка одноименного иона будет равна
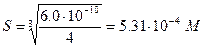
Значит потери за счет растворимости Мg(ОН)2 (М =58,320) в 250 мл составляют 5,31×10-4×0,250×58,320=7,74×10-3 г Mg(OH)2 или 3,87%
При использовании в качестве промывной жидкости раствора аммиака растворимость Mg(OH)2 понижается за счет введения одноименных с осадком ионов OH-. Зная, что потери должны составлять 0,1%, находим растворимость Mg(OH)2:
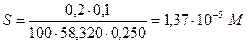
Следовательно, [Мg2+]=1,37×10-5 M. Отсюда, на основании произведения растворимости, имеем
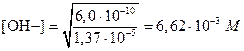
На основании константы диссоциации NН3
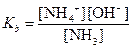
вычисляем концентрацию NН3 в растворе, в котором [ОН-]=6,62×10-8 M. Так как в водном растворе аммиака [NH4+]=[ОН-], то из константы диссоциации следует
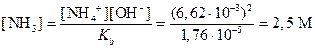
Пример 8. Произведения растворимостей BaCO3 и PbCO3 соответственно равны 8×10-9 и 7.3×10-14. Из раствора, содержащего 0.001 M Ba2+ и 10-5 Pb2+, осаждается половина бария. Какова теоретическая молярная доля PbCO3 в осадке:
а) если ни какого соосаждения не происходит,
б) если происходит равномерное распределение примеси,
в) если происходит логарифмическое распределение примеси?
Решение.
а) После осаждения половины бария, [Ba2+]=5×10-4 M. Концентрация карбонат-иона, [CO32-]=8×10-9/5×10-4 =4×10-5 M. При этой концентрации карбоната [Pb2+]=7.3×10-14/4×10-5=1.83×10-9 M, т.е. свинец практически полностью переходит в осадок. Отсюда молярная доля PbCO3 в осадке
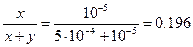
б) 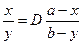 , D=8×10-9/7.3×10-14=1.10×105.
, D=8×10-9/7.3×10-14=1.10×105. 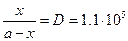 , x» a =10-5,
, x» a =10-5,
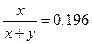
в) l=1.10×105, 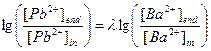 ,
, 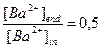 ,
, 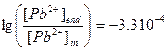 .
.
x» a =10-5, 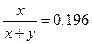
Пример 9. Произведения растворимостей BaCO3 и PbCO3 соответственно равны 8×10-9 и 7.3×10-14. К 1 л раствора, содержащего 0.001 M Ba2+ и 10-5 Pb2+, добавляют 0.0011 М карбоната. Каковы концентрации катионов бария и свинца, оставшихся в растворе,
а) если никакого соосаждения не происходит,
б) если происходит равномерное распределение примеси,
в) если происходит логарифмическое распределение примеси?
Решение.
а) После добавления карбоната в осадок практически полностью выделяется ион бария. Если в первом приближении пренебречь образованием PbCO3, то [CO32-]=0.0011-0.001=10-4 M. Произведение концентраций [Pb2+]in×[CO32-]=10-9 > 7.3×10-14. Другими словами, в осадок будут выделяться оба катиона. В соответствии с этим
[CO32-]=0.0011-0.001-10-5+8×10-9/[CO32-]+7.3×10-14/[CO32-].
Решением этого квадратного уравнения является [CO32-]=1.45×10-4 М.
Отсюда для равновесных концентраций катионов в растворе получаем:
[Ba2+]end=8×10-9/1.45×10-4=5.5×10-5 М, [Pb2+]end=7.3×10-14/1.45×10-4=5.0×10-10 М
б) Из пункта а) следует, что как барий, так и свинец практически полностью выделяются в осадок. Если принять, что образующийся твердый раствор является идеальным, то активность соответствующего компонента в твердой фазе будет равна его молярной доле в ней:
a (PbCO3)=10-5/(0.001+10-5)=9.9×10-3»0.01, a (BaCO3)»1-0.01=0.99.
[Pb2+]end×[CO32-]=ПР(PbCO3)× a (PbCO3), [Pb2+]end=7.3×10-14×0.01/1.45×10-4=5.0×10-12 М
[Ba+]end×[CO32-]=ПР(BaCO3)× a (BaCO3), [Ba2+]end=8×10-9×0.99/1.45×10-4=5.6×10-5 М
в) l=8×10-9/7.3×10-14=1.10×105, 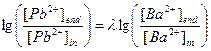 ,
,
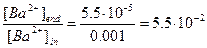 ,
, 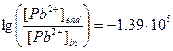 , [Pb2+]end»0.
, [Pb2+]end»0.
Задачи
1. Какую навеску пирита, содержащего около 30% серы нужно взять для анализа, чтобы получить 0,3 г осадка BaSO4?
2. Вычислить фактор пересчета, если при определении мышьяка сначала осадили As2S3, затем окислили серу до SO42-, осадили сульфат хлоридом бария и взвесили BaSO4?
3. Какую навеску Fe3O4 следует взять для получения 1,0 г Fe2O3?
4. Определение содержания серы выполняют по схеме S®H2S®CdS®CuS®CuO. Вычислить фактор пересчета для определения S по CuO.
5. Вычислить фактор пересчета для определения HF, если анализ выполняли по схеме: HF®CaF2®CaSO4.
6. Для определения сульфата в растворе Fe2(SO4)3 осадили Fe(OH)3 и после прокаливания осадка получили гравиметрическую форму Fe2O3. Вычислить фактор пересчета.
7. Вычислить фактор пересчета для определения P2O5, если анализ выполняли по схеме: P2O5®PO43–®(NH4)3PO4×12MoO3®PbMoO4.
8. Вычислить фактор пересчета для определения калия, если после осаждения его в виде K2PtCl6 получена гравиметрическая форма платины.
9. Вычислить фактор пересчета для определения тиосульфата натрия, если после окисления и осаждения получена гравиметрическая форма BaSO4.
10. Вычислить фактор пересчета для определения CaO, если анализ выполняли по схеме: CaO®Ca3(PO4)2®Mg2P2O7.
11. Вычислить фактор пересчета для определения NH3 по хлорплатинатному методу, при котором гравиметрической формой является металлическая платина (NH3®(NH4)2PtCl6®Pt).
12. Сколько вещества, содержащего около 50% железа, следует взять для анализа, чтобы масса прокаленного осадка Fe2O3 была 0,1 г?
13. Анализ карбида кальция выполняли по схеме CaC2®H2C2®Ag2C2®AgCl. Вычислить фактор пересчета для определения CaC2.
14. Смесь бромида и иодида серебра содержит по массе 55,25 % серебра. Вычислить процентное содержание каждой соли в смеси.
15. Рассчитать навеску вещества, содержащего около 1% K2SO4 и 3% KCl, необходимую для получения 0,2 г осадка KClO4.
16. При анализе 0,6528 г вещества получили 0,2825 г смеси сульфатов калия и магния. Масса Mg2P2O7, выделенного из этой смеси, составила 0,1536 г. Вычислить процентное содержание оксидов калия и магния в анализируемом веществе.
17. Из навески 1,0000 г силикатной породы получили смесь солей NaCl и KCl общей массой 0,1015 г. Из этой смеси получили осадок K2PtCl6 0,2040 г. Вычислить процентное содержание Na2O и K2O в силикате.
18. Сульфат алюминия содержит около 88% Al2(SO4)3×18H2O. Рассчитать навеску, необходимую для определения алюминия в виде Al2O3, если масса Al2O3 0,1 г.
19. Какой объем 0,1 М AgNO3 потребуется для осаждения хлора из 1,0 г смеси, содержащей одинаковые массы BaCl2×2H2O и NaCl, если осадитель добавляется в стехиометрическом соотношении?
20. Вычислить потери Са (г и %) за счет растворимости осадка СаС2O4, если к 20 мл раствора, содержащего 0.1 г кальция, прибавили 35 мл 0,25 М (NH4)2C2O4.
21. Сколько процентов составят потери за счет растворимости AgCl при осаждении 0,15 г хлорида эквивалентным количеством нитрата серебра в 1 л раствора?
22. Сколько миллилитров 0,1 н. (NH4)2SO4 нужно прибавить к 300 мл воды, чтобы при промывании осадка 0,5 г BaSO4 этим раствором потери за счет растворимости не превышали 0,01%?
23. Сколько миллилитров 25%-ного NH3 нужно добавить к 150 мл промывной жидкости, чтобы при промывании осадка MgNH4PO4 потери за счет растворимости составили не более 0,0001 г MgO?
24. Вычислить потери PbSO4 (г и %) за счет растворимости осадка, полученного при добавлении к 20 мл 0,1 М Pb(NO3)2 и полуторного избытка 0,1 М H2SO4
25. Сколько миллилитров 0,1 М (NH4)2CO4 необходимо для осаждения кальция и стронция из 200 мл раствора, содержащего в 1 л 0,555 г СаСl2 и 0,317 г SrCl2, если осадитель добавляют в стехиометрическом количестве?






