Всякое изменение состояния газа называют термодинамическим процессом.
При переходе данной массы газа из одного состояния в другое в общем случае могут меняться все параметры газа: объём, давление и температура. Однако, иногда меняются какие-либо два из этих параметров, а третий остаётся неизменным. Процессы, при котором один из параметров состояния газа остаётся постоянным, а два других изменяются, называют изопроцессами.
Изотермический процесс (Т=const). Закон Бойля—Мариотта.
 Процесс, протекающий в газе, при котором температура остается постоянной, называют изотермическим («изос» — «одинаковый»; «терме» — «тепло»). Если при постоянной температуре увеличивать объём V, давление Р уменьшается, когда объём V уменьшается - давление Р растёт, а произведение Р на V сохраняется.
Процесс, протекающий в газе, при котором температура остается постоянной, называют изотермическим («изос» — «одинаковый»; «терме» — «тепло»). Если при постоянной температуре увеличивать объём V, давление Р уменьшается, когда объём V уменьшается - давление Р растёт, а произведение Р на V сохраняется.
рV = соnst (2.6)
Этот закон называется законом Бойля – Мариотта, так как почти одновременно был открыт в XVII в. французским ученым Э. Мариоттом и английским ученым Р. Бойлем.
Закон Бойля-Мариотта формулируется так: произведение давления газа на объем для данной массы газа есть величина постоянная:
Графически этот закон в координатах Р, V изображается линией, называемой изотермой (рис. 2.3). Для одной и той же массы газа разные изотермы соответствуют процессам, происходящим при различных температурах.
Изобарный процесс (P=const). Закон Гей-Люссака.
Процесс, протекающий в газе, при котором давление остается постоянным, называют изобарным («барос» — «тяжесть»). Простейшим примером изобарного  процесса является расширение нагреваемого газа в цилиндре со свободным поршнем. Наблюдаемое при этом расширение газа называют тепловым расширением.
процесса является расширение нагреваемого газа в цилиндре со свободным поршнем. Наблюдаемое при этом расширение газа называют тепловым расширением.
Опыты, проведенные в 1802 году французским физиком и химиком Гей-Люссаком показали: при неизменном давлении отношение объёма дано массы идеального газа к его абсолютной температуре является величиной постоянной, (закон Гей-Люссака)
 или
или 
Графическая зависимость объема от температуры изображается прямой линией — изобарой (рис. 2.4). При очень низкой температуре (близкой к -273 °С) закон Гей-Люссака не выполняется, поэтому сплошная линия на графике заменена пунктиром.
Изохорный процесс (V=const). Закон Шарля.
Процесс, протекающий в газе, при котором объем остается постоянным, называют изохорным («хорема» — вместимость). Для осуществления изохорного процесса газ помещают в герметический сосуд, не меняющий свой объём
Французский физик Ж. Шарль установил: при неизменном объёме отношение давления данной массы идеального газа к его абсолютной температуре является величиной постоянной, (закон Шарля)

 или
или 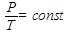
Графическая зависимость давления от температуры изображается прямой линией — изохорой (рис. 2.5).
Если изохору (рис. 2.5) продолжить в область отрицательных температур, то в точке пересечения с осью абсцисс имеем
Между открытием первого закона –(закона Бойля-Мариотта) и второго (закона Гей-Люссака) прошло больше, чем сто лет. Почему? Дело в том, что в первом опыте неважно при какой температуре проводятся измерения. Надо только, чтобы она не менялась. Но чтобы исследовать зависимость объёма от температуры надо уметь измерять температуру. В конце XVII и почти весь XVIII век проблема измерения температуры была одной из главных и очень сложной.
Первый современный термометр был описан в 1724г Даниелем Фаренгейтом, стеклодувом из Голландии. Во Франции в употребление вошла шкала Реомюра (около 1740г) и до начала ХХ века использовалась во многих странах. Современная шкала Цельсия была предложена в 1742г. После открытия газового термометра –самого чувствительного и самого точного эта проблема была решена.
Термодинамическая шкала температур была предложена английским ученым Кельвином (У. Томсоном). За начало отсчета на этой шкале принята температура
0К. Нуль Кельвина — это предельная температура, при которой давление идеального газа равно нулю.
За единицу температуры по термодинамической шкале принят кельвин (К); соответствует 1°С.
Температура, отсчитанная по термодинамической шкале температур называется термодинамической температурой. Так как точка плавления льда при нормальном атмосферном давлении, принятая за 0°С, равна 273,16 К-1, то
Т(К) = 273,16 + t°С (2.11)






