Понимание рака
Инициирование и прогрессия рака зависят и от внешних факторов окружающей среды (табак, химические вещества, радиация и инфекционные агенты) и внутренних факторов клетки (наследуемые мутации, гормоны, иммунное состояние и мутации в процессе метаболизма). Эти факторы могут действовать одновременно или последовательно, приводя к аномальному поведению клеток и избыточной пролиферации. В результате клеточная масса растет и распространяется, изменяя окружающие нормальные ткани (такие как в головном мозге), и может также диссеминировать в другие области организма (метастазирование). Однако, важно помнить, что в наиболее распространенных раковых образованиях необходимы месяцы и годы для аккумуляции этих ДНК мутаций и формирования выявляемого канцера.
Раковые образования возникают приблизительно у одного из каждых 3 индивидуумов. Мутации ДНК в обычных условиях возникают с частотой 1 на каждые 20 миллионов из расчёта на ген на клеточное деление. Среднее количество клеток, формируемых у какого-либо индивидуума в течение средней продолжительности жизни, составляет 1016 (10 миллионов клеток, замещаемых каждую секунду!). Поэтому было бы логично предположить, что популяции людей в какой-либо точке мире покажут сходную частоту рака. Однако, заболеваемость канцером (количество диагностированных индивидуумов) резко варьируют между странами. Очевидно, некоторые факторы, видимо, вмешиваются с резким увеличением инцидента канцера в некоторых популяциях. Очевидный вывод заключается в том, что предрасполагающие факторы, которые вызывают рак, являются либо наследуемыми, либо средовыми. Это означает, что или определенные популяции несут большое количество генов восприимчивости к канцеру, или окружающая среда, в которой находятся популяции, в значительной степени способствует заболеваемостью раком.
1.4 Причины рака (этиология рака)
Что из двух - гены или окружение - играют доминирующую роль в развитии рака? В то время как гены распределены неравноценно через популяции, они не объясняют различия в раковых заболеваемостях в мире. Это продемонстрировано наиболее показательно на следующем примере. Частота рака желудка в 6-8 раз выше среди японцев по сравнению с американцами. Однако, дети эмигрировавших в Америку японцев имеют заболеваемость раком желудка, сопоставимую с заболеваемостью в американской популяции. Поэтому, риск развития рака видится в значительной степени средовым, составляющем более 90% всех вызванных канцерных образований.
1.4.1 Образ жизни и окружающая среда
Первое известное сообщение, связывающее влияние образа жизни с раком, было сообщение John Hill, английского врача, который замечти связь между раком носа и использованием нюхательного табака. В конце 18-ом столетия, сэр Percival Pott сообщил, что рак мошонки у трубочистов был связан с плохой гигиеной и накоплением вызывающих рак агентов в саже. Датская Гильдия Трубочистов рекомендовала ежедневные ванны, что было наиболее вероятной причиной для драматического снижения заболеваемости раком мошонки в Европе.
В 1950, убедительные эпидемиологические данные показали, что часто курящие люди имеют в 20 раз выше риск развития рака легких по сравнению с некурящими. С тех пор, курение и потребление спирта связывают почти с ~170 000 летальными исходами рака рта и гортани ежегодно в одних только США (Рис. 1.3). Более чем полмиллиона смертельных случаев каждый год, ожидают, будет вызвано ожирением, физической пассивностью, диетой (малое потребление овощей, избыток соли или нитратов связаны с канцером желудка и пищевода, тогда как чрезмерно жирная пища с малым количеством клетчатки связаны с раковыми образованиями кишечника, поджелудочной и молочной желез и простаты).
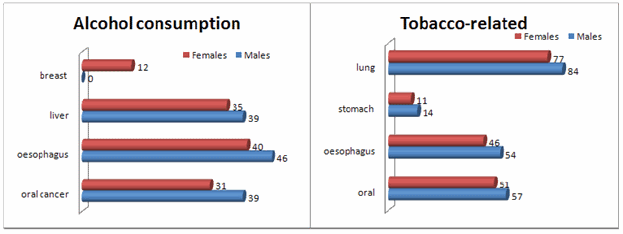
Фигура 1.3: Процент раковых образований, приписываемых избыточному потреблению спирта и использованию табака. Избыточное потребление спирта связано с раковыми образованиями печени и рта/гортани как у мужчин, так и у женщин. Риск рака молочной железы высок у женщин, которые выпивают больше алкоголя. Курение и использование табака достоверно увеличивает риск рака легких и у мужчин, и у женщин, и также немного выше риск раковых образований рта/гортани. Источник: SEER обзор статистики канцера, НИР, США
Другие раковые образования, вызванные возбудителями инфекции, включая вирусы [вирус гепатита B (HBV), вирус папилломы человека (HPV), вирус иммунодефицита человека (ВИЧ) - которые вызывают носоглоточные, цервикальные карциномы и саркому Капоши] и бактерии, такие как Helicobacter pylori (раковые образования желудка). Частота раковых образований кожи (меланомы) повышается, особенно в Австралии, в результате экспозицию высоким уровням ультрафиолетового излучения солнца и популярности соляриев. Однако риск развития этих раковых образований может быть снижен путем изменения образа жизни, использованием вакцин и антибиотиков.
Инициирование и прогрессия рака также являются следствием действия канцер-вызывающих агентов (канцерогенов, мутагенов). Они присутствуют в пище и воде, в воздухе, в химических веществах и солнечном свете, которым экспонируются люди. Поскольку эпителиальные клетки покрывают кожу, выстилают дыхательные пути и пищеварительные тракты, и метаболизируют принятые внутрь канцерогены, не удивительно, что более 90% раковых образований происходят из эпителия ('карциномы'). В менее чем 10% случаев генетическая предрасположенность повышает риск развития рака в более ранние сроки. Например определенные лейкозы детства, ретинальные раковые образования и т.д.
1.4.2 Возраст
Хотя рак может наблюдаться у людей любого возраста, он наиболее распространен среди популяции пожилых (РИС. 1.4). Шестьдесят процентов новых случаев канцера и две трети летальных исходов рака наблюдаются в людей старше 65 лет. Частота распространенных раковых образований (например, молочной железы, колоректального отдела кишечника, простаты и легких) увеличивается с возрастом.
Несколько теорий пытаются объяснить, почему частота рака увеличивается у пожилых: возрастные альтерации иммунной системы (сниженное иммунное наблюдение); аккумуляция случайных генетических мутаций или длительная экспозиция канцерогенов (особенно для колоректального и рака легких); гормональные нарушения или экспозиции; и высокая продолжительность жизни.
Необходимость множественных генетических изменений для развития рака наиболее ярко иллюстрируется пошаговыми генетическими изменениями, которые демонстрируют многие полипы толстого кишечника, прогрессирующие в канцер.
Экспоненциальный рост частоты многих раковых образований с возрастом связан с повышенной восприимчивостью в позднем периоде к канцерогенезу, индуцированному средовыми экспозициями. Экспозиция эстрогена в течение жизни может привести к раку молочной железы или матки; экспозиция тестостерона - к раку простаты. Снижение клеточного иммунитета может также привести к определенным типам рака, которые высоко иммуногены (например, лимфомы, меланомы). Аккумуляция ДНК мутаций должна быть усилена для формирования рака, поэтому чем длинее продолжительность жизни, тем выше риск развития рака.

Рис. 1.4: Возрастная частота и летальность для всех типов раковых образований. Источник: SEER Обзор Статистики Канцера, НИР, США
Распространение в другие области (метастазирование)
Солидные опухоли, как правило, являются частью нормальных тканей, и при оптимальных условиях, могут инвазировать смежные ткани или, поступая в кровеносную систему, колонизировать отдаленные области организма. Эти вторичные опухоли - метастазы- ответственны почти за 90% канцер-ассоциированных летальных исходов. Способность опухолевых клеток инвазировать и метастазировать является завершением шести признаков рака. Метастазы позволяют опухолям выживать и расти в новой среде, где отсутствуют ограничения пространства или питательных веществ. Недавно сформированные вторичные опухоли могут содержать раковые клетки и некоторые нормальные поддерживающие клетки, задействованные из нормальных тканей. Как и любая другая опухоль, метастатические опухоли также показывают нарушения в сигнальной цепи как описано в других 5 признаках.
Однако, метастатические опухоли показывают дополнительные уникальные клеточные черты, которые позволяют им меняться и адаптироваться к их новой среде. Точный механизм инвазии и метастазирования представляет сложный процесс и является субъектом интенсивных исследований, но включает обычную стратегию физического заселения раковых клеток в новую область путем активации внеклеточных протеаз.
Раковые клетки напоминают плохих фокусников, когда дело доходит до инвазии и метастазирования. "Гудини" клеточного мира - лейкоцит иммунной системы. В ответ на инфекцию эти клетки покидают кровеносную систему и направляются в окружающие ткани. Лейкоцитам требуется меньше минуты для "понуждения" эндотелиальных клеток капиллярной стенки к ретракции, позволяя им вступать в ткань для атаки на возбудители инфекции (процесс, названный дипедезисом). Раковые клетки однако полагаются на грубую силу для инвазии в окружающую ткань, главным образом вследствие утраты ими необходимых биохимических механизмов, и им может потребоваться до 24 часов для завершения процесса.
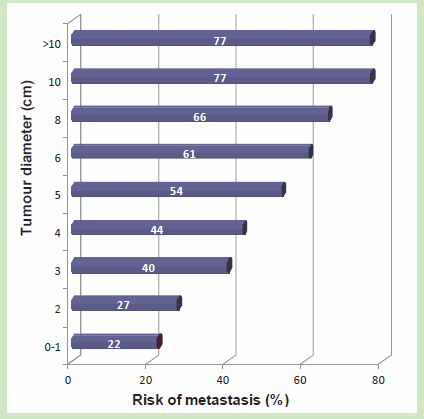
Возрастает ли риск метастазирования с увеличением размера опухоли?
Изучение 1589 пациентов с раком молочной железы (рисунок справа) показывает повышенный риск развития отдаленных метастазов с увеличением грубого объема опухоли. Например, только 22 % женщин с размером опухоли менее 1 см имели метастазы по сравнению с 77 % женщин с опухолями более 10 см. Однако, вопрос, приобретены ли мутации, необходимые для метастазирования, в раннем или позднем периоде канцерной прогрессии, все еще неразрешен.
7.1. Каковы стадии метастазирования?
Миграция раковых клеток от первичной локализации в отдаленную область - сложный биологический процесс, который включает изменения на молекулярном, клеточном и физическом уровне. Коротко, каскад инвазии и метастазирования обычно включает следующие стадии (Рис. 7.1)
1. Локальная инвазия. в этом процессе небольшая in situ опухоль прорывается за барьер базальной мембраны
2. Интравазация. Опухолевые клетки перемещаются через стены капилляров или лимфатических сосудов в кровеносную систему. Это - критический шаг метастатического пути, и включает сложное, морфологическое изменение, лагодаря которому раковая клетка приобретает свойства инвазивности и клеточной подвижности. Это позволяет раковой клетке проложить свой путь через капиллярную стенку в кровеносную систему.
3. Транспорт. Раковые клетки перемещаются с кровью или лимфой, пока не фиксируются на солидной поддерживающей ткани. Хотя и кровь, и лимфа ответственны за транспорт, большинство отдаленных метастазов связаны с кровотоком. На данном этапе, большинство раковых клеток может теряться или разрушаться во враждебном окружении. Однако, выживающие раковые клетки получают доступ к тканям в первом наборе капилляров, с которыми они взаимодействуют (главным образом, благодаря крупным клеткм, блокирующим небольшой пассаж по капиллярам) и формируют микротромбы.
4. Экстравазация. Этот конечный шаг миграции чрезвычайно подобен интравазации, но главное отличие в том, что направление движения полностью обратно. Раковые клетки в микротромбах теперь проталкиваются через капиллярную стенку и напавляются в тканевую среду.
5. Формирование микрометастазов. В процессе экстравазации, раковые клетки начинают реактивировать клеточные пролиферативные пути и формировать небольшую опухолевую массу, которая или развивается в полости капилляра или через стенку сосуда.
6. Колонизация. Это - наиболее сложная стадия, главным образом, поскольку новая среда не всегда может обеспечивать необходимыми для роста факторами выживания и пролиферации. Большинство раковых клеток как правило гибнет или остается в живых в течение длительных периодов как микрометастазы (которые намного труднее обнаружить)

Рис. 7.1. Биологические пути метастазирования рака.
7.2. Ключевые молекулы, вовлеченные в метастазирование
Однако, завершение всех 6 шагов, отмеченных ранее, наблюдается не всегда, и процесс метастазирования высоко неэффективен, с колонизацией как наименее эффективны шагом. Для превращения опухолевой клетки в метастатическую необходимы несколько изменений, разрешающих интра-, экстравазацию и колонизацию. Сложность этого процесса иллюстрируется карциномными клетками. Эти раковые клетки активируют цикл клеточного дифференцирования, названный ЭМТ (эпителиально-мезенхимальный транзит) путем индукции экспрессии нескольких ЭМТ-разрешающих транскрипторных факторов. Это позволяет раковой клетке приобрести характеристики мезенхимальных клеток, такие как инвазивность и подвижность.
Эти изменения в характеристиках включают несколько протеинов, ответственных за тканевую инвазию и распространение, и некоторый из ключевых игроков выделены ниже
a) Одними из наиболее важных протеинов являются межклеточные адгезивные молекулы (CAM), главная роль которых заключается в закреплении клетки в окружающей ткани. Среди CAM, самый распространенный протеин, вовлеченный в метастазирование, - E-кадгерин, найденный во всех эпителиальных клетках. В нормальных клетках E-кадгерин действует как мостик между смежными клетками, устанавливая цитоплазматический контакт и разделяя внутриклеточные сигнальные факторы, ответственные за ингибирование способности к инвазии и метастазированию. Большинство эпителиальных раковых образований демонстрируют утрату E-кадгериновой функции, и эта элиминация играет значительную роль в способности к метастазированию.
b) Другой класс протеинов, вовлеченных в тканевую инвазию, является интегринами, широко распростаненной семьей гетеродимерных трансмембранных адгезивных рецепторов, которые связывают клетки с внеклеточным матриксом. Дополнительно к роли в ангиогенезе они также играют центральную роль в клеточной адгезии и миграции, контроле клеточного дифференцирования, пролиферации и выживания. Изменения в экспрессии интегринов также очевидны в инвазивных и метастатических клетках. Успешная колонизация новых областей (и локальных, и отдаленных) требует адаптации, которая достигается путем изменения субъединиц интегринов, показанные мигрирующими клетками. Например, карциномные клетки облегчают инвазию, предпочтительно экспрессируя интегриновые субъединицы, необходимые для связывания с деградированными внеклеточными протеазами стромальными компонентами.
c) Другая стратегия для успешной колонизации - повышенная экспрессия внеклеточных протеаз (подобных MMP - Matrix MetalloProteinases Матриксные Металлопротеиназы) наряду с уменьшением уровней протеазных ингибиторов. Клетки в строме рядом с раковыми клетками секретируют активные протеазы, которые облегчают инвазию благодаря деградации компонентов внеклеточного матрикса. Это позволяет раковым клеткам мигрировать за границы кровеносного сосуда и через слои нормальных эпителиальных клеток.
Все упомянутые выше протеины являются витальными для инвазивной и метастатической способности. Однако, регулирующие и молекулярные цепи, видимо, отличаются в средах различных тканей, и их точные роли в различных типах опухолей являются высоко вариабельными. Инвазия и метастазирование представляют последнюю большую область для исследования канцера. Вызов заключается в применении нового молекулярного понимания тканевой инвазивности и метастазирования для развития эффективных терапевтических стратегий.
http://cancer-reviews.ru/biology.html






