Преподаватель Дворяшина Ю.С.
Студент Беренцева Сусанна
Группа ЕТ-232
Учебный год 2016/17 Семестр 4
Челябинск
Теория
Наиболее простым и производительным методом анализа нитратов в названных объектах является метод прямой потенциометрии с индикаторным нитратселективным электродом. По механизму возникновения потенциала pNO3-электрод относится к мембранным ионообменным электродам.
В качестве ионообменника обычно используют нитрат четвертичного аммониевого основания (NR4NO3), нитрат тетрафениларсония (As(C6H5)4NO3) или нитрат триcфенантролинникеля (II) ([Ni(Phen)3](NO3)2). Диапазон линейности электродной функции – от 0,35 до 4.3 ед. рNO3 при рН от 2 до 9. Определению нитрата не мешают многие анионы: Cl–, HCO3–, CH3COO– , F- и SO42–.
Равновесный потенциал электрода с ионообменной мембраной описывается модифицированным уравнением Нернста (уравнением Никольского – Эйзенмана):
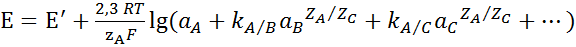 (2.1)
(2.1)
где Е′ – постоянная при постоянстве состава раствора по матричным компонентам, а также при постоянном диффузионном потенциале жидкостного соединения гальванической ячейки,
а А, а В, а С – активности аналита и посторонних ионов, соответственно,
z А, z В, z С – их заряды.
При постоянстве ионной силы раствора, которую обеспечивают добавлением в анализируемый раствор больших количеств индифферентного электролита, активности в уравнении (2.1) можно заменить на концентрации. Мешающее влияние каждого постороннего иона характеризуется коэффициентом потенциометрической селективности: k A/B, k A/C и т.д. В общем случае коэффициент крутизны электродной функции S несколько меньше нернстовского коэффициента: S≤ 2,3 RT/zF.
Ниже приведены технические характеристики ионселективного электрода марки ЭЛИС-121 NO3:
· Диапазон измерений рNO3 при 20 ºС от 0,3 до 4,3.
· Величина рН анализируемого раствора должна быть от 2 до 10.
· Крутизна электродной характеристики при 20 ºС – 54,0 мВ/рNO3.
· Коэффициенты селективности для мешающих ионов: Cl– – 5·10–3;CH3COO– – 5·10-4; SO42– – 8·10–4.
В отсутствии посторонних ионов уравнение (2.1) записывают в виде:
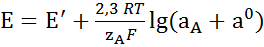 (2.2)
(2.2)
в котором а 0 имеет смысл «вымывания» потенциалопределяющих ионов (ионов А) из материала мембраны. Главной причиной вымывания считают растворимость ионообменника в воде и ионообменное вытеснение иона А примесями. Вымывание ионообменника из мембраны ограничивает диапазон линейности электродной функции (диапазон измерений, нернстовский участок). Линейный участок электродной функции описывается уравнением:  (2.3) которое выполняется с достаточной точностью при условии а А>> а 0. Вымывание влияет на предел обнаружения потенциалопределяющего вещества. При а А = 0 измеренное значение потенциала называют фоновым потенциалом. Предел обнаружения с min обычно находят графическим способом как это показано на рис. 3.
(2.3) которое выполняется с достаточной точностью при условии а А>> а 0. Вымывание влияет на предел обнаружения потенциалопределяющего вещества. При а А = 0 измеренное значение потенциала называют фоновым потенциалом. Предел обнаружения с min обычно находят графическим способом как это показано на рис. 3. 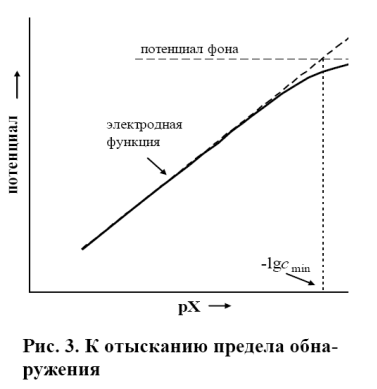
Коэффициенты потенциометрической селективности изготовители электродов обычно приводят в инструкции по применению электрода. Эти коэффициенты находят экспериментально по методу смешанных растворов или методом раздельных растворов. Проще других метод раздельных растворов, одна из расчетная формул которого: 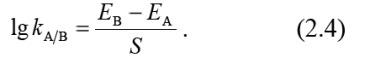
Это уравнение получают из уравнения (2.1), если вначале измеряют потенциал электрода Е В в растворе, содержащем только посторонние ионы В. Затем определяют потенциал раствора аналита Е А. Измерения проводят с растворами, активности ионов в которых равны. Причем заряды ионов А и ионов В должны быть одинаковы.
Прежде чем использовать ионселективный электрод в анализе необходимо внимательно изучить по документации, а лучше проверить экспериментально, следующие его основные характеристики:
1) интервал определяемых содержаний, в котором выполняется линейная (нернстовская) зависимость потенциала от логарифма активности (концентрации) потенциалопределяющего иона;
2) крутизну электродной функции на ее нернстовском участке;
3) предел обнаружения;
4) селективность электрода;
5) время отклика электрода (время установления равновесного потенциала);
6) рабочий интервал рН растворов, рекомендуемый для данного электрода.
Приборы, оборудование и реактивы
1. Иономер Мультитест ИПЛ-102 или его аналог.
2. Нитратселективный электрод, например, марки ЭЛИС-121 NO3.
3. Хлорсеребряный электрод сравнения с двойным солевым мостиком, например, марки ЭСр-10101.
4. Термометр сопротивления (датчик температуры).
5. Магнитная мешалка.
6. Весы лабораторные 2-го класса точности.
7. Цилиндр мерный вместимостью 50 мл.
8. Колба мерная вместимостью 50 мл.
9. Колба мерная вместимостью 100 мл.
10. Пипетка Мора вместимостью 5 мл.
11. Тарированная капельная пипетка.
12. Стаканы высокие вместимостью 100 мл для измерений – 4 шт.
13. Промывалка.
14. Резиновая груша.
15. Стандартный раствор 0,1 М нитрата калия.
· Готовят из образца состава ГСО 6094-91 в соответствии с инструкцией его применения или из реактива.
· Для этого взвешивают на лабораторных весах 5,005 г предварительно высушенного в сушильном шкафу при 110 С в течение 3 часов нитрата калия.
· Количественно переносят навеску в мерную колбу вместимостью 500 мл, растворяют навеску в дистиллированной воде, доливают колбу дистиллированной водой до метки и перемешивают.
16. Стандартный раствор 0,1 М хлорида калия.
· Готовят из стандарттитра или из реактива.
· При приготовлении из реактива растворяют навеску 7,455 г соли в 1000 мл дистиллированной воды.
17. Алюмокалиевые квасцы, 1 %-ный раствор.
18. Раствор 0,3 М сульфата калия для заполнения внешнего солевого мостика электрода сравнения.
· Взвешивают 5,2 г сульфата калия и растворяют в 100 мл дистиллированной воды.
19. Дистиллированная вода из промывалки.
20. Фильтровальная бумага.
Выполнение работы
· Осуществляют внешний осмотр рабочего места и оборудования с целью проверки комплектности и выявления неисправностей.
· Включают прибор и прогревают его в течение 20 мин.
· Натирают огурец
ГРАДУИРОВАНИЕ ИОНОМЕРА В ШКАЛЕ ПОКАЗАТЕЛЕЙ АКТИВНОСТИ PNO3.
· Для градуирования используют три раствора с концентрацией нитрата калия 1·10–2, 1·10–3 и 1·10–4 М, показатели активности для которых соответственно равны pNO3 = 2,04, 3,02 и 4,00.
· Растворы приготовляют последовательным разведением головного 0,1 М стандартного раствора нитрата калия.
ПЕРВЫЙ ГРАДУИРОВОЧНЫЙ РАСТВОР ГОТОВЯТ:
· помещая пипеткой 5 мл стандартного раствора с концентрацией 0,1 М из стаканчика в мерную колбу, и доливают водой до 50 мл. Стаканчик должен быть предварительно промыт малыми порциями головного стандарта. Мерную колбу предварительно следует ополоснуть дистиллированной водой.
· Раствор из колбы переливают в сухой стакан для измерений с надписью «№ 1».
ВТОРОЙ СТАНДАРТНЫЙ РАСТВОР ПОЛУЧАЮТ ИЗ ПЕРВОГО.
· Для этого 5 мл раствора «№ 1»переносят пипеткой в промытую дистиллированной водой мерную колбу. Пипетку перед применением следует также промыть дистиллированной водой.
· А затем, раствором «№ 1», заполняя и опорожняя не менее 2-х раз. После внесения аликвоты стандарта, колбу доливают водой до 50 мл, а затем переливают ее содержимое во второй сухой измерительный стакан с «№ 2».
· ТРЕТИЙ РАСТВОР С «№ 3» получают аналогичным образом из второго градуировочного раствора.
Измерения начинают с раствора нитрата наименьшей концентрации, с раствора «№ 3».
· В режиме градуировки заносят в память прибора значение pNO3=4,00 этого раствора.
· Ополаскивают электроды водой из промывалки, осушают электроды кусочком фильтровальной бумаги.
· Погружают электроды в раствор и дополнительно перемешивают его круговыми движениями стакана.
· Электроды не должны касаться стенок сосуда и должны быть погружены в раствор не менее чем на 1 см.
· Производят измерения потенциала раствора в соответствии и инструкцией по градуированию иономера.
· Равновесный потенциал обычно устанавливается через 2 мин. Время выдержки до достижения равновесия можно задать с помощью встроенного в приборе таймера.
· Удаляют стакан, промывают электроды водой из промывалки, осушают их фильтровальной бумагой.
· Аналогичные процедуры выполняют с остальными стандартными растворами.
· Переходят, с помощью клавиатурных команд, в позицию занесения в память прибора значения pNO3=3,02 раствора «№ 2».
· Погружают электроды во второй раствор, перемешивают раствор круговыми движениями стакана и измеряют его потенциал.
· Удаляют стакан, промывают электроды водой из промывалки, осушают их фильтровальной бумагой.
· Заносят pNO3=2,04 и измеряют потенциал для градуировочного раствора «№ 1». Полученное при этом значение коэффициента наклона градуировки также записывают в лабораторный журнал.
· Одновременно считывают с дисплея температуру в лаборатории. Датчик температуры должен быть подключен к прибору, но погружать датчик в раствор не нужно.
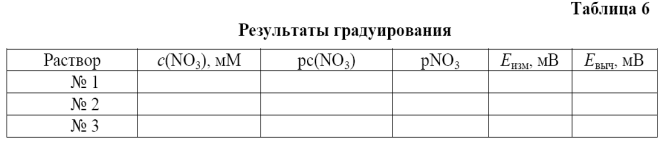
o Для тестирования, заложенного в приборе алгоритма вычислений, результаты градуирования записывают в табл. 6, а затем обрабатывают «вручную» по линейному методу наименьших квадратов (МНК).
o Найденный в автоматическом режиме градуирования коэффициент наклона сравнивают с МНК-оценкой при ручных вычислениях, а также с теоретическим значением коэффициента в уравнении (2.1) и паспортными данными для электрода ЭЛИС-121 NO3.
o Полученное по МНК уравнение линейной регрессии используют для вычислений Е выч. Затем по данным табл. 6 на миллиметровой бумаге строят график в координатах (pNO3, E). При этом точки, соответствующие Е изм изображают значками, а точки, соответствующие Е выч соединяют прямой.
ОПРЕДЕЛЕНИЕ ПРЕДЕЛА ОБНАРУЖЕНИЯ НИТРАТА В ЕГО ВОДНОМ РАСТВОРЕ.
· Тщательно промытые электроды погружают в дистиллированную воду.
· Измеряют потенциал, а также pNO3 дистиллированной воды. При этом заменяют воду в измерительном стакане несколько раз.
· Повторные измерения прекращают, когда разность двух последних измерений pNO3 не будет превышать 0,02 логарифмические единицы.
· Последнее значение pNO3 принимают за окончательный результат определения показателя предела обнаружения.
· Справедливость этого предложения следует доказать с использованием уравнения (2.2).
· Другой способ доказательства (чисто эмпирический) состоит в том, что измеренное значение потенциала фона заносят на построенный ранее график электродной функции и определяют предел обнаружении графически как это показано на рис. 3.
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА СЕЛЕКТИВНОСТИ ЭЛЕКТРОДА ОТНОСИТЕЛЬНО ХЛОРИД-ИОНА.
· Коэффициент селективности определяют по методу раздельных растворов.
· В измерительный стакан помещают 30-40 мл 0,1 моль/л раствора хлорида калия.
· Погружают в раствор промытые дистиллированной водой и осушенные фильтровальной бумагой электроды.
· Измеряют потенциал E (Cl) и записывают его значение в лабораторном журнале.
· Нажимают клавишу ВЫХОД.
· Опорожняют и тщательно ополаскивают измерительный стакан.
· Готовят электроды для измерений с 0,1 моль/л раствором нитрата калия.
· Заполняют стакан 30–40 мл раствора KNO3.
· Переходят в режим измерений, измеряют и записывают в лабораторном журнале значение потенциала E (NO3).
· Коэффициент потенциометрической селективности k (NO3/Cl) вычисляют по уравнению (2.4).
· При этом используют коэффициент крутизны электродной функции, найденный при градуировании иономера.
· Сравнивают полученное значение коэффициента со значением k (NO3/Cl) =5·10–3, записанным в паспорте электрода.
ОПРЕДЕЛЕНИЕ НИТРАТА МЕТОДОМ ДОБАВКИ ПРИ ИЗВЕСТНОЙ КРУТИЗНЕ ЭЛЕКТРОДНОЙ ФУНКЦИИ.
Метод добавок применяют в случаях, когда определяемое вещество содержится в образцах со сложной или изменяющейся от образца к образцу матрицей. В таких случаях метод градуировочного графика становится малоэффективным.
· Алгоритм метода одной добавки заключается в том, что в потенциометрическую ячейку отмеряют V мл анализируемого раствора и измеряют его потенциал Е 1.
· Затем в ячейку добавляют V st, мл стандартного раствора аналита с концентрацией cst.
· После чего измеряют потенциал раствора с добавкой Е 2. Результат анализа вычисляют по формуле:
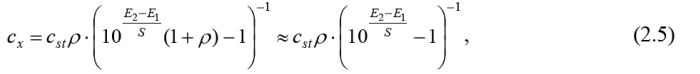
где = V st/ V, S – известный из паспорта электрода или установленный при градуировании коэффициент крутизны электродной функции. Нужно иметь в виду, что метод добавок дает правильные результаты только на линейном участке электродной функции, поскольку расчетную формулу метода получают с использованием уравнения (2.3).
Распространенными объектами анализа нитратов с pNO3-электродом является растительное сырье и продукты питания.
· Твердые образцы овощей или продуктов истирают на тёрке в чашку Петри.
· Навеску 10 г переносят в стакан вместимостью 100 мл.
· Заливают 50 мл квасцов и помещают на магнитную мешалку.
· Смесь в стакане выдерживают 30 мин при перемешивании.
· Затем пробу количественно переносят в мерную колбу вместимостью 100 мл и доводят объем до метки раствором квасцов.
· В измерительный стакан отмеряют цилиндром 50 мл анализируемого раствора.
· Погружают в раствор электродную пару.
· Переводят прибор в режим измерений.
· Записывают в лабораторном журнале измеренный потенциал Е 1.
· Добавляют в стакан капельной пипеткой одну каплю 0,1 М стандартного раствора нитрата.
· Перемешивают раствор в стакане его круговыми движениями.
· Измеряют равновесный потенциал раствора с добавкой Е 2. Если разность | Е 2 – Е 1| не превышает 20 мВ, то продолжают внесение добавки и измерения потенциала Е 2.
· Для расчетов по уравнению (2.4) используют значение | Е 2 – Е 1| 20 мВ, а также измеренный при этом объём добавки V st. = nV к, равный произведению числа капель n на объём капли V к. Объём капли предварительно устанавливают гравиметрическим методом.
· Для установления объёма капли помещают на чашку весов сухой бюкс, компенсируют вес тары, добавляют из капельницы 10 капель стандартного раствора и записывают в лабораторном журнале показание весов m. Объем капли, в среднем, вычисляют по формуле: V к = 0,1 m.
· Результат вычисляют по формуле: с (мг/кг) = 104 M (NO3) сx = 6,2·104 сx, то есть в миллиграммах нитрата в одном килограмме образца для анализа (мгNO3/кг).
· При анализе напитков и соков отмеренный объем 10–20 мл образца для анализа обрабатывают 1 %-ным раствором квасцов. В остальном ход анализа и обработка его результатов не отличается от анализа твердых продуктов.
· Результат анализа выражают в единицах мгNO3/л. Расчетная формула – с (мг/л) = 104 M (NO3) сx = 6,2·104 сx.






