Липиды - это разнообразные по химическому строению вещества, характеризующиеся различной растворимостью в органических растворителях, не растворимы в воде. В зависимости от химического состава липиды подразделяют на несколько классов:
1) Простые липиды – триглицериды, эфиры трехатомного спирта глицерина и высших жирных кислот;
2) Сложные липиды – фосфолипиды, гликолипиды,стерины,стероиды.
Таблица 1. Классификация липидов.



 Липиды
Липиды
Простые липиды Сложные липиды
 |  | ||




 Жиры Воска Фосфолипиды Гликолипиды Стероиды
Жиры Воска Фосфолипиды Гликолипиды Стероиды
(глицериды) (холестерин)
Цереброзиды Сульфатиды Ганглиозиды




 Глицерофосфолипиды Сфинголипиды
Глицерофосфолипиды Сфинголипиды
Фосфатизилхолины Ацетальфосфатиды Фосфатидилинозиты
Фосфатидил Фосфатидилсерины
этаноламины
Функции липидов:
1) Триглицериды выполняют функцию резервного энергетического материала. Липиды пищи представлены в основном – жирами;
2) Фосфолипиды и гликолипиды – важнейшие компоненты клеточных мембран;
3) Стероиды – наиболее распространенный представитель – холестерин. Он входит в состав клеточных мембран, а также служит предшественником желчных кислот, витаминов D3, стероидных гормонов;
4) Жиры способствуют всасыванию жирорастворимых витаминов А,D, В, К;
5) Простагландины – производные жирных кислот, они выполняют регуляторные функции.
Липиды являются обязательной составной частью питания. Соотношение белковлипидов и углеводов в пищевом рационе человека 1: 1: 4.
В среднем должно поступать около 80г жира в сутки. Как же происходит переваривание жиров в ЖКТ?
Переваривание жиров в полости желудка играет важную роль лишь у детей грудного возраста; рН желудочного сока у детей-грудничков 5,0 что способствует перевариванию эмульгированного жира, молока желудочной липазой.
Переваривание жиров у взрослых людей происходит в верхних отделах тонкого кишечника, где есть условия для эмульгирования жиров.
После попадания пищи в двенадцатиперстную кишку происходит нейтрализация НСl желудочного сока бикарбонатами, содержащимися в панкреатическом и кишечном соках, одновременно происходит процесс эмульгирования под действием желчных кислот, которые являются продуктом обмена холестерина ¾ желчных кислот (жк), является парными (гликохолевал, таурохолевал).
Рис. 1. Желчные кислоты

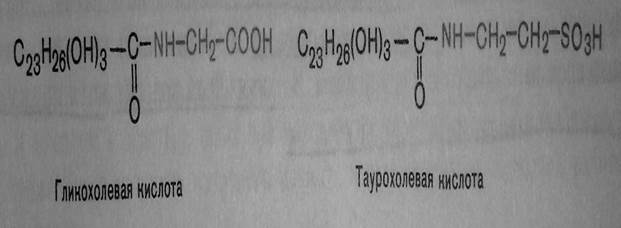
В желчи желчных кислот (Ж.К.) около 1% фосфолипидов – 0,5 %, холестерин – 0,5%, билирубин, минеральные соли.
Первые 3 из них образуют в пузырной желчи смешанные мицеллы. Они и желчные кислоты выполняют следующие функции: эмульгирование жиров, активация липазы, всасывание, перистальтика кишечника.
Большая часть желчных кислот из полости кишечника всасывается в клетки с кровью вороной вены, попадает в печень и повторно используется в образовании желчи.
Ж.К. проходят энтерогепатический круг 5-10 раз в сутки. Небольшая часть Ж.К. около 0,5 г за сутки выводится с калом. Эта убыль компенсируется синтезом в печени новых Ж.К. Фонд Ж.К. обновляется примерно за 10 дней.
Схема 1. Этапы переваривания и всасывания жиров. 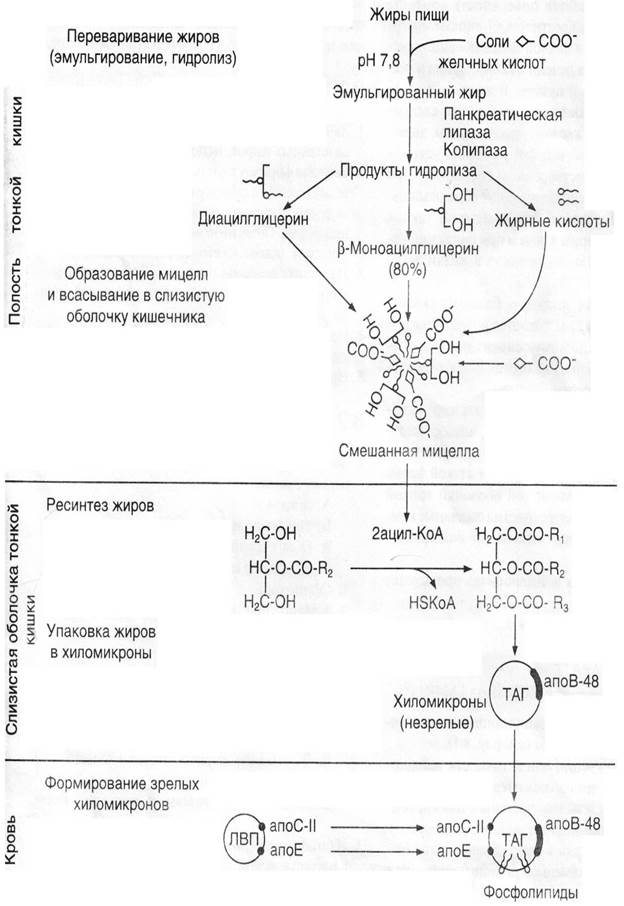

 О
О


 СН2О – C R 1 СН2ОН
СН2О – C R 1 СН2ОН
 O
O



 СН – O – C R 2 Панкр. липаза CHOH + R1COOH, + R2COOH, + R3COOH
СН – O – C R 2 Панкр. липаза CHOH + R1COOH, + R2COOH, + R3COOH

 O
O
 CH2O – C R3 CH2OH
CH2O – C R3 CH2OH
Триглицерид Глицерин Жирные кислоты
Таким образом, основными продуктами, образующимися в кишечнике при расщеплении пищевых жиров являются глицерин и жирные кислоты.
В стенке кишечника синтезируются жиры специфические для данного организма. В синтезе жиров принимают участие как экзогенные, так и эндогенные жирные кислоты. Механизм ресинтеза триглицеридов в клетках стенки кишечника сводится в общих чертах к следующему: первоначально из ЖК образуется активная форма – ацил-КоА, после чего происходит ацилирование моноглицеридов – затем образование ди- и триглицеридов.
Ресинтезированные в эпителиальных клетках кишечника триглицериды, фосфолипиды, а также поступивший в них из полости кишечника холестерин, соединяются с небольшим количеством белка – образуя ХМ – попадая в кровяное русло (алиментарная гипергликемия), ХМ – большие частицы и не способны проникать в клетки жировой ткани. Поэтому они под действием липопротеидлипазы расщепляются на глицерин и жирные кислоты на поверхности эндотелия кровеносных капилляров жировой ткани. Расщепление триглицеридов, ХМ в печени и в кровеносных капиллярах жировой ткани приводит к прекращению ХМ.
С током крови глицерин и ЖК попадают в печень и ткань, из них синтезируется в печени резервный жир, который под действием тканевых липаз расщепляется на глицерин и жирные кислоты.
В дальнейшем глицерин и жирные кислоты окисляются в тканях до СО2 и Н2О, а освободившаяся энергия в виде АТФ используется клетками.
Окисление глицерина.
Окисление глицерина в клетках протекает при участии АТФ:

 О
О



 СН2ОН СН2ОН С
СН2ОН СН2ОН С
Н




 СНОН + АТФ фосфоглицерат киназы СНОН + НАД дегидр-за СНОН + НАДН+ + Н+
СНОН + АТФ фосфоглицерат киназы СНОН + НАД дегидр-за СНОН + НАДН+ + Н+
СН2ОН СН2ОРО3Н2
Глицерин АДФ 3-фосфоглицерин Фосфоглицериновый
альдегид
Образовавшийся фосфоглицериновый альдегид является промежуточным продуктом окисления, как глицерина, так и углеводов. Расщепление его происходит по пути гликолиза до ПВК. Образовавшаяся ПВК в форме ацетил-КоА вовлекается в ЦГК и окисляется до СО2 и Н2О.
Окисление насыщенных жирных кислот.
Окисление жирных кислот происходит иначе. Теория В-окисления высших жирных кислот, высказанная в 1904 году впервые Кноопом с четным числом «С» атомов полностью оправдалась. Происходит отщепление в В-положении сразу 2-х атомов «С» в форме ацетата.
Окисление жирных кислот протекает в митохондриях, так как в них находятся все ферменты В-окисления. Внутренняя мембрана митохондрий непроницаема для жирных кислот, их перенос происходит при участии карнитина. При действии на карнитин ацилтрансферазы I к спиртовой группе карнитина присоединяется жирная кислота с образованием ацилкарнитина.
Во внутренней мембране находится фермент карнитин-ацилтрансфераза II, который превращает ацилкарнитин в ацил-КоА и карнитин.
При В-окислении окисляется группа СН2 в В-положении жирной кислоты. Многократное повторение этого процесса приводит к полному распаду жирной кислоты до ацетил-КоА. Ацетильный остаток окисляется в ЦГК.
За счет окисления 8 моль ацетил-КоА, образующихся из пальметиновой кислоты может синтезироваться 96 моль АТФ, а полный выход АТФ – 131 моль, а глюкозы – 38 моль.
Таким образом, энергетическая емкость жирных кислот существенно больше, чем глюкозы. Использование жирных кислот путем В-окисления происходит во многих тканях.
Особенно значительна роль этого источника энергии в скелетных мышцах при длительной физической работе и в сердечной мышце. Около 70% кислорода, поглощаемого сердечной мышцей, используется для окисления жирных кислот. Нервная ткань не использует жирные кислоты как источник энергии.
Синтез жирных кислот.
По сравнению с В-окислением биосинтез жирных кислот имеет ряд характерных особенностей. Синтез жирных кислот в основном осуществляется в цитозоле клетки, а окисление – в митохондриях.
Участие в процессе биосинтеза жирных кислот малонил-КоА, который образуется путем связывания СО2 с ацетил-КоА.
На всех этапах синтеза жирных кислот принимает участие ацилпереносящий белок (АПБ) и кофермент НАДФН+ - Н+.
Процесс синтеза жирных кислот был детально изучен на Е. Сoli и в общих чертах сходен с таковым у высших организмов. Мультиферментный комплекс, именуемый синтетазой высших жирных кислот, состоит из 6 ферментов, связанных с АПБ. Этот белок относительно термостабилен вовлекается в процесс синтеза (В.Ж.К.) практически на всех его этапах.
Таблица 3. Синтез жирных кислот.



 АПБ + СО2
АПБ + СО2



 Ацетил-КоА Ацетил-АПБ Ацетоацетил-АПБ
Ацетил-КоА Ацетил-АПБ Ацетоацетил-АПБ




 НАДН++Н+
НАДН++Н+
 Малонил-КоА Малонил-АПБ β-Гидроксибутирил-АПБ
Малонил-КоА Малонил-АПБ β-Гидроксибутирил-АПБ

 Кротонил-АПБ
Кротонил-АПБ

Бутирил-АПБ
Далее цикл повторяется. Допустим, идет синтез пальмитиновой кислоты (С16). В этом случае образованием бутирил-АПБ завершается лишь первый из семи циклов, в каждом из которых началом является присоединение молекулы малонил-АПБ к карбоксильному концу растущей цепи жирной кислоты.
Затем цикл повторяется снова. После семи оборотов цикла получается пальмитил-Е. При участии пальмитилдеацилазы пальмитил-Е гидролитически распадается на пальмитиновую кислоту и фермент (Е).
Пальмитат – это основной продукт действия пальмитилсинтетазы, однако в небольших количествах образуются и другие жирные кислоты с более короткой или более длинной углеродной цепью.
Удлинение углеродной цепи происходит за счет дополнительного присоединения ацетил-КоА или малонил-КоА при помощи ферментов, имеющихся в цитозоле. Таким путем образуются жирные кислоты с более длинной цепью – до 24 углеродных атомов.
Ненасыщенные жирные кислоты образуются из насыщенных при участии ферментов десатураз в этих реакциях используется D2 и восст. НАД.
Линолевая, линоленовая, арахидоновые жирные кислоты не синтезируются в организме и должны поступать с пищей. Их объединяют под названием «Витамины F».
Биосинтез триглицеридов.
Биосинтез триглицеридов осуществляется во всех тканях при наличии глицерина и жирных кислот. Глицерин в тканях может возникнуть при восстановлении триозофосфатов – продуктов распада углеводов. Это обстоятельство является доказательством того, что между обменом углеводов и липидов имеется тесная связь.

 О
О




 СН2ОН АДФ СН2ОН R1 – Co SКоА 2НSKoA
СН2ОН АДФ СН2ОН R1 – Co SКоА 2НSKoA





 СНОН +АТФ СНОН + О Глицерофосфат
СНОН +АТФ СНОН + О Глицерофосфат
 СН2ОН Глицерол киназа СН2О-РО3Н2 R2 – С SКоА Ацилтрансфераза
СН2ОН Глицерол киназа СН2О-РО3Н2 R2 – С SКоА Ацилтрансфераза
Глицерин Глицерофосфат Жирные кислоты





 О О О
О О О




 СН2О – С – R1 CН2О – С – R1 O CН2О – C – R1
СН2О – С – R1 CН2О – С – R1 O CН2О – C – R1





 О Н3РО4 О R3-Co SKoA О
О Н3РО4 О R3-Co SKoA О




 CНО – С – R2 Фосфатидат СНО – С – R2 Диглицерид CНО – С – R2
CНО – С – R2 Фосфатидат СНО – С – R2 Диглицерид CНО – С – R2

 Фосфатаза Ацилтрансфераза О
Фосфатаза Ацилтрансфераза О
CН2О – РО3Н2 СН2ОН СН2О – С – R3
Фосфатидная Диглицерид Триглицерид
кислота
Фосфатидная кислота при взаимодействии с холином, серином, ноламином может давать соответствующие фосфатиды.
Фосфатидная кислота является предшественником в биосинтезе как глицеридов, так и фосфатидов; все зависит от потребности клеток в данный отрезок времени. Фосфатидная кислота под влиянием фермента фосфогидролазы теряет фосфорную кислоту и превращается в соответствующий диглицерид, который в дальнейшем может взаимодействовать с молекулой жирной кислоты и превратиться в триглицерид.
Регуляция обмена липидов.
Начнем с регуляции синтеза и мобилизации жиров. Какой процесс будет преобладать синтез или распад будет зависеть от поступления с пищей жиров и физической активности. В адсорбтивном состоянии под действием инсулина происходит синтез жиров в постадсорбтивном состоянии. Распад жиров активируется глюкагоном и адреналином.
Регуляция синтеза жиров.
В адсорбтивный период при увеличении соотношения инсулин/глюкагон в печени активируется синтез жиров. В жировой ткани индуцируется синтез ЛП-липазы в адипоцитах и осуществляется ее экспонирование на поверхность эндотелия, следовательно, в этот период увеличивается поступление жирных кислот в адипоцитах. Одновременно инсулин активирует белки переносчики глюкозы ГЛЮТ-4. Поступление глюкозы в адипоциты и гликолиз также активирует эти белки. В результате образуются все необходимые компоненты для синтеза жиров: глицерол-3-фосфат и активные формы жирных кислот. В печени инсулин, действуя через различные механизмы, активирует ферменты путем дефосфорилирования, индуцирует их синтез. В результате увеличиваются активность и синтез ферментов, участвующих в превращении части глюкозы, поступающей с пищей, в жиры. Это – регуляторные ферменты гликолиза – пируват-дегидрогеназный комплекс и ферменты, участвующие в синтезе жирных кислот из ацетил КоА. Результат действия инсулина на обмен углеводов и жиров в печени – увеличение синтеза жиров и секреция их в кровь в составе ЛПОНП. Они доставляют жиры в капилляры жировой ткани, где действие ЛП-липазы обеспечивает быстрое поступление жирных кислот в адипоциты, где они депонируются в составе триацилглицеринов.
Запасание жиров в жировой ткани – основная форма депонирования источников энергии в организме человека массой 70 кг составляет 10 кг. У некоторых и больше – энергия депонированных жиров составляет около 110 тыс. ккал.
Регуляция мобилизации жиров.
Мобилизация депонированных жиров стимулируется глюкагоном и адреналином. В постадсорбтивный период и при голодании глюкагон, действуя на адипоциты через аденилатциклазную систему (АЦС), активирует протеинкиназу А, которая фосфорилирует Н, таким образом, активирует гормончувствительную липазу, что инициирует липолиз и выделение жирных кислот и глицерина в кровь (вспомните каскадный механизм внутриклеточного липолиза).
При физической нагрузке увеличивается секреция адреналина, который действует через В-адренергические рецепторы адипоцитов. В настоящее время обнаружено 3 типа В-рецепторов: В1В2В3, активация которых приводит к липолитическому действию.
К наибольшему липолитическому действию приводит активация В3-рецепторов. Адреналин одновременно действует на α2-рецепторы адипоцитов, связанные с ингибирующим G-белком.
Вероятно, действие адреналина двоякое: при низких концентрациях в крови преобладает его антилиполитическое действие через α2-рецепторы, а при высокой – преобладание липолитическое действие через В-рецепторы.
Для мышц, сердца, почек, печени при голодании или физической работе жирные кислоты становятся важным источником энергии. Печень перерабатывает часть жирных кислот в кетоновые тела, используемые мозгом, нервной тканью и некоторыми другими тканями как источник энергии.
Итак, в результате мобилизации жиров, концентрация жирных кислот в крови увеличивается приблизительно в 2 раза. Когда постадсорбтивный период сменяется адсорбтивным, инсулин активирует специфическую фосфатазу, которая дефосфорилирует гормончувствительную липазу и распад жиров останавливается.
Регуляция скорости В-окисления жирных кислот.
В-окисление – метаболический путь, прочно связанный с работой ЦПЭ и общего пути катаболизма. Поэтому его скорость регулируется потребностью клетки в энергии, то есть соотношение АТФ/АДФ и НАДН2/НАД также как и скорость реакций ЦПЭ и общего пути катаболизма.
Скорость В-окисления в тканях зависит от доступности жирных кислот, поступающих в митохондрии. Концентрация свободных жирных кислот в крови повышается при активации липолиза в жировой ткани, при голодании под действием гликогена, при физической нагрузке под действием адреналина.
В этих условиях жирные кислоты становятся преимущественным источником энергии для мышц и печени, так как в результате В-окисления образуется НАДН- и ацетил-КоА, ингибирующие пируват-дегидрогеназный комплекс. Превращение пирувата, образующегося из глюкозы в ацетил-КоА замедляется.
Накапливаются промежуточные метаболиты гликолиза и, в частности, глюкозо-6-фосфат. Он ингибирует гексокиназу и, следовательно, препятствует использованию глюкозы в процессе гликолиза. Таким образом, «сберегается» глюкоза для нервной ткани и эритроцитов.
Скорость В-окисления зависит также от активности фермента карнитинацилтрансферазы I. В печени этот фермент ингибируется малонил-КоА, веществом, образующимся при биосинтезе жирных кислот.






