Ферменты, строение, свойства, механизм действия.
Ферменты или энзимы – это вещества белковой природы, участвующие в разнообразных химических превращениях. Теоретические и практические достижения энзимологии занимают ведущее место в решении проблем молекулярной биологии и медицины.
И.П. Павлов считал ферменты «возбудителями всех химических превращений» у живых существ. А Ю.И. Менделеев предположил, что «вся тайна животной жизни заключается в непрерывных химических превращениях веществ, входящих в состав животных тканей».
Учение о ферментах выделено в самостоятельную науку – энзимологию. Термин «энзим» (от греч. en zyme – в дрожжах), так же как и «фермент» (от лат. fermentatio – брожение), означает процесс, связанный с выделением газов, брожением.
«Современная биология говорит на языке энзимологии», – это слова нашего отечественного биохимика А.Е. Браунштейна.
В настоящее время наука о ферментах интенсивно развивается в тесной связи с другими науками – органической, неорганической, физической химией, физиологией, ферментологией и др. Таким образом, энзимология находится на стыке химических, биологических и медицинских наук.
Изучение ферментов имеет большое значение для фундаментальной и прикладной биологии, а также для практических отраслей химической, пищевой и фармацевтической индустрии (для изготовления катализаторов, антибиотиков, витаминов и др. биологически активных веществ, используемых в народном хозяйстве, медицине). Успехи общей и молекулярной энзимологии способствует развитию новой ветви – медицинской энзимологии.
По строению ферменты могут быть простыми (протеины) и сложными (протеиды). Отличие от белков!
Молекулы простых ферментов при гидролизе расщепляются до аминокислот. По химическим свойствам простые ферменты относятся к альбуминам (эстераза печени), глобулинам (трипсин и уреаза). Простыми ферментами являются также многие гидролазы пищеварительного тракта, РНК-аза, ДНК- аза и другие.
Большинство ферментов являются сложными белками.
«Белковая часть» – Апофермент
Фермент Холефермент
«Простетическая группа», «Кофермент» – Коэнзим
(прочно связана) (непрочно связан)
Непосредственное участие в химической реакции, катализируемой ферментом, принимает не белок, а кофермент. Белок же определяет специфичность реакции на этапе фиксации субстрата (субстрат – вещество, на которое действует фермент).
Апофермент влияет на характер реакции. Пример: ферменты трансаминаза и декарбоксилаза, кофермент Витамина В6, и от того какова будет белковая часть будут происходить либо 1-ая реакция, либо 2-ая.
Связь между апоферментом и коферментом в молекуле различных ферментов неодинакова. Часто кодермент непрочно связан с апоферментом и соединяется с ним во время каталитического акта (дегидрогеназы, коферменты ФАД, НАД).
Во многих ферментах (Ф) кофактор прочно связан с апоферментом (каталаза, пероксидаза), где активным центром выступает Fe++ в составе гема. Ферменты эти часто называют металлоферменты (они переводят фермент в активное состояние, а сами не принимают участие в каталитическом акте).
Коферменты обычно являются термостабильными органическими соединениями, в состав их так входят ионы металлов (металлоферменты), витамины – В6-трансаминазы, декарбоксилазы, каталазы, пероксидазы, цитохромы, нуклеотиды коф. НАД, ФАД, где в составе активного центра соответственно присутствуют Витамины РР и В2 (вещество, на которое действует Ф).
В реакцию с субстратом вступает не вся молекула (Ф.), а лишь небольшой участок, получивший название – активного центра.
Та область ферментативной молекулы, в которой происходит связывание и превращение субстрата, называется активным центром. Активный центр образуется боковыми радикалами аминокислотных остатков полипептидной цепи, а 2-х компонентных ферментах, в него входят некоторые группировки небелковой части ферментов, имеющие 4-ю структуру. Число активных центров часто совпадает с числом субъединиц. Активный центр неоднороден. В нем выделяется несколько зон – каталитическую зону непосредственно вступающую в химическое взаимодействие с субстратом и зону связывания, которая обеспечивает специфичное сродство к субстрату.
Пример: активный центр химотрипсина, в состав входят остатки гистидина и серина.
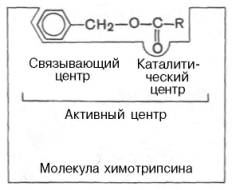 Рис. 1
Рис. 1
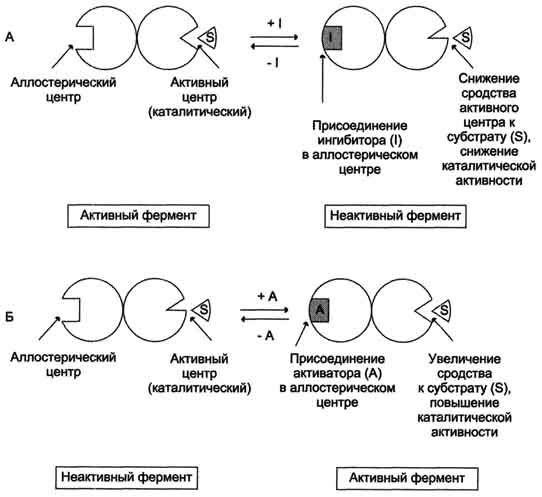
Аллостерический центр или иной – участок молекулы фермента, возникший в результате присоединения к нему определенного низкомолекулярного вещества, при этом изменяется третичная структура фермента.
Схема действия ингибитора, вызывающего аллостерический эффект.
Для того, чтобы изучить структуру и свойства ферментов, механизм их действия, для этого их надо выделить.
Выделяют ферменты из растворов при помощи высаливания, (NH4)2 SO4, NaCl, ацетоном, спиртом, электрофорезом, хроматографией и т.д.
Одни ферменты из клетки легко извлекаются растворителями, другие – труднее, так как прочно связаны с клеточной структурой. Иногда для разрушения клеточной структуры пользуются ультразвуком.
В настоящее время широко применяется метод выделения ферментов из различных структур: ядер, митохондрий, лизосом и плазмы путем дифференциального центрифугирования (10 – 100 тыс. об/мин). Методом рентгеноструктурного анализа, ЯМР (ядерно-магнитного резонанса), ЭПР (электронно-парамангитного резонанса).
В настоящее время получено более 2000 ферментов в чистом виде и более 200 в кристаллическом виде.
Сходства и различия между ферментами и неорганическими катализаторами.
Сходства:
Различия:
1. И те и другие не расходуются в ходе химической реакции;
2. Способны вызвать термодинамическую реакцию;
3. Как те, так и другие ускоряют прямую и обратные реакции;
4. Действуют в малых концентрациях;
5. Некоторые неорганические и почти все биологические катализаторы чувствительны к действию ингибиторов.
1. Ферменты действуют при определенных t, pH среды, давлении, а неорганические катализаторы действуют при высоких t, pH среды и давлении;
2. В отличие от неорганических катализаторов проявляют высокую специфичность (абсолютная, относительная, стереохимическая);
3. Биологические катализаторы в организме образуются в виде проферментов (пепсин, трипсин и т.д.).
Чем отличаются ферменты от неорганических катализаторов уже было указано выше. А вот от белков ферменты отличаются наличием активного центра, поэтому способны катализировать реакции.
Свойства ферментов:
1. Специфичность ферментов. Каждый фермент действует на вполне определенный субстрат или же определенный тип связи в молекуле.
Специфичность бывает:
a) Абсолютная специфичность фермента – это, когда данный фермент действует только строго на определенный субстрат.
NH2 – CО – NH2 Уреаза 2NH3 + CO2
Есть ферменты и более широкого спектра действия (пепсин, трипсин, липаза).
b) Относительная специфичность – это, когда фермент действует на группу сходных по своей структуре веществ или определенный тип связи.
c) Стереохимическая специфичность – это, когда фермент действует либо на D или L аминокислоты или на транс- или цис-изомеры. Так фумараза действует только на транс-форму фумаровой кислоты и не действует на цис-форму.
2. Термолабильность – связана с белковой природой ферментов. Оптимум действия ферментов лежит в интервале t тела (37-40°). Высокая температура действует на ферменты разрушающе, низкая замедляет ферментативный процесс (лабораторная работа).
3. Высокая чувствительность к рH среды. Оптимум активности для многих ферментов наблюдается в изоточке. Только пепсин при рН 1,5 – 2 и амилаза поджелудочного сока – рН 8.
Механизм действия ферментов:
Как установлено, при химических процессах не все молекулы реагирующих веществ являются реакционноспособными. Иначе, в реакцию могут вступать лишь те молекулы, запас энергии которых превышает энергетический барьер данной реакции. Число реакционноспособных молекул, а, следовательно, скорость реакции должна быть тем больше, чем ниже энергетический барьер реакции (т.е. тот минимальный запас энергии в молекулах, при котором они становятся реакционноспособными).
Энергия, которую надо сообщить молекулам с тем, чтобы между ними произошла реакция, называется энергией активации.
Высокая скорость реакции в клетке обеспечивается путем снижения уровня энергии активации.
В активный центр химотрипсина входят остатки 3-х аминокислот: аспарагина в 102 положении, гистидина – в 57 положении, серина – 195 положении. Следовательно, каталитический и субстратносвязывающий центры оказываются на разных участках полипептидной цепи.
Жесткая структура активного центра всегда комплементарна молекулярной структуре субстрата, что позволяет проявлять свою высокую специфичность.
Образование фермент-субстратного комплекса протекает быстро и также быстро распадается.

непродолжительное время
И поэтому долгое время не могли доказать существование фермент-субстратного комплекса. Прямые доказательства существования ф/с комплекса были получены в лабораториях Д. Кейлина и Б. Чанса. В настоящее время экспериментальные и математические методы кинетики, термодинамики и статистической механики химических реакций позволяют определять для ряда ферментативных реакций константы диссоциации.
Известно, что многие белки или ферменты синтезируются в неактивной форме – это пробелки. Когда эти неактивные белки являются ферментами их называют проферментами. В основе превращения профермента в фермент лежит механизм избирательного протеолиза.
У разных проферментов процесс избирательного протеолиза может протекать в одну или несколько стадий. К таким ферментам относятся – пепсин, трипсин, химотрипсин, гормоны – инсулин. Белок коллаген синтезируется в виде проколлагена, затем происходит гидроксилирование пролина и лизина и белок может выполнять свои функции.
Выработка пищеварительных ферментов в неактивной форме имеет защитное значение. Если бы они вырабатывались в активной форме произошел бы процесс самопроизвольного переваривания.
Основой механизма избирательного протеолиза является изменение конформации фермента и формирование каталитического центра.
У сложных ферментов механизм действия иной, так как в качестве активного центра выступают различные коферменты. Т.о. образуется 3-й комплекс между субстратом, апоферментом и коферментом.
У сложных ферментов белковая часть обеспечивает образование связующего центра, а кофермент входит в состав каталитического центра. Группа ферментов дегидрогеназ, коферментами являются НАД и ФАД, обеспечивают дыхательные функции (тканевое дыхание).
Следовательно, исходя из вышеизложенного единого механизма действия ферментов быть не может, но тем не менее для некоторых групп ферментов был предложен Эмилем Фишером механизм действия, который заключается в том, что фермент подходит к субстрату как «ключ к замку».
Теория Э. Фишера, ключ – замок.

В противоположность теории Э. Фишера «ключ-замок» Д. Кошлендом была разработана теория «индуцированного соответствия», допускающая высокую конформационную лабильность молекулы и белка – фермента, гибкость и подвижность активного центра. Эта теория была основана на убедительных экспериментах, свидетельствующих о том, что субстрат индуцирует конформационные изменения молекулы фермента таким образом, что активный центр принимает необходимую для связывания субстрата пространственную ориентацию (дома зарисовать схему).
Получены и другие экспериментальные данные о том, что теория Д. Кошленда создается не обязательно изменениями конформации белковой молекулы, но так же геометрической и электронно-топографической перестройкой молекулы субстрата.
Подобно другим катализаторам ферменты с термодинамической точки зрения, ускоряют химические реакции за счет снижения энергии активации.
Для понимания энергетики химической реакции необходимо учитывать изменение энергии в процессе данной химической реакции и роль ферментов в динамике этого процесса.
Изоферменты – это разновидности фермента, обладающие одной и той же субстратной специфичностью, но отличающиеся между собой некоторыми физико-химическими, каталитическими и иммунохимическими свойствами.
Молекулы изоферментов состоят из нескольких субъединиц, которые формируют их четвертичную структуру.
В настоящее время известно более 200 изоферментов, нескольких ферментов ЛДГ, фосфоглюкомутазы, альдолазы и др.
Наиболее изучены изоферменты ЛДГ. М. в ЛДГ – 140 тыс., её молекула состоит из 4-х субъединиц, которые делятся на (Н) – преобладает в миокарде и (М) – в скелетной мускулатуре. Известно 5 изоферментов ЛДГ состоящих из следующих субъединиц:
НННН НННМ ННММ НМММ ММММ
ЛДГ1 ЛДГ2 ЛДГ3 ЛДГ4 ЛДГ5
к аноду (+) промежуточное положение к катоду (-)
Фракции отличаются между собой биологической ролью. Так, анодные фракции осуществляют процесс превращения ПВК в аэробных условиях, а катодные фракции – в анаэробных условиях. Промежуточные фракции в аэробных и анаэробных условиях. Для каждой ткани характерен свой изоферментный спектр. Так в миокарде, мозгу, почках и эритроците преобладают ЛДГ1 и ЛДГ2, ЛДГ4 и ЛДГ5 – типичны для скелетной мускулатуры. Спектр их может меняться в различные периоды онтогенеза и патологии. Так, при нефритах в крови ЛДГ4 и ЛДГ5, при заболевании легких – ЛДГ3.
Появление изоферментов является важным процессом эволюционного совершенствования биокатализа. Это проявляется в улучшении направленности действия ферментов, сопряженности особенностей биокатализа с интенсивностью функций важных органов, и повышении тонкой специфичности действия фермента.
Таким образом, в механизме ферментативного катализа ведущую роль играют промежуточные фермент-субстратные комплексы, образование которых определяется как тонкой трехмерной структурой активного центра, так и уникальной структурной организацией всей молекулы фермента, обеспечивающей высокую каталитическую активность (за счет снижения энергии активации) и специфичностью действия фермента.
Поэтому без детального ознакомления со свойствами и механизмом действия ферментов невозможно понять процессы обмена веществ, которые мы рассмотрим позже.
А сейчас еще энзимодиагностику и рассмотрим энзимотерапию.
Энзимодиагностика.
Большинство исследований ферментов, которыми пользуются клинические лаборатории, производятся в сыворотке, моче, спинномозговой жидкости, слюне, реже в других биологических жидкостях.
Несмотря на то, что до сих пор физиологическое значение большинства ферментов плазмы неизвестно, исследование их активности приобрело значение для диагностики многих заболеваний.
Активность ферментов в плазме обычно невелика в сравнении с активностью тех же ферментов в тканях.
Активность ферментов в форменных элементах крови: в лейкоцитах и в эритроцитах обычно во много раз превышает активность ферментов в плазме или сыворотке.
При исследовании активности ферментов в плазме больных необходимо помнить, что некоторые лекарственные средства влияют на результаты определений. Так, салицилаты могут повышать активность трансаминазы плазмы крови. Антикоагулянты, прибавляемые к пробе крови – влияют на определение ферментативной активности; она зависит так же от времени, дня, пищи.
Определение активности ферментов в тканях производится главным образов в гомогенатах и тканевых срезах, значительно реже представляется возможным исследовать активность в изолированных одиночных клетках. За последние годы появилось много сообщений о ферментативных исследованиях, получаемых путем биопсии.
Энзимотерапия.
Попытки применения ферментов с терапевтической целью производились уже давно. Еще в VIII веке пытались ускорить заживление изъязвлений при помощи желудочного сока. Вскоре после того, как Шванн открыл пепсин, он был использован в 1834 году при лечении диспепсии, а затем применен для местного лечения гнойничков и трудно заживающих ран. К прошлому относятся и первые сообщения о терапевтическом применении других протеолитических ферментов – трипсина, химотрипсина и др. Только в последнем десятилетии ферментотерапия нашла более широкое применение. Несомненно, этому способствовали достижения биохимии в выделении и очистке ферментов, а так же в изучении условий их оптимального действия. Ферменты, как правило, применяются в качестве вспомогательных средств, чаще всего параллельно с другими лекарственными препаратами. Огромное большинство биохимических процессов происходит внутри клетки, куда экзогенно ферменты, как крупномолекулярные соединения, не имеют доступа. Это приводит к тому, что ферментотерапия имеет ограниченное применение.
Кроме заместительной терапии ферменты протеазы нашли применение для удаления некротических тканей, растворения скоплений фибрина в полостях тела и даже кровеносных сосудах.
Обнаружение в составе коферментов – витаминов, послужило основанием для витаминотерапии. В настоящее время,широко применяются большие дозы витаминов при различных заболеваниях, которые не связаны с их дефицитом.
С терапевтической целью используются так же антиметаболиты некоторых витаминов, т.е. антивитамины. Здесь, прежде всего, следует назвать антогонист витамина К – динумарол, а так же его производные, которые нашли применения в лечении внутрисосудистых тромбов. Аминоптерин – антогонист фолиевой кислоты, затрудняет синтез пуринов и пиримидиновых оснований, и таким образом тормозит развитие опухолевых клеток. В практике этот препарат имеет большое значение в лечении лейкозов.
Не так давно мы были свидетелями выдающегося успеха наших медиков, создавших под руководством академика Е.И. Чазова первый в мире иммобилизованный тромболитический фермент стрептодеказу. Иммобилизация ферментов происходит путем присоединения тем или иным способом к обычно нерастворимой полимерной матрице, например к целлюлозе, путем ковалентного связывания происходит инкапсулирование и включение в липосомы, обеспечивающие доставку ферментов к поврежденным органам.
В последнее время получен 2-й отечественный препарат тромболитического действия целиаза. Под его действием происходит растворение тромба, восстановление кровообращения с последующей нормализацией функций органов. Клинические испытания показали его высокую эффективность при лечении инфаркта миокарда, тромбоза магистральных сосудов конечностей.
Помимо отечественных препаратов, оказывающих тромболитическое действие известно много импортных.






