Комплемент – это сложный белковый комплекс, состоящий примерно из 20 белков, который активируется за счет каскадного процесса, когда продукт предыдущей реакции выполняет роль катализатора следующей.
Известно два пути активации комплемента:
классический
и альтернативный.
Активация комплемента по классическому пути осуществляется при агрегации молекул иммуноглобулина или при связывании иммуноглобулинов (АТ) с соответствующим АГ. Важным моментом в процессе активации является конфигурация молекулы иммуноглобулина, которая может изменяться в ходе реакции АГ-АТ или неспецифической агрегации молекул иммуноглобулинов между собой. Непосредственно в активацию комплемента вовлечен домен СН2 Fc-фрагмента молекулы иммуноглобулина. Одним из условий для реализации этого процесса является расположение двух Н-цепей на определенном расстоянии одна от другой. В молекуле IgM это условие обеспечивается за счет собственной конфигурации молекулы, а в реакциях с IgG такое взаиморасположение Н-цепей возникает с частотой 1:800, в связи с чем способность IgG к связыванию комплемента существенно ниже, чем у IgM.
На раннем этапе активации комплемента по классическому пути происходит активация С1. В присутствии Са2+ образуется тетрамер C1r2 -Ca2+-C1s2, который связывается с одной молекулой C1q (рис. 1).
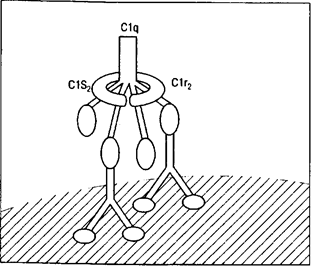
Рис. 1. Взаимодействие комплекса C1 (C1q, С1r2, C1s2) с двумя молекулами IgG, связавшими антиген
Комплекс С1 обладает протеазной активностью. Его естественными субстратами являются С2 и С4. В плазме присутствует также ингибитор этого фермента (C1-1nh).
На следующем этапе образуется активный С3-комплекс (С3-конвертаза). С4 состоит из трех полипептидных цепей (, и ), связанных между собой дисульфидными мостиками и нековалентными связями. Под действием C1s из 1-ой-цепи образуется С4а-фермент с молекулярной массой 6000. В то же время C1-эстераза превращает С4 в С4b-форму, способную связываться с поверхностью клетки. К связанному с клеткой С4b присоединяется С2а (продукт расщепления С2 под действием С1).
Активированный комплекс С4b-С2а представляет собой С3-конвертазу, способную расщеплять С3 на С3а и С3b. Мембраносвязанный С3b взаимодействует с С5 и становится субстратом для С3-конвертазы, которая расщепляет С5 на С5а и С5b, причем С5b остается связанным с мембраной.
С5b последовательно связывает С6, С7 и С8, образуя комплекс, способствующий пространственной ориентации двух или более молекул С9. Проникая внутрь липидного слоя и полимеризуясь, они образуют кольцеобразный мембраноатакующий комплекс (МАК). Он представляет собой трансмембранный канал, проницаемый для электронов и воды (рис. 2). За счет более высокого коллоидно-осмотического давления внутри клетки в нее начинают поступать Na+ и вода, в результате чего клетка набухает и лизируется.
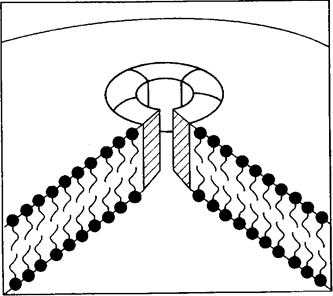
Рис. 2. Образование трансмембранного канала (мембраноатакующего комплекса) за счет полимеризации С9
Другие биологические функции системы комплемента. Помимо лизиса клеток, происходящего за счет встраивания в мембрану МАК, белки системы комплемента облегчают адгезию микроорганизмов на поверхности фагоцитирующей клетки. Это осуществляется с помощью рецепторов для СЗb, которые имеются на поверхности фагоцитов.
СЗа и С5а, образующиеся в процессе активации комплемента, могут действовать непосредственно на нейтрофилы и макрофаги, вызывая активизацию клеточного дыхания. Кроме того, они способствуют выбросу медиаторов воспаления из тучных клеток и циркулирующих в крови базофилов.
Белки острой фазы. В ответ на инфекцию, повреждение тканей и стресс в крови резко повышается концентрация ряда белков, получивших общее название белков острой фазы. К ним относятся6
- С-реактивный белок,
- сывороточный амилоидный А-белок,
- гликопротеин (орозомукоид),
- антитрипсин,
- макроглобулин,
фибриноген,
церулоплазмин,
С9-компонент комплемента
и фактор В.
Микробные эндотоксины стимулируют выработку интерлейкина-1 и фактора некроза опухолей, являющихся эндогенными пирогенами. Интерлейкин-1 стимулирует клетки печени к продукции повышенного количества С-реактивного белка, концентрация которого в плазме может повышаться в 1000 раз и более. Этот белок представляет собой замкнутый пентамер, способный связываться с теми микроорганизмами, в состав мембраны которых входит фосфорилхолин. Образовавшийся комплекс активирует систему комплемента по классическому пути, что приводит к связыванию С3b с поверхностью микроба, его опсонизации и фагоцитозу.
Молекула С9 содержит гидрофильный домен, который взаимодействует с комплексом С5b-8, и участок, обладающий выраженной гидрофобностью, за счет которого С9 взаимодействует с липидной мембраной.
Под влиянием комплекса С5b-8 происходит полимеризация нескольких молекул С9, после чего циркулирующий комплекс поли-С9 встраивается в двухслойную липидную мембрану, формируя сквозной белковый канал.






