1. ƒва мол€ кислорода очень медленно перевод€тс€ из состо€ни€ 1 в состо€ние 2. акое количество теплоты необходимо подвести к газу, если в координатах PV процесс изображаетс€ пр€мой линией? ¬ состо€нии 1 газ характеризуетс€ параметрами – = 1атм, V = 24,6л, T =300K, P = 3 P, V = 2 V.
2. ¬ычислить работу испарени€ 1 мол€ воды при переходе ее в пар при 1000— и нормальном давлении. ќпределить количество теплоты, сообщаемое при этом воде.
3. ¬ычислить работу, совершаемую за цикл перемагничивани€ единицы объема сердечника длинного соленоида, если известно, что площадь петли гистерезиса на диаграмме с ос€ми (H, J) равна S.
4. ѕоказать, что элементарна€ работа пол€ризации единицы объема диэлектрика равна dW=-(1/4π)E ЈdD, а работа пол€ризации в собственном смысле равна dWc=E ЈdP.
5. “ермическое и калорическое уравнени€ состо€ни€ идеального электронного газа св€заны соотношением PV = 2/3 E. Ќайти дл€ этого газа уравнение адиабаты в переменных P,V. ≈ Ц внутренн€€ энерги€ газа.
6. »деальный газ расшир€етс€ по закону р = aV. Ќайти графически работу, произведенную газом при увеличении объема от V 1 до V 2. ѕоглощаетс€ или выдел€етс€ тепло при таком процессе?
7. ¬оздух находитс€ в термически изолированной комнате объемом 27 м, в которой имеетс€ небольшое отверстие. „ерез него воздух может просачиватьс€ наружу, где давление равно 1 атм. акое количество тепла необходимо подвести в комнату, чтобы температура медленно увеличивалась от 0 до 20∞—? “еплоемкость воздуха можно считать посто€нной —р = 103 ƒж/(кг Х ), г = 1,41
8. Ќайти работу, совершаемую над молем идеального газа и количество тепла, получаемое им при сжатии от объема V 1 до объема V 2 в политропическом процессе pVn = const.
9. ћол€рна€ теплоемкость идеального газа при некотором процессе измен€етс€ по закону  , где
, где 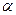 - посто€нна€ величина. Ќайти уравнение, св€зывающее параметры – и V в этом процессе.
- посто€нна€ величина. Ќайти уравнение, св€зывающее параметры – и V в этом процессе.
10. ¬ычислить разность Cр Ц Cv дл€ газа ¬ан-дер¬аальса.
11. ”равнение состо€ни€ некоторой термодинамической системы имеет вид – = ј“3, причем коэффициент пропорциональности ј зависит от объема, но не зависит от температуры. Ќайти ∂Cv/∂V в точке – = 105 ѕа, “ = 300 .
12. ѕроцессы PV≤ = const, P≤V = const, P/V = const €вл€ютс€ политропными PVⁿ = const с различными показател€ми политропы n. ¬ычислить соответствующие им теплоемкости.
13. Ќа плоскости с координатными ос€ми V и P через некоторую точку ј проведены изотерма “ и адиабата S идеального газа. ѕоказать, что политропные процессы DAD´ и ≈ј≈´ происход€т при отрицательной и положительной теплоемкости соответственно.
14. ћоль неидеального газа находитс€ в неограниченном сверху цилиндре, помещенном в однородное поле силы т€жести. ¬ычислить теплоемкость газа.
15. ќпределить теплоемкости идеального газа в следующих процессах: а) PV2 = const, б) P2V = const, в) P/V = const.
16. –аботу двигателей внутреннего сгорани€ можно моделировать циклом, состо€щим из адиабаты, изобары и изохоры. ќпределить теоретически ѕƒ такого двигател€, если известно, что отношение максимального и минимального объемов газа (степень сжати€) - n.
|
|
|
17. Ќайти ѕƒ двигател€ внутреннего сгорани€, работающего по циклу ƒизел€. Ќа участке 1 -2 Ц адиабатное сжатие атмосферного воздуха, 2 -3 изобарное расширение (впрыскивание горючей смеси и ее сгорание), 3 -4 адиабатное расширение, 4 -1 Цизохорное охлаждение. ѕараметрами цикла €вл€етс€ степень сжати€ е = V1 /V2 и степень предварительного расширени€ с = V1 /V2.
18. ¬ычислить энтропию газа ¬ан Ц дер Ц ¬альса и найти уравнение его адиабаты.
19. ѕоказать, что энтропи€ увеличиваетс€, когда, например, гор€ча€ вода отдает теплоту такой же массе холодной воды, и температуры их выравниваютс€.
20. »деальный газ с показателем адиабаты g совершает цикл, состо€щий из: изохоры, адиабаты и изотермы, причем изотермический процесс происходит при максимальной температуре цикла. Ќайти ѕƒ каждого цикла, если температура в его пределах измен€етс€ в n раз.
21. ∆елезо массой 200 г при температуре 100 ∞C опущено в калориметр, в котором находитс€ 300 г воды при температуре 12∞C. ѕренебрега€ теплоемкостью калориметра, найти изменение энтропии системы при выравнивании температур. ”дельна€ теплоемкость железа 500 ƒж/кг∙K.
22. Ќекоторое количество воды нагревают от 10 до 100 ∞C и дают ей полностью выкипеть. акой должна быть масса воды, чтобы ее энтропи€ в данном процессе изменилась на 3,61 кƒж/ (парообразованием при t <100∞ C пренебречь).
23. ћетодом циклов установить зависимость давлени€ насыщенного пара от температуры.
24. Ќайти термодинамические потенциалы F,‘, H дл€ мол€ одноатомного идеального газа.
25. ќпределить термодинамические потенциалы при независимых переменных (–, Ќ) и (“, F).
26. ѕоказать, что дл€ веществ, у которых объем линейно зависит то температуры “, теплоемкость —р не зависит от давлени€.
27. Ќайти уравнение адиабаты и уравнение состо€ни€ идеального газа, зна€ его энтальпию: H=CpЈP(g-1)/gЈexp ((s-s0)/ Cp).
28. ћетодом циклов найти зависимость Ёƒ— гальванического элемента от температуры.
29. ѕоказать, что дл€ веществ, у которых давление €вл€етс€ линейной функцией температуры “, теплоемкость —v не зависит от объема.
30. Ёнерги€ √иббса некоторой системы равна: ‘=а“(1-ln“)+RTlnP-TS0 , где a,R и S0 - const. Ќайти термическое и калорическое уравнени€ состо€ни€ этой системы.
31. Ќайти условие равновеси€ в системе, состо€щей из жидкости (1) и пара (2) при “ = const, V = cons t.
32. ѕоказать, что в системе с S = const и – = const равновесие наступает при минимуме энтальпии Ќ, а в системе с S = const и V = const - при минимальной внутренней энергии.
33. ќпределить услови€ равновеси€ двух фаз разных веществ, т.е. двухфазной двухкомпонентной системы, когда каждый компонент входит в состав только одной фазы.
34. ќпределить услови€ равновеси€ системы во внешнем силовом поле.
35. ƒл€ области температур, в которых удельный объем жидкости можно пренебречь по сравнению с удельным объемом пара, найти зависимость давлени€ насыщенного пара от температуры. ”дельную теплоту парообразовани€ считать не завис€щей от “.
36. »деальный газ находитс€ в адиабатно изолированном цилиндре с поршнем под посто€нным давлением. Ќепосредственно вычислив вариации энтропии дS и д≤S, показать, что при равновесии энтропи€ €вл€етс€ максимальной.
37. ѕоказать, что если в некотором состо€нии (∂T/∂S)р = 0, то дл€ устойчивости такого состо€ни€ должна одновременно обращатьс€ в нуль также и втора€ производна€, а (∂≥T/∂≥S)> 0.
|
|
|
38. Ќайти давление насыщенного пара, учитыва€ зависимость удельную теплоту перехода л от температуры.
39. Ќайти выражение дл€ скачка коэффициента теплового расширени€ Da=an-as и скачкаD = n- s модул€ упругости при сверхпровод€щем переходе.
40. ”становить св€зь между удельными теплотами плавлени€ л 23 (теплота перехода твердого тела 3 в жидкость 2), испарени€ жидкости л 12 и сублимации л13.
41. ѕод каким давлением вода будет кипеть при 950—? ”дельна€ теплота испарени€ воды равна 2258,4 ƒж/г.
42. Ќайти температурную зависимость теплоты фазового перехода dл / dT.
43. ќпределить коэффициент ƒжоул€-“омсонав критической точке.
¬опросы, выносимые на самосто€тельное изучение:
1. “ема: Ђ‘азовые переходы 2 родаї - “ермодинамика сверхпровод€щего перехода.
2. “ема: Ђ“ермодинамика диэлектриков и магнетиковї - ѕьезоэффект. ћагнитное (магнитокалорический эффект) и €дерное охлаждени€.
3. “ема: Ђ“ермодинамика излучени€ї - “ермическое и калорическое уравнение состо€ни€ и энтропи€ равновесного излучени€. “ермодинамические потенциалы и условие устойчивости равновесного излучени€.
4. “ема: Ђ“ермодинамика плазмыї - ¬нутренн€€ энерги€ плазмы. “ермическое уравнение состо€ни€ плазмы.
5. “ема: Ђ¬ариационные принципы термодинамики необратимых процессовї - ѕринцип минимума производства энтропии ѕригожина. ¬ариационный принцип ќнзагера. ”стойчивость стационарных состо€ний. ѕринцип Ће-Ўателье в неравновесной термодинамике.
¬опросы дл€ самоподготовки к практическим
ќсновные пон€ти€ и базовые принципы термодинамики
1. акими независимыми параметрами можно характеризовать состо€ние равно≠ весной термодинамической системы в отсутствие внешних полей?
2. ак прин€то называть соотношение, св€зывающее между собой значени€ термодинамических параметров вещест≠ва в состо€нии термодинамического равновеси€? акой вид имеет это соотношение дл€ идеального газа?
3. „то такое состо€ние термодинамического равновеси€?
4. „то такое эмпирическа€ абсолютна€ шкала температур?






