Основные сведения об ацетилене
Ацетилен С2Н2 первый член гомологического ряда непредельных углеводородов, имеющих в молекулах одну тройную связь. Состав выражают общей формулой СnН2n-2. Структурная формула ацетилена или CH ≡ CH.
Химические свойства
1. Реакции присоединения протекают ступенчато. Присоединяя водород (с катализатором), ацетилен превращается сначала в этилен, а затем в этан:
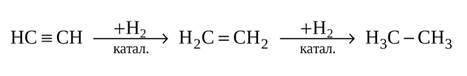
Бром присоединяется к ацетилену по месту тройной связи. При этом образуется соединение с четырьмя атомами брома в молекуле - 1,1,2,2-тетрабромэтан. Ацетилен обесцвечивает бромную воду и раствор марганцовокислого калия.
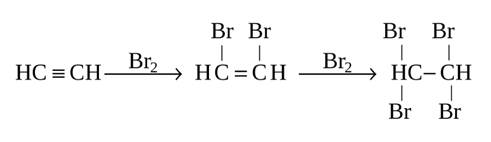
Присоединение органических кислот и спиртов:

2. Гидратация ацетилена проводится по реакции Кучерова. Действие воды на ацетилен в присутствии солей окиси ртути в качестве катализатора, получается уксусный альдегид CH 3 COH:
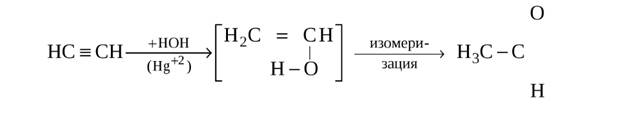
3.Окисление:
а) Горит ацетилен, образуя пламя с температурой около 3000ºС:
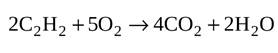
б) Сильные окислители расщепляют тройную связь ацетилена с образование карбоновых кислот:
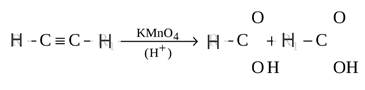
4.Реакции полимеризации. При взаимодействии ацетилена с хлористым водородом в присутствии катализатора приводит к образованию хлористого винила, называемого хлорвинилом CH2 = CHCl:

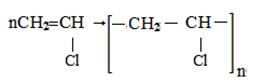
Хлористый винил – бесцветный газ под действием света при нагревании, превращается в полихлорвинил. Полихлорвинил используется как изоляционный материал, для изготовления искусственной кожи, клеёнки, плащей.
Физические свойства
Ацетилен – бесцветный газ, очень ядовит. Смесь его с воздухом при поджигании сильно взрывает. Когда газы находятся в сжатом виде, особенно в жидком состоянии, взрыв происходит даже от слабого толка. Ацетилен хранят и перевозят в виде раствора в ацетоне.



На воздухе горит коптящим пламенем. В струе кислорода сгорает без копоти и даёт пламя очень высокой температуры 2800°С. Ацетиленово - кислородное пламя применяют в автогенной сварке и резке металлов.
Получение
- Карбидный способ. Его получают действием воды на карбид кальция СаС 2:
СаС 2 +2H2O → Ca(OH) 2 + С2Н2
Полученный этим способом ацетилен имеет неприятный запах из-за примесей в техническом карбиде кальция. Чистый ацетилен без запаха.
- Термический крекинг углеводородов:
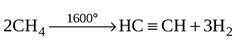
Применение
Ацетилен служит исходным материалом для получения уксусной кислоты, получают синтетический хлоропреновый каучук. Развито производство ацетилена из природного газа метана. Это гораздо дешевле, чем из карбида кальция. Препятствием для широкого применения ацетилена является его взрывоопасность. При соединении с воздухом образуется взрывчатая смесь. С металлами - твёрдые взрывчатые соединения.
Ход работы:
ОПЫТ №1. Получение этилена
1.1. Получите готовую реакционную смесь у учителя. Соберите прибор для получения газов.
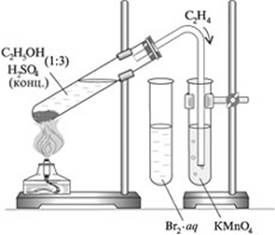
Осторожно, равномерно нагрейте смесь.
Внимание!!!






