43. ПОЛИТРОПТЫҚ ПРОЦЕСТЕР. ПОЛИТРОПТЫҚ ПРОЦЕСТІҢ НЕГІЗГІ СИПАТТАЛАРЫ. Политроптық процесс деп – жүйенің физикалық күйінің өзгеруінде газдың жылу- сыйымдылығы тұрақты сақталатын термодинамикалық процесті айтады. Егер барлық термодинамикалық процестер турақты жылусыйымдылықта өтетін болса, онда олар жеке кездейсоқ политропты процесс болады.Политропты прцесс түсініктемелері, көбінесе жылу және газды двигательдердің, компрессолардың сығылу және улғаю жұмыстық процестерін оқып үйренуде қолданылады.Кезкелген еркін процесті Р, V координатында (кіші учаскелі) төмендегі теңдікпен анықтайды.Р Vn=idem, (1.4.19)n – политроп көрсеткіші. Оның сандық мәні - ∞ пен + ∞ аралығында болуы мүмкін, бірақ көрсетілген процесс үшін ол тұрақты шама болады.Политроп теңдеуі 1.4.19 адиабаттық теңдеуден айырмашылығы n-көрсеткіші, сондықтан барлық қатыныстағы негізгі параметрлерін адиабаттық процесіндегі формулаларымен анықтауға болады (1.4.14)-(1.4.18), бірақ адиабат көрсеткіштерінің К орнына политроп көрсеткіштерін n-ді қабылдау керек.Политроп көрсеткіші n және полтироп процесінің жылусыйымдылығы Сn төмендегіше анықталады;n=  ,(1.4.20)осыдан Сn=Cv*
,(1.4.20)осыдан Сn=Cv*  (1.4.21) .Политроп процесінің жылусыйымдылығы және оның полтроптық көрсеткішке n тәуелділігі. Процесс өтіп жатқан кезде алып келінген (немесе алып кетілген) жылудың мөлшерін термодинамиканың бірінші заңының теңдеуін қолданып анықтауға болады.q=Cn(Т2-Т1)=Сv
(1.4.21) .Политроп процесінің жылусыйымдылығы және оның полтроптық көрсеткішке n тәуелділігі. Процесс өтіп жатқан кезде алып келінген (немесе алып кетілген) жылудың мөлшерін термодинамиканың бірінші заңының теңдеуін қолданып анықтауға болады.q=Cn(Т2-Т1)=Сv  ,(1.4.22)мұндағы Сn – политроп процесіндегі идеал газдың жылусыйымдылығын көрсетеді.(1.4.2.1) теңдеуі политроп процесіндегі жылусыйымдылығының мөлшерін анықтайды. Егер (1.4.21) және (1.4.19) теңдеулеріне n-нің мәнін қойсақ онда жылусыйымдылық мөлшерін анықтауға болады (изохоралық, изобарлық, изотермалық, адиабатты процестер үшін).Политроптық процесс барлық негізгі термодинамикалық процестердің бірлігін анықтайды:Изохоралық процесс үшін n=
,(1.4.22)мұндағы Сn – политроп процесіндегі идеал газдың жылусыйымдылығын көрсетеді.(1.4.2.1) теңдеуі политроп процесіндегі жылусыйымдылығының мөлшерін анықтайды. Егер (1.4.21) және (1.4.19) теңдеулеріне n-нің мәнін қойсақ онда жылусыйымдылық мөлшерін анықтауға болады (изохоралық, изобарлық, изотермалық, адиабатты процестер үшін).Политроптық процесс барлық негізгі термодинамикалық процестердің бірлігін анықтайды:Изохоралық процесс үшін n=  , Cn= Cp, V=idem. Изобарлық процесс үшін n=0, Cn= KCv= Cp, P=idem.Изотермалық процесс үшін n=1, Cn=
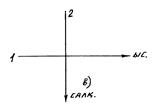
, Cn= Cp, V=idem. Изобарлық процесс үшін n=0, Cn= KCv= Cp, P=idem.Изотермалық процесс үшін n=1, Cn=  , VP=idem.Адиабаттық процесс үшін n=k, Cn= 0= Cq PVk=idem.1.13 – суретте PV – диаграммасында n- көрсеткішіне байланысты политроптық процестердің орналысуы және олардың бір нүктеден шығатыны (таралғаны) көрсетілген
, VP=idem.Адиабаттық процесс үшін n=k, Cn= 0= Cq PVk=idem.1.13 – суретте PV – диаграммасында n- көрсеткішіне байланысты политроптық процестердің орналысуы және олардың бір нүктеден шығатыны (таралғаны) көрсетілген 
44. Политроптық процестерді P,U; T,S диаграммаларында бейнелеу
Политроптық процесс деп – жүйенің физикалық күйінің өзгеруінде газдың жылу- сыйымдылығы тұрақты сақталатын термодинамикалық процесті айтады. Егер барлық термодинамикалық процестер турақты жылусыйымдылықта өтетін болса, онда олар жеке кездейсоқ политропты процесс болады. Кезкелген еркін процесті Р, V координатында (кіші учаскелі) төмендегі теңдікпен анықтайды. Р Vn=idem, n – политроп көрсеткіші. Оның сандық мәні - ∞ пен + ∞ аралығында болуы мүмкін, бірақ көрсетілген процесс үшін ол тұрақты шама болады. 1 – суретте PV – диаграммасында n- көрсеткішіне байланысты политроптық процестердің орналысуы және олардың бір нүктеден шығатыны (таралғаны) көрсетілген


45. ЖЫЛУ АЛМАСТЫРУШЫ АППАРАТТАРДЫҢ ТҮРЛЕРІ ЖАНЕ СХЕМАЛАРЫ.Жылу алмасу аппараттары – бір ортадан екінші ортаға (сұйық және газ) жылуды тасымалдау үшін қолданылатын құрылғы.Жылу тасымалдау үшін, қолданылатын жылу аппараттарына, әртүрлі қазандарда қолданылатын серпімділік сүйықтар әртүрлі аралық қысымда және температурада қолданылады; су буы, ыстық су, жанған отын өнімі, май, әртүрлі тұзды ертінділер мен сүйық қоспалар т.б.Жылу алмасу аппараттарына бу қазандары, су және ауа қыздыратын пештер, конденсаторлар, радиаторлар т.б. жатады. Жылу алмасу аппараттары жұмыс істеу принциптеріне қарай рекуперативті, регенеративті және араластырғыш болып бөлінеді. Атқаратын қызметіне қарай жылу алмасу аппараттары қыздырғыш және салқындатқыш ретінде пайдаланады. Жылу алмастырғыштар әртүрлі өндірістік технологиялық процесстерде, жылыту жүйелерінде, іштен жану қозғалтқыштарында, әртүрлі үрмелі поршенді қозғалтқыштардың үрмелі ауаларын салқындату үшін, газтурбиналы қозғалтқыштардың қыздыру және салқындату жүйелерінде, майлау және салқындату жүйелеріндегі радиаторларда, экономайзерде, бу қыздырғыштарда, конденсаторда, бу күшті қондырғыларының қыздырғыштарында өте кеңінен қолданылады.Рекуперативті аппараттар деп – жылудың бір жылу тасымалдағыштан (ыстық) басқа салқын жылу тасымалдығышқа өзара бөлгіш қатты қабырға арқылы іске асатынын айтады.Регенераторлы аппараттар деп – жылу тасымалдығыштар арқылы қатты дененің беті не жылынатынды немесе салқындатылатынды айтады. Ыстық жылуды тасымалдағыш, өзінің жылуын қатты денеге береді (жинақтаушы құрылғы), содан кейін қатты дененің алған жылуы екінші салқын жылутасымалдағышқа беріліп салқындатылады. Мысал ретінде, мұндай регенеративті аппараттарда металлургия және шыны өнеркәсібтерінде қолданылатын пештерде және газ турбиналы қондырғыларда ауаны жылытушы жатады.Аралыстырғыш жылу алмастырғыштарда жылу, ыстық тасымалдағыштардан салқын тасымалдағыштарға беріледі, соның нәтижесінде бір-бірімен жанасады және араласады. Мысал ретінде, бұларға жататындар аралыстырғыш конденсаторлар, градирлі және скрубберлі жылу алмастырғыштар.Техникада көбінесе рекуперативті жылу алмастырғыштар қолданылады.Жылу алмастырғыштардың қандайда, түрі болмасын, олар үшін қолданылатын жылулық есептеулер бірдей тәсілмен жүргізіледі.Жылу алмастырғыш аппараттарда сұйықтықтың қозғалысы негізінен мына үш схема түрінде іске асады, (2.6 – сурет а,б,в) тура ағындылық, кері ағындылық және қиылысты ағындылық. 

 Тура ағындылық (2.6, а-сурет) – жылу алмастырғыштағы екі жылу тасымалдағыштың (ыстық және салқын) қозғалысы бір-бірімен параллель бағытта болады. Кері ағындылық (2.6, б-сурет) – жылуалмастырғыштағы екі жылу тасымалдағыштың қозғалысы бір-бірімен қарама қарсы бағытта болады.Қиылысты ағындылық (2.6, в-сурет) – жылу алмастырғыштағы екі жылу тасымалдағыштың қозғалысы бір-біріне перпендикуляр бағытта болады.Іс-жүзінде жылу тасымалдағыштардың қозғалыстарының қарапайым схемаларынан басқа, күрделі қозғалыс схемалары да қолданылады: бір уақытта тура ағынды және кері ағынды қозғалыстар (2.7, а-сурет); көп қатарлықиылысты ағындылық (2.7, б-сурет).
Тура ағындылық (2.6, а-сурет) – жылу алмастырғыштағы екі жылу тасымалдағыштың (ыстық және салқын) қозғалысы бір-бірімен параллель бағытта болады. Кері ағындылық (2.6, б-сурет) – жылуалмастырғыштағы екі жылу тасымалдағыштың қозғалысы бір-бірімен қарама қарсы бағытта болады.Қиылысты ағындылық (2.6, в-сурет) – жылу алмастырғыштағы екі жылу тасымалдағыштың қозғалысы бір-біріне перпендикуляр бағытта болады.Іс-жүзінде жылу тасымалдағыштардың қозғалыстарының қарапайым схемаларынан басқа, күрделі қозғалыс схемалары да қолданылады: бір уақытта тура ағынды және кері ағынды қозғалыстар (2.7, а-сурет); көп қатарлықиылысты ағындылық (2.7, б-сурет). 

46. Дененің күйінің термиялық (температуралық) және калориялық (жылулық) теңдеулері Айналымдық процестерәдістерін қолдана отырып, термодинамиканың екінші заңынан екі фазалық жүйе үшін Клапейрон-Клаузиус теңдеуін табуға болады.  мұндағы r -фазалық өтудегі жылу (бу түзу жылулығы). (1.5.4) теңдеуі заттың фазалық өзгеруіндегі термиялық және калориялық шамалардың арасындағы байланысты көрсетеді. dT dP/ шамасы фазалық ауысудағы қысымның температура бойынша өзгеруі. Меншікті көлемдердің айырмашылығы оң немесе теріс мәндер болуы мүмкін.
мұндағы r -фазалық өтудегі жылу (бу түзу жылулығы). (1.5.4) теңдеуі заттың фазалық өзгеруіндегі термиялық және калориялық шамалардың арасындағы байланысты көрсетеді. dT dP/ шамасы фазалық ауысудағы қысымның температура бойынша өзгеруі. Меншікті көлемдердің айырмашылығы оң немесе теріс мәндер болуы мүмкін.
47. Отындардың жіктелуі, элементарлық құрамдары және олардың сипаттамалары.
Отындарың жіктелуі және олардың негізгі сипаттамалары. Отынның элементарлық құрамы. Отын деп – жанатын затты және одан бөлінетін жылуды тиімді мақсатта пайдалануды айтады. Отынның жалпы сипаттамасына, отының шығу тегі, агрегаттық күйі, химиялық құрамы және отын жанған кезде бөлінетін жылу мөлшері жатады. Отынды негізінен жоғарыда айтылғандай шығу тегімен агрегет күйіне байланысты жіктейді. Осыған байланысты отынның барлық түрлерін табиғи және жасынды деп бөледі. Табиғи қатты отынға (ағаш, торф, қоңыр және таскөмір, антрациттер, жанғыш сланецтер), сұйық отынға (мұнай) және газ тәріздес отынға (табиғи газдар) жатады. Жасанды қатты отынға (ағаш, көмір, қорытылған қалдықтар, кокс, көмір шаңы), сұйық отынға мұнай өнімдері (бензин, керосин, мазут, спирт және т.б.) және газ тәріздес жасанды отынға (кокстық, домендық, жанғыш генраторлы, қурғақ айдалған газдар, қосымша газдар және т.б.) Ядролық отындар реакция кезінде атомдық ядерлер бөлініп изотоптың ауыр элементтерін құрайды (табиғи уран U235, жасанды U233 және плутоний Рu239) осыған байланысты олар табиғи отындарға қарағанда миллион есе артық жылу бөліп шығарады. Қатты және суйық отындардың құрамында көміртегі С, сутегі Н, ұшатын күкірт Sұ және жанбайтын заттар-оттегі, ауа, азот N, күл А, ылғал W. Меншіктк жану жылу (Дж/кг) – белгілі мөлшердегі отынның толық жанған кездегі жылу бөлінуінің шамасы. Отынның жану жылулығын, отынның элементарлық құрамын аналитикалық жолмен немесе тәжірибелік жодармен анықтауға болады. Отынның жану жылуылығы жоғарғы және төменгі жану жылылуқ деп бөледі.
48. ЭНТРОПИЯ ЖӨНІНДЕ ТҮСІНІКТЕМЕ. ЭНТРОПИЯНЫҢ ҚАЙТЫМДЫ ЖӘНЕ ҚАЙТЫМСЫЗ ПРОЦЕСТЕРДЕГІ ӨЗГЕРУІ. Энтропия – термодинамикалық жүйенің күйінің функциясы және дененің термиялық (жылулық) энергиясының өзгеруі түрінде жылу мен абсолюттік температура арасындағы өз-ара байланысты бейнелейді. Энтропия – кейбір күй функция мәнін көрсетеді және дененің күйіне байланысты оның бастапқы және соңғы күйінін өзгеруіне тәуелді екенін анықтау үшін қолданылады. Ол денені абсолюттік температурасы Т-мен термиялық (жылу) энергиясы dq арасындағы жылулық байланысты көрсетеді. dq/T мәні газдың тепе-тең өзгеруінде, бұл кейбір функция күйінің толық дифференциалы, себебі сол дененің күйіне тәуелді болады.Бұл функция 1 кг газ үшін, S арқылы белгіленіп, Дж/(кг*К) мен өлшенеді және оны энтропия деп атайды.(Энтропия терминін Р. Клаузиус 1865 ж. енгізген) Онда, осы 1.3.3 теңдеуінен мынаны аламыз dS  ,(1.3.4) мұндағы ”=” белгісі қайтымды процесті ал, “>” – белгісі қайтымсыз процесті, S-энтропияны көрсетеді. Сонымен қатар (1.3.4) теңдеуі, энтропия арқылы жазылған термодинамиканың екінші заңының аналитикалық түрі. Энтропияның болу және өсу принципі – бұл термодинамиканың екінші заңының физикалық мағынасын береді. Энтропияың қайтымды және қайтымсыз процестердегі өзгеруін қарастырамыз:а) Энтропияның қайтымды процестегі өзгеруін оқшауланған (адиабатты) жүйеде (dq=0) қарастырайық. Онда (1.3.4) теңдеуі адиабатты жүйеде қайтымды процестер үшін мына түрде қабылданады. dq=Т.dS=0, (1.3.5)немесе dS=0; S=const Сонымен оқшауланған адиабатты қайтымды процестерде энтропия өзгермейді. б) Энтропияның қайтымсыз процестегі өзгерүін қарастырамыз.Бұл жағдайда (1.3.4.) теңдеу қайтымсыз процестері үшін мына түрде қабылданады dS>0 немесе S2-S1>0, (1.3.6)демек энтропия өседі. Сонымен энтропия қайтымды процестерде оқшауланған жүйеде турақты болып қалады да, ал қайтымсыз процестерге өседі. Шыныда барлық нақты процестер қайтымсыз, сондықтан оқшауланған жүйелерде энтропия барлық уақытта көбейеді, олай болса қайтымсыз (нақты) процестер барлық уақытта энтропияның өсуіне байланысты өтеді. Сонымен оқшауланған жүйеде (dq=0) болуы, энтропияның өсу принципін немесе термодинамиканың екінші заңының жалпы түрін көрсетеді. Термодинамиканың екінші заңының физикалық мәніде, осы энтропияның оқшауланған жүйеде өсу принципін белгілеу (анықтау). Сонымен энтропияның өзгеруіне қарай нақты процестің қандай бағытта өтетінін айтуға болады. Термодинамиканың екінші заңының мағынасы бойынша барлық нақты процестерде энтропия өсуі сөзсіз.
,(1.3.4) мұндағы ”=” белгісі қайтымды процесті ал, “>” – белгісі қайтымсыз процесті, S-энтропияны көрсетеді. Сонымен қатар (1.3.4) теңдеуі, энтропия арқылы жазылған термодинамиканың екінші заңының аналитикалық түрі. Энтропияның болу және өсу принципі – бұл термодинамиканың екінші заңының физикалық мағынасын береді. Энтропияың қайтымды және қайтымсыз процестердегі өзгеруін қарастырамыз:а) Энтропияның қайтымды процестегі өзгеруін оқшауланған (адиабатты) жүйеде (dq=0) қарастырайық. Онда (1.3.4) теңдеуі адиабатты жүйеде қайтымды процестер үшін мына түрде қабылданады. dq=Т.dS=0, (1.3.5)немесе dS=0; S=const Сонымен оқшауланған адиабатты қайтымды процестерде энтропия өзгермейді. б) Энтропияның қайтымсыз процестегі өзгерүін қарастырамыз.Бұл жағдайда (1.3.4.) теңдеу қайтымсыз процестері үшін мына түрде қабылданады dS>0 немесе S2-S1>0, (1.3.6)демек энтропия өседі. Сонымен энтропия қайтымды процестерде оқшауланған жүйеде турақты болып қалады да, ал қайтымсыз процестерге өседі. Шыныда барлық нақты процестер қайтымсыз, сондықтан оқшауланған жүйелерде энтропия барлық уақытта көбейеді, олай болса қайтымсыз (нақты) процестер барлық уақытта энтропияның өсуіне байланысты өтеді. Сонымен оқшауланған жүйеде (dq=0) болуы, энтропияның өсу принципін немесе термодинамиканың екінші заңының жалпы түрін көрсетеді. Термодинамиканың екінші заңының физикалық мәніде, осы энтропияның оқшауланған жүйеде өсу принципін белгілеу (анықтау). Сонымен энтропияның өзгеруіне қарай нақты процестің қандай бағытта өтетінін айтуға болады. Термодинамиканың екінші заңының мағынасы бойынша барлық нақты процестерде энтропия өсуі сөзсіз.
49. Энтропияның өсу принципімен термодинамиканың 2-ші заңының физикалық маңызы Энтропия – кейбір күй функция мәнін көрсетеді және дененің күйіне байланысты оның бастапқы және соңғы күйінін өзгеруіне тәуелді екенін анықтау үшін қолданылады. Ол денені абсолюттік температурасы Т-мен термиялық (жылу) энергиясы dq арасындағы жылулық байланысты көрсетеді. Энтропияның болу және өсу принципі – бұл термодинамиканың екінші заңының физикалық мағынасын береді. Энтропияың қайтымды және қайтымсыз процестердегі өзгеруін қарастырамыз: а) Энтропияның қайтымды процестегі өзгеруін оқшауланған (адиабатты) жүйеде (dq=0) қарастырайық. Онда (1.3.4) теңдеуі адиабатты жүйеде қайтымды процестер үшін мына түрде қабылданады. dq=Т.dS=0, (1.3.5) немесе dS=0; S=const Сонымен оқшауланған адиабатты қайтымды процестерде энтропия өзгермейді. б) Энтропияның қайтымсыз процестегі өзгерүін қарастырамыз.Бұл жағдайда (1.3.4.) теңдеу қайтымсыз процестері үшін мына түрде қабылданады dS>0 немесе S2-S1>0, (1.3.6) демек энтропия өседі. Сонымен энтропия қайтымды процестерде оқшауланған жүйеде турақты болып қалады да, ал қайтымсыз процестерге өседі. Шыныда барлық нақты процестер қайтымсыз, сондықтан оқшауланған жүйелерде энтропия барлық уақытта көбейеді, олай болса қайтымсыз (нақты) процестер барлық уақытта энтропияның өсуіне байланысты өтеді. Сонымен оқшауланған жүйеде (dq=0) болуы, энтропияның өсу принципін немесе термодинамиканың екінші заңының жалпы түрін көрсетеді. Термодинамиканың екінші заңының физикалық мәніде, осы энтропияның оқшауланған жүйеде өсу принципін белгілеу (анықтау).
Сонымен энтропияның өзгеруіне қарай нақты процестің қандай бағытта өтетінін айтуға болады.Термодинамиканың екінші заңының мағынасы бойынша барлық нақты процестерде энтропия өсуі сөзсіз.
50. Қазіргі замандағы барабанды (атанақты) және тура ағынды қазанды қондырғылардың схемаларымен жұмыс істеу принциптері Көмірмен жанатын атанақты түрлі табиғи айналыммен жұмыс жасайтын қазан схемасы 3.1-суретте келтірілген
 Атанаққа (барабанға) суды берместен бүрын су экәномайзеріде қыздырылады.Құрғақ ыстық бу,бу қыздырғышқа келеді, кейін тұтынушыларға жіберіледі. Қазанды агрегаттарың негізгі элементтеріне мыналар жатады: Оттық - отынның химиялық энергиясын жанған өнімнің жылу энергиясына айналдыратын қурылығы. Су экономайзері-қазанға келетін суды жанған отынның өнімімен қыздыратын немесе жартылай буландыратын құрылғы. Ауа қыздырғыш - қазанның оттығына берместен бұрын, жанған оттынның өнімімен ауаны қыздыратын қурылғы. Қазан агрегаттарының жабдықтарына мыналар жатады: Қазан қаптамасы - атқаратын қызметі шығатын жылудың шығынын азайту және газдың тығыздығын қамтамасыз ету мақсатында, отқа төзімділік және жылуды оқшаулашы қоршау жүйесі. Арматура және гарнитура – қазан агрегаттарын пайдалану және оларға қызмет ету үшін, арналған құрылығы. Қазанды қондырғыларының қосымша жабдықтарына мыналар жатады: отын дайындайтын құрылғы, отын беру, қатты отындарды жаққанда қолданылатын күл ұстағыш және күл тұтқыш жүйелер, сумен қамтамасың ететін қондырғылар,үрлегіш желдеткіштер,түтін тартқыш қондырғылар,жылуды бақылаушы приборлар және автоматты түрде басқаратын қондырғылар.
Атанаққа (барабанға) суды берместен бүрын су экәномайзеріде қыздырылады.Құрғақ ыстық бу,бу қыздырғышқа келеді, кейін тұтынушыларға жіберіледі. Қазанды агрегаттарың негізгі элементтеріне мыналар жатады: Оттық - отынның химиялық энергиясын жанған өнімнің жылу энергиясына айналдыратын қурылығы. Су экономайзері-қазанға келетін суды жанған отынның өнімімен қыздыратын немесе жартылай буландыратын құрылғы. Ауа қыздырғыш - қазанның оттығына берместен бұрын, жанған оттынның өнімімен ауаны қыздыратын қурылғы. Қазан агрегаттарының жабдықтарына мыналар жатады: Қазан қаптамасы - атқаратын қызметі шығатын жылудың шығынын азайту және газдың тығыздығын қамтамасыз ету мақсатында, отқа төзімділік және жылуды оқшаулашы қоршау жүйесі. Арматура және гарнитура – қазан агрегаттарын пайдалану және оларға қызмет ету үшін, арналған құрылығы. Қазанды қондырғыларының қосымша жабдықтарына мыналар жатады: отын дайындайтын құрылғы, отын беру, қатты отындарды жаққанда қолданылатын күл ұстағыш және күл тұтқыш жүйелер, сумен қамтамасың ететін қондырғылар,үрлегіш желдеткіштер,түтін тартқыш қондырғылар,жылуды бақылаушы приборлар және автоматты түрде басқаратын қондырғылар.
51.Есеп
52. Политроп процесінің жылусыйымдылығы және оның полтроптық көрсеткішке n тәуелділігі. Процесс өтіп жатқан кезде алып келінген (немесе алып кетілген) жылудың мөлшерін термодинамиканың бірінші заңының теңдеуін қолданып анықтауға болады.q=Cn(Т2-Т1)=Сv  ,(1.4.22)мұндағы Сn – политроп процесіндегі идеал газдың жылусыйымдылығын көрсетеді.(1.4.2.1) теңдеуі политроп процесіндегі жылусыйымдылығының мөлшерін анықтайды. Егер (1.4.21) және (1.4.19) теңдеулеріне n-нің мәнін қойсақ онда жылусыйымдылық мөлшерін анықтауға болады (изохоралық, изобарлық, изотермалық, адиабатты процестер үшін).Политроптық процесс барлық негізгі термодинамикалық процестердің бірлігін анықтайды:Изохоралық процесс үшін n=
,(1.4.22)мұндағы Сn – политроп процесіндегі идеал газдың жылусыйымдылығын көрсетеді.(1.4.2.1) теңдеуі политроп процесіндегі жылусыйымдылығының мөлшерін анықтайды. Егер (1.4.21) және (1.4.19) теңдеулеріне n-нің мәнін қойсақ онда жылусыйымдылық мөлшерін анықтауға болады (изохоралық, изобарлық, изотермалық, адиабатты процестер үшін).Политроптық процесс барлық негізгі термодинамикалық процестердің бірлігін анықтайды:Изохоралық процесс үшін n=  , Cn= Cp, V=idem. Изобарлық процесс үшін n=0, Cn= KCv= Cp, P=idem.Изотермалық процесс үшін n=1, Cn=
, Cn= Cp, V=idem. Изобарлық процесс үшін n=0, Cn= KCv= Cp, P=idem.Изотермалық процесс үшін n=1, Cn=  , VP=idem.Адиабаттық процесс үшін n=k, Cn= 0= Cq PVk=idem.1.13 – суретте PV – диаграммасында n- көрсеткішіне байланысты политроптық процестердің орналысуы және олардың бір нүктеден шығатыны (таралғаны) көрсетілген
, VP=idem.Адиабаттық процесс үшін n=k, Cn= 0= Cq PVk=idem.1.13 – суретте PV – диаграммасында n- көрсеткішіне байланысты политроптық процестердің орналысуы және олардың бір нүктеден шығатыны (таралғаны) көрсетілген 
53. Шартты отын және отынның жану жылулығы туралы түсінік. Шартты отын - жану жылулығы 29,35 МДж/кг тең қабылданған, отын. 







